磺胺二甲基嘧啶分子印迹聚合物的吸附性能分析
2020-07-04傅桂瑜林郑忠黄志勇
傅桂瑜, 李 磊, 林郑忠, 黄志勇
(集美大学食品与生物工程学院,福建 厦门 361021)
0 引言
磺胺二甲基嘧啶(sulfadimidine,SM2)是对氨基苯磺酰胺结构类药物的一种,该类药物与对氨基苯甲酸竞争性结合二氢叶酸合成酶,进而影响细菌核蛋白合成而发挥抑菌作用。该类药具有抗菌谱广、价格低廉、性质稳定等优点,因而被广泛应用于畜牧业和水产养殖业。但当其在人体内残留量达到一定水平时,会产生“三致”作用[1],引起肝中毒、尿结石、肾衰竭或者过敏反应等[2-4]。原农业部第235 号公告《动物性食品中兽药最高残留限量》中规定,SM2在牛奶中的最高残留量为25 μg /kg。统计数据表明,牛奶中SM2残留的检出率高达20%,高于其他各类药物残留[5],因此很有必要开展食品中磺胺类药物残留的日常监测。
目前,食品中磺胺类药物的识别、检测主要还是基于高效液相色谱法(high performance liquid chromatography,HPLC)[3-4]和化学检测法[6]。HPLC法常用的前处理若采用传统的萃取方法,效率较低,而采用分子印迹聚合物(molecular imprinted polymer,MIP)作为识别材料可以提高效率。分子印迹技术 (molecular imprinted technique,MIT)又称为分子模板技术,是将印迹分子与功能单体通过共价或非共价作用形成稳定的结合位点,在一定条件下加入交联剂发生共聚反应使之形成稳定结构,最后将印迹分子从网状聚合物中去除,形成了具有对印迹分子特异性识别的三维网状结构物质[7-8]。MIT因其较高的选择性、亲和性,良好的物理、化学稳定性,较长的使用寿命,具有可检测复杂样品和微量物质的优越性,在生物医药、环境分析和食品安全方面都具有良好的发展前景。MIP本身没有检测功能,所以MIP通常被作为固相萃取填料,对靶标物进行富集后再结合其他手段检测。李玲等[9]采用本体聚合法合成了一种二甲基嘧啶的MIP,利用分子印迹固相萃取高效液相色谱连用技术检测磺胺类兽药残留,MIP对模板分子的吸附量为11.37 mg/g。该方法具有灵敏度高、准确性好等优点,但步骤繁琐,且固相萃取柱对痕量SM2的萃取效率低,不利于后续的检测分析。魏晓兵[10]制备了一种分子印迹聚合物/氧化石墨烯复合材料MIP/GO,并将其作为一种新型分子印迹固相萃取吸附剂,所制备的材料对SM2的吸附量是传统MIP吸附量的1.5倍,可以实现痕量物质的有效富集,并结合HPLC对SM2残留进行检测。以上制备的MIP固相萃取填料对靶标物具有高效识别能力,相比传统的填料,简化了前处理流程,提高了效率。但传统MIP在合成后为块状物质,还需要人工研磨或其他措施才能使用,费时费力。另外,研磨过程会造成一部分识别位点失效,且颗粒大小不均匀,吸附量不稳定[11]。因此,在保留传统MIP高效识别能力的基础上,寻找一种合成和使用过程简单的吸附材料用于SM2的选择性富集很有必要。
本文以SM2为模板分子,采用沉淀聚合法制备了一种对SM2具有特异性识别的MIP,制备方法简单,成本低廉,得到的聚合物粒径小、颗粒均匀、选择性好、吸附速度较快,并能重复利用,能作为一种SM2的富集材料。
1 材料与方法
1.1 实验材料
SM2、磺胺胍(sulfaguanidine,SG)、磺胺二甲氧嘧啶(sulfadimethoxine,SDM)、磺胺噻唑(sulfathiazole,ST)均购于上海麦克林生化科技有限公司;乙腈、甲醇、乙醇、四氢呋喃(tetrahydrofuran,HF)、乙酸、过氧化氢、浓硫酸、溴化钾均购于广东西陇科学股份有限公司;甲基丙烯酸(methacrylic acid,MAA)、乙二醇二甲基丙烯酸酯(glycol dimethacrylate,EGDMA)均购于上海阿拉丁生化科技股份有限公司;偶氮二异丁腈(azodiisobutyronitrile,AIBN)购于天津市光复精细化工研究所。以上试剂除了溴化钾是色谱纯外,其他都是分析纯。
1.2 实验仪器
紫外分光光度计(Lambda 265,上海珀金埃尔默企业管理有限公司);傅里叶红外光谱仪(Thermo Fisher scientific,IS50 FT-IR);透射电镜(日本电子株式会社,JEM-2010);真空干燥箱(上海新苗医疗企业制造有限公司,DZF-6030);恒温水浴锅(厦门亿辰科技有限公司,ZNCL-G15);纯水机(Sartorius,Comfort I)。
1.3 实验方法
1.3.1 SM2-MIP的制备
采用沉淀聚合法制备SM2-MIP。准确称取模板分子SM20.14 g,倒入100 mL的具塞圆底烧瓶中,加50 mL的乙腈溶解,加入0.17 mL的功能单体MAA,超声溶解后,4 ℃条件下静置12 h,便于氢键的充分形成。加入1.92 mL的交联剂EGDMA以及引发剂AIBN 100 mg,超声10 min后,通N210 min,脱除溶液中的氧气。加塞密封,60 ℃恒温水浴条件下反应24 h,磁力搅拌600 r/min。将制备得到的乳白色沉淀以8 000 r/min离心10 min。沉淀用V(甲醇)∶V(乙酸)=9∶1的溶液反复清洗,直到上清液中检测不到SM2为止。得到的聚合物用甲醇浸泡12 h,去除聚合物中的残留乙酸。在40 ℃条件下真空干燥6 h得到聚合物,将其研磨成粉末状,得到SM2分子印迹聚合物(SM2-MIP),密封保存,便于后续实验利用。制备空白聚合物(SM2-NIP)时,不加入SM2,其他过程与MIP制备的过程完全相同。
1.3.2 模板分子与功能单体相互作用
模板分子SM2和功能单体MAA以物质的量比为1∶4溶于乙腈中,模板分子的初始浓度为0.01 mmool/L,预聚反应12 h。采用紫外分光光度法在200~350 nm范围内扫描紫外吸收曲线。
1.3.3 动力学吸附实验
准确称取SM2-MIP/NIP 20 mg,加入到5 mL 20 mg/L的SM2溶液中(平行三组),间隔5,10,20,30,60,90,120,150 min后,将吸附体系离心,取上清液2 mL测定其紫外吸光度值,计算其吸附量Q,并作SM2-MIP的动力学吸附曲线。
1.3.4 等温吸附曲线
准确称取SM2-MIP/NIP 20 mg,分别加到5 mL的5,10,15,20,25,30 mg/L的SM2溶液中(平行三组),吸附2 h后将吸附体系离心,取上清液2 mL测定其紫外吸光度值,计算其吸附量Q,并作SM2-MIP的等温吸附曲线。
1.3.5 聚合物的吸附性能测定
在优化条件下,用制备好的SM2-MIP/NIP吸附不同质量浓度的SM2标准溶液(5~20 mg/L),并记录其相应的吸光度值变化,并计算其吸附量Q(mg/g),通过SM2的浓度C与Q作标准曲线。

1.3.6 聚合物的表征
1)红外光谱测定:分别称取1 mg的SM2-MIP/NIP 干燥粉末,与200 mg KBr均匀混合研磨,压片后用傅里叶红外光谱仪测定其红外光谱。
2)透射电镜(transmission electron microscope,TEM)形态测定:取一定量的SM2-MIP,用甲醇稀释到一定浓度,超声30 min后,取一定量的稀释液滴加到硅片上,自然晾干后喷金。用JEM-2010透射电镜表征聚合物微球的表面形貌,并用Nano Measurer 1.2对其进行粒径统计分析。
1.3.7 聚合物的选择性研究
本实验选择与SM2结构相似的SG、SDM、ST为干扰项,分别用制备好的SM2-MIP/NIP聚合物对SM2、SG、SDM、ST的标准溶液进行吸附,观察其吸光度值的变化。
2 结果与讨论
2.1 模板分子与功能单体相互作用
功能单体与模板分子相互作用力的大小决定着MIPs的选择识别能力。因此,通过分析预聚体系中二者之间的相互作用是选择功能单体最简单、快速的方法。图1为模板分子,MAA,模板分子与MAA作用的紫外吸收谱线。由图1可以看出,预聚体系的吸收值明显小于模板分子,这说明功能单体与模板分子存在着一定的相互作用。如MAA的羧基和模板的胺基可以形成较强的氢键,同时也能形成离子键。MIP对模板的高选择性主要归功于这些相互作用力。
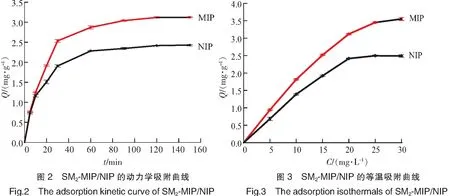
2.2 动力学吸附曲线
为了测定SM2-MIP对溶液中SM2分子吸附饱和程度随时间的变化,本实验固定SM2的质量浓度为20 mg/L,测定不同时间下的MIP/NIP吸附量,实验结果如图2所示。由图2可见,MIP和NIP的动力吸附曲线主要分为两部分,90 min以前,吸附量随着时间的推移不断增加;90 min以后吸附量逐渐趋于平稳,达到饱和状态。这是由于印迹位点有浅穴和深穴之分,在90 min以前主要以浅穴吸附为主,吸附速度较快;90 min之后以深穴吸附为主,同时由于印迹分子向深穴传质过程中受到空间位阻的作用,吸附变慢,达到饱和状态。对比MIP和NIP,两者有着同样的吸附饱和时间。
2.3 等温吸附曲线
以聚合物的吸附量Q对吸附溶液的初始浓度C作图,得到MIP/NIP的等温吸附曲线,如图3所示。由图3可见,随着吸附浓度的增大,MIP的吸附量随之增加,当吸附液质量浓度达到25 mg/L时,MIP吸附量达到平衡。这是由于在合成聚合物的过程中,聚合物形成了与模板分子SM2结构相匹配的空间构型,即相应功能基团排列形成的印迹位点。这种印迹空穴对模板分子具有一定的“记忆功能”,会对模板分子进行选择性吸附。同时,NIP的吸附量随着吸附浓度的增加也随之增加,当质量浓度达到25 mg/L时吸附达到平衡。这表明聚合物除了对模板分子的特异性吸附外,还存在一定的非特异性吸附能力,这是由于聚合物表面残留的功能基团,会与模板分子形成氢键所致。MIP和NIP的吸附量差异随着浓度的增加而增加,这也充分表明了MIP的印迹空穴的存在。
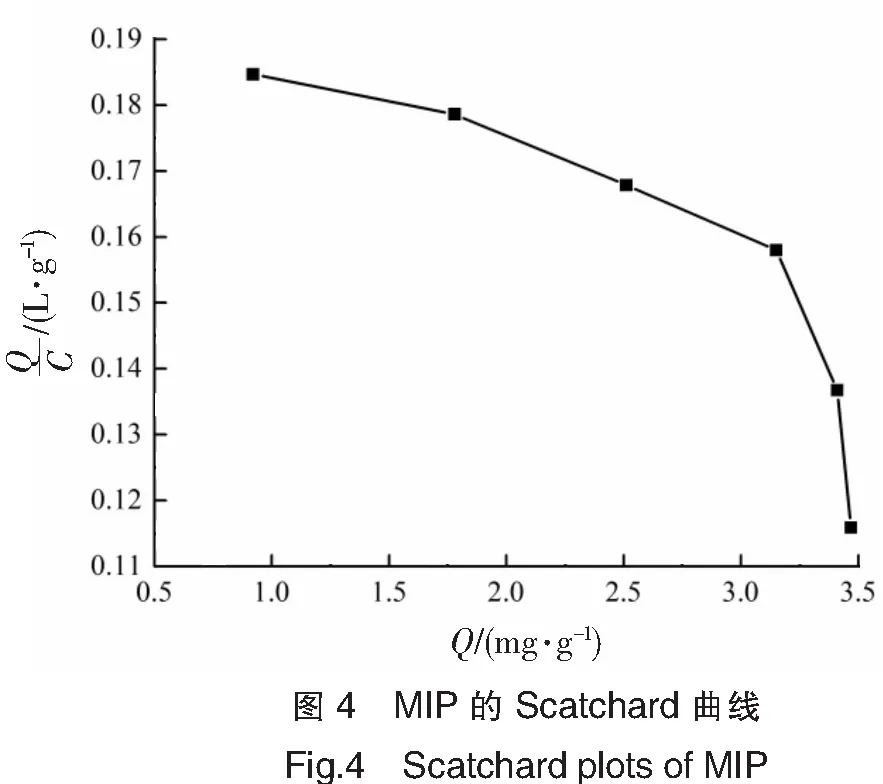
为了评价分子印迹聚合物的识别性能,用MIP对SM2的等温吸附数据作 Scatchard数据分析。Scatchard方程[12]为Q/C=(Qmax-Q)/Kd,其中:Q是MIP对SM2的吸附量(mg/g);C是SM2的平衡质量浓度(g/L);Qmax是结合位点的最大表观结合量(mg/g);Kd是结合位点的平衡解离常数(g/L)。以Q/C对Q作图,如图4,图4中分别存在2条线性关系较好的线,说明合成的聚合物存在着两类结合位点。根据斜率和截距[13]得知:聚合物对SM2的低亲和性结合位点的平衡解离常数Kd1=8.06 g/L,最大结合量Qmax1=6.62 mg/g;高亲和性位点的平衡解离常数Kd2=1.65 g/L,最大结合量Qmax2=3.86 mg/g。结合位点的形成与模板、功能单体的相互作用力有关,高亲和性结合位点可能是氢键起主要作用,而低亲和性位点可能是静电力起主要作用[14]。
2.4 聚合物的响应性
本实验通过MIP吸附不同浓度的SM2溶液,根据吸附后的吸光度值的不同,计算得到不同的吸附量Q。发现在一定质量浓度范围内(5~20 mg /L),吸附量Q与吸附的浓度C有一定的线性关系,如图5所示。并根据其相关性得到线性方程为:Q=0.145 1C+0.227 1,R2=0.997 9。
2.5 聚合物的表征

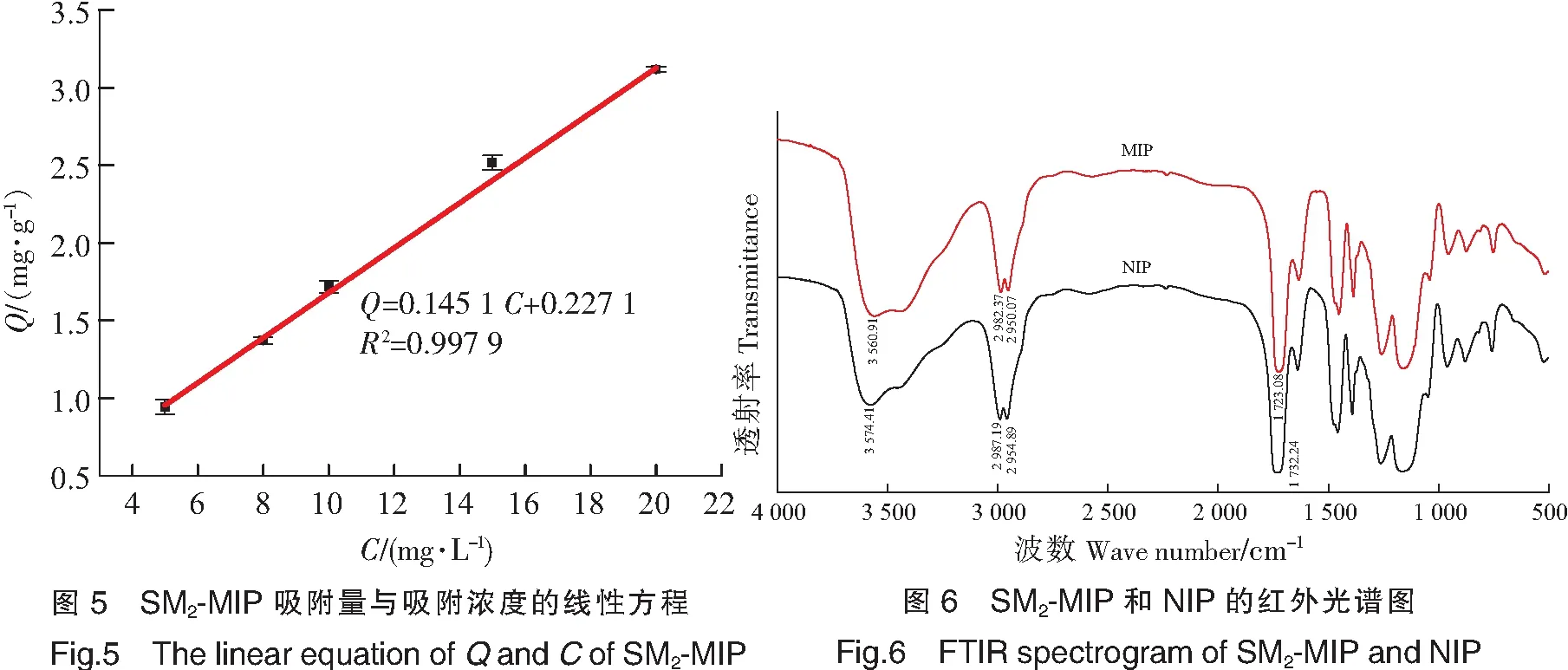
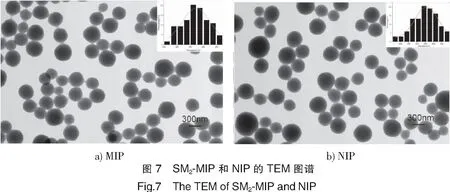
通过TEM表征,由图7可以看出,MIP聚合物微球成不规则球形,MIP平均粒径在368 nm,NIP的平均粒径在355 nm。由于笔者改进了聚合方法,提高了微球的规整性和尺寸的均匀性,这有利于提高MIP的吸附稳定性。
2.6 聚合物的选择性
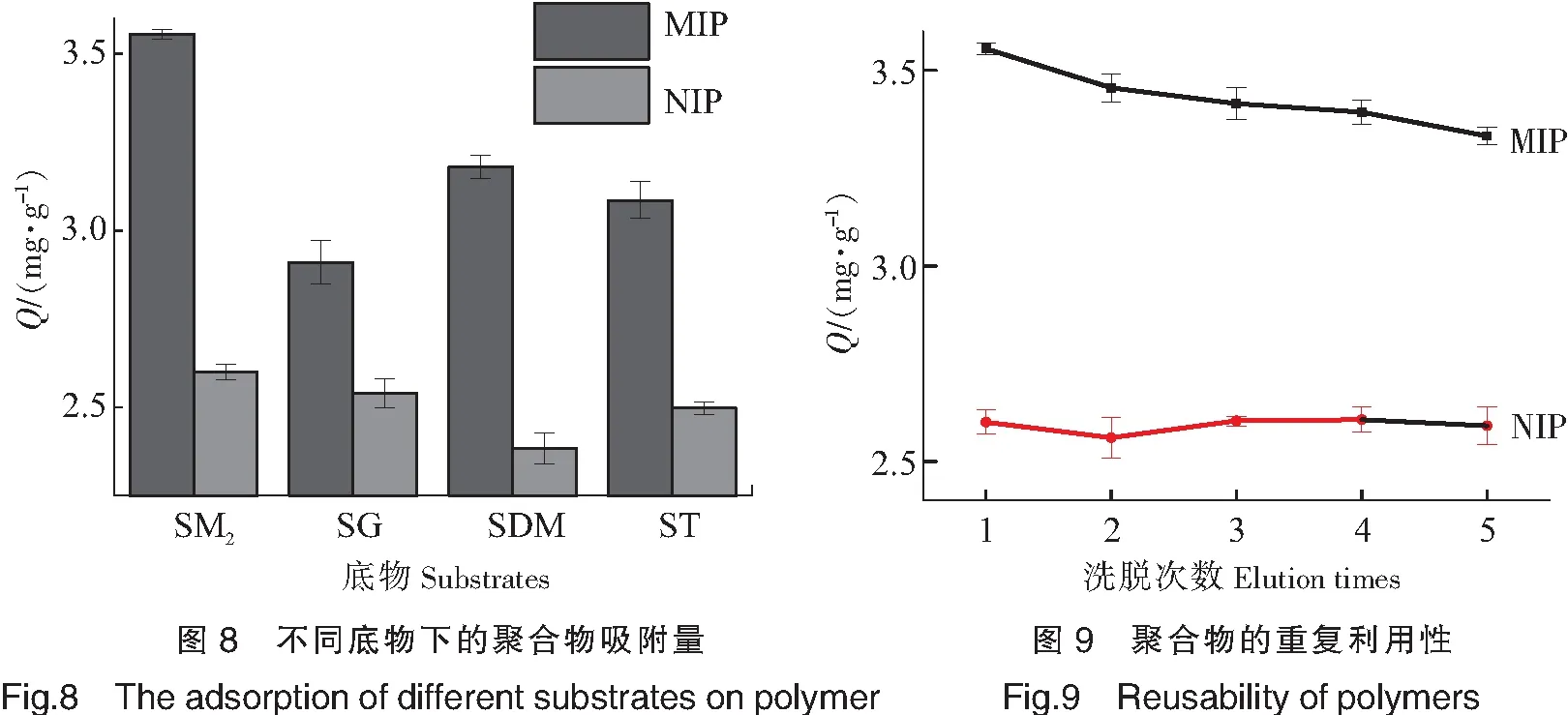
为了表明SM2-MIP对SM2的选择性吸附性能,本实验选择了4种与模板分子SM2结构相似的磺胺为底物,分别用制备好的SM2-MIP/NIP聚合物对SM2、SG、SDM、ST的25 mg/L的标准溶液进行吸附实验,测定其吸光度值,结果如图8所示。由图8可见,从吸附量Q来看,SM2-MIP对SM2的吸附量最大,对SDM、ST、SG的吸附量逐渐降低。这是由于SDM与SM2的空间构型最相似,与MIP的印迹空穴能够形成良好的互补作用[16]。ST、SG与SM2的空间构型相似度不如SDM,与印迹空穴的互补程度较差,所以吸附量较低。比较4组吸附体系,MIP与NIP均存在一定的吸附差异,表明MIP与NIP在空间结构上确实存在差异。
2.7 重复利用性
将吸附达到饱和后的MIP/NIP用V(甲醇)∶V(乙酸)=9∶1进行洗脱,直至洗脱后上清液用紫外分光光度计检测不出SM2为止。真空干燥后再次吸附25 mg/L的SM2溶液,多次重复利用后,测定其吸附能力的变化,结果如图9所示。由图9可见,SM2-MIP经过4次洗脱后,依然有良好的选择性吸附能力,但是随着洗脱次数的增加,MIP的吸附能力有所下降,可能是由于MIP的印迹空穴在洗脱过程中被破坏,导致其选择性吸附减弱。NIP在4次洗脱后,其吸附能力基本不变,这是由于其不存在印迹空穴,洗脱对其吸附能力基本没有影响。
3 结论
本文采用沉淀聚合法,以SM2为模板分子,MAA为功能单体,EGDMA为交联剂,制备了SM2分子印迹聚合物,并对其吸附性能进行了研究。结果表明,在一定浓度范围内,聚合物的吸附量Q与吸附液质量浓度C有一定的线性关系,线性方程为:Q=0.145 1C+0.227 1,R2=0.997 9。并且制备的聚合物对SM2有着良好的选择吸附性和重复利用性,洗脱5次依然具有良好的选择性。
