坛紫菜色素突变体产生原因的初步研究
2020-07-04连跃斌王文磊纪德华陈昌生谢潮添
连跃斌,许 凯,王文磊,徐 燕,纪德华,陈昌生,谢潮添
(集美大学水产学院,福建 厦门 361021)
0 引言
全球紫菜的年总产值约为20亿美元,而我国的紫菜产量位居世界第一,2017年全国的紫菜产量达17.3×104t[1],其中,坛紫菜(Pyropiahaitanensis)的产量约占全国紫菜产量的75%,产业规模巨大,经济效应可观[1]。然而,近年来随着坛紫菜养殖面积不断扩大,广大养殖户仍以传统方式进行生产,以未经选育的野生种为主要栽培品种,造成坛紫菜种质严重退化、产量降低、质量下降等问题[2]。因此,优良品种的选育势在必行。
坛紫菜叶片是四分子嵌合体,一株叶状体上最多可以有四种颜色。经过嵌合再纯化的色素突变体可作为体色标记性状,并广泛用于纯系选育。坛紫菜色素突变体在基础研究和生产实践中的应用价值日益体现。严兴洪和王素娟[3]使用秋水仙碱对坛紫菜的体细胞进行诱变处理,得到了形状细长、颜色深、生长较快的红色突变体。严兴洪[4]利用紫外线辐射,对条斑紫菜(Porphyrayezoensis)和坛紫菜的原生质体进行诱变处理,经照射后,产生的后代原生质体颜色呈红色,并出现一些生长速度更快、长宽比更小的纯红色突变体后代。有贺祐胜等[5]在条斑紫菜红色突变体的研究中表明,红色突变体与野生型比较,藻红蛋白含量高,藻蓝蛋白含量低,叶绿素a差异不大,所以藻体呈现红色。徐燕[6]通过60Co-γ射线辐射坛紫菜自由丝状体,从诱变丝状体子代中选育性状优良的色素突变体,将诱变品系和野生选育品系进行杂交,之后利用体细胞克隆技术将单一色块酶解,诱导产生丝状体进而发育为完整的紫菜叶状体,经过四代选育,最终获得了一个优良紫菜纯系新品种(闽丰1号),该品种藻体日均增重快、耐高温、藻体宽而薄且不易老化。梁艳[7]在对坛紫菜(闽丰1号)的研究中证明,叶状体的藻胆蛋白含量均极显著地高于对照组,藻胆蛋白含量是对照组的2.14倍,其中藻红蛋白含量占比较大,叶绿素a含量同样显著高于对照组。在生产中,紫菜藻体的色泽是衡量紫菜菜饼干制品品质高低的重要指标,而已有的研究结果表明紫菜的色泽主要是由其藻体中光合色素的含量和比例决定的[8]。由此可见,探究紫菜色素突变体的形成原因就显得尤为重要。
影响高等植物颜色形成的色素主要是花青素、类胡萝卜素、甜菜红素和叶绿素。然而,在藻类中影响颜色形成的色素主要是藻胆蛋白和叶绿素。光合色素(Chla、PE、PC&APC)的含量和相互之间的比例决定了紫菜的质量和藻体的颜色[9-10]。谷氨酰-tRNA还原酶(Glutamyl-tRNA reductase,hemA)是卟啉合成途径的第一个关键限速酶,能够催化谷氨酸合成5-氨基酮戊酸(5-Aminolevulinic acid,ALA)[11]。ALA可以调节Chla的合成[12-14],提高Chla和捕光系统II的稳定性[15]。例如,添加ALA可以促进小球藻(Chlorellavulgaris)和雨生红球藻(Haematococcuspluvialis)的色素合成与藻体生长[16]。姚嘉龙等[17]对拟南芥(Arabidopsis)的研究表明,hemA基因在Chla生物合成过程中表达量显著下降,说明相关酶合成减少,导致Chla合成减少。在番茄色素合成中,过剩的血红素影响细胞内色素的含量和比例,会引起色素突变[18]。在Synechococcussp.PCC7002藻蓝蛋白操纵子阅读框cpcF和cpcE中任意位点插入突变,都会产生相同表现型的突变株,相对于野生型来说这种突变株产生极少的藻蓝蛋白,而且所产生的藻蓝蛋白缺少α-84位上的藻蓝胆素[19]。小球藻的研究发现,由于突变体在叶绿素Mg2+鳌合酶基因表达缺陷,造成突变体Chla合成缺陷,最终造成小球藻Chla含量减少和藻体颜色黄化[20]。
然而,目前关于紫菜色素合成通路以及色素突变体产生的分子机理尚不清楚[21]。因此,本实验从色素合成通路出发,结合相关色素含量测定和色素合成关键基因转录水平分析,探究坛紫菜颜色形成的分子机制,为进一步理解紫菜等大型海藻的颜色形成机制提供理论依据。
1 材料与方法
1.1 实验材料
正常培养条件:温度(21±0.5)℃,光照强度50~60 μmol/(m2·s),光照周期12L∶12D,在新鲜海水中培育,每3天更换1次海水。每个样品均设置3个生物学重复。
1.2 色度值测量
从每个突变体中随机选取3株作为实验材料。藻体平摊于白色湿润瓷盘上,用CM-700d分光测色计(柯尼卡美能达,Konica Minolta 控股公司,日本)垂直于藻体,测量藻体的中部,取色度值a值和b值。a值越大表示藻体颜色越偏红色,a值越小表示藻体颜色越偏绿色;b值越大表示藻体颜色越偏黄色,b值越小表示藻体颜色越偏蓝色。
1.3 叶绿素和藻胆蛋白的测定
1.3.1 叶状体藻胆蛋白含量的测定
藻胆蛋白含量测定,参照文献[22]:1)分别取6份在生长旺期冰冻保存的叶状体藻体,将其中3份藻体称取鲜重(WF)后置于105 ℃烘箱中干燥2 h,再称取干重(WD),测定藻体的含水率(WC);2)取另3份藻体在避光环境中,在倒有液氮的研钵中充分研磨至粉末状,将粉末倒入50 mL冻存管中,分别加入适量的0.05 mol/L磷酸钠缓冲液(pH=6.8)浸泡数分钟后,用磷酸钠缓冲液冲洗研钵3次以上,将冻存管中液体总体积控制在25 mL左右,用铝箔包裹避光;3)将冻存管放入-20 ℃冰箱中冷冻,待完全冰冻后,取出冻存管于室温下避光解冻,反复冻融6次以上,放入4 ℃冰箱中过夜,彻底提取藻胆蛋白;4)用300目筛绢网将研磨液过滤至50 mL离心管中,用磷酸钠缓冲液冲洗冻存管,于4 ℃、10 000 r/min离心20 min。取上清液,在锡箔纸包裹的容量瓶中定容至50 mL(V),摇匀后静置至室温;5)用分光光度计测定其在565 nm、615 nm、650 nm和730 nm波长下的OD值(A)。利用公式分别计算1 g藻体中藻红蛋白(PE)、藻蓝蛋白(PC)和别藻蓝蛋白(APC)的含量w(mg/g):
w(PE)=[0.123(A565-A730)-0.068(A615-A730)+0.015(A650-A730)]×V/[WF(1-WC)],
w(PC)=[0.162(A615-A730)-0.001(A565-A730)-0.098(A650-A730)]×V/[WF(1-WC)],
w(APC)=[0.171(A650-A730)-0.006(A565-A730)-0.004(A615-A730)]×V/[WF(1-WC)]。
1.3.2 叶状体Chla含量的测定
Chla含量测定,参照文献[23]:1)分别取6份在生长旺期冰冻保存的叶状体藻体, 将其中3份藻体称取鲜重(WF)置于105℃烘箱中干燥2 h后再称取干重(WD),测定藻体的含水率(WC);2)另取3份藻体在避光环境中,在倒有液氮的研钵中充分研磨至粉末状,将粉末倒入40 mL锡箔纸包裹的冻存管中,加入适量90%的丙酮溶液浸泡3分钟,用90%的丙酮溶液冲洗研钵3次以上,盖上瓶盖;3)在室温下,置于避光处24 h,彻底提取Chla,用300目筛绢网将研磨液过滤至50 mL离心管中,于4℃、10 000 r/min离心20 min;4)取上清液,在锡箔纸包裹的容量瓶中定容至50 mL(V),摇匀;5)用分光光度计测定其在666 nm、730 nm波长下的OD值(A),计算每克藻体中Chla的含量(mg/g),ω(Chla)=(A666-A730) ×10V/(890(WF(1-WC))。
1.4 RNA提取与转录组测序
1.4.1 RNA提取
利用E.Z.N.Z植物提取试剂盒(OMEGA,德国)提取不同颜色突变体样品RNA。
1.4.2 转录组测序
提取样品总RNA后,将完整性均好,无杂质污染的RNA样品,由深圳华大基因股份有限公司利用BGISEQ-500高通量测序平台检测,然后本研究完成后续的数据拼接组装与分析。
1.4.3 RNA-Seq测序数据的处理
测序得到的reads,通过如下步骤处理获得clean reads:1)去除含有测序接头的reads;2)去除比例大于10%的reads;3)去除低质量的reads(质量Q≤5的碱基数占整个reads的50%以上);4)获得clean reads。
1.4.4 Clean reads
使用无参转录组组装软件Trinity对clean reads进行无参考组装,得到坛紫菜Unigene。对组装出的Unigene进行长度分布、平均长度、N50、组装大小等测序指标的统计。
1.4.5 Unigene功能注释
将组装所获得的Unigene序列通过序列比对软件Blast+在7大数据库(Nr、Swissport、KEGG、GO、COG、KOG、Pfam)中进行序列比对,进而得到该Unigene的功能注释信息。
1.4.6 基因表达量的计算
根据组装结果,使用 Bowtie2 软件把每个样本的clean reads比对到Unigene,之后使用RSEM (reads per kb per million reads)计算每个样品的基因表达水平。
1.4.7 差异表达基因的筛选
对经过RSEM软件比对得到的gene read count数据,用差异表达分析软件edgeR进行分析。显著差异表达基因的筛选标准为FDR(false discovery rate)<0.05&log2|FC|>=1,F为基因表达量,C为唯一比对到基因的片段数。
1.4.8 GO和Pathway显著富集分析
首先把所有的差异基因向KEGG数据库(http:www.kegg.jp/)的各个Pathway映射,计算每个Pathway的基因数目,然后应用超几何检验,找出与整合基因组差异表达基因显著富集的Pathway。FDR≤0.05的Pathway定义为差异基因中显著富集的Pathway。
1.5 聚类分析和热图分析
本研究中,在进行表达量计算时,采用计算FPKM值(fragments per kb per million reads)表示基因的相对表达量,FPKM值的计算方法是:FPKM=106C/(NL103),N为唯一比对到参考基因的总片段数,L为基因长度。
根据基因的注释信息,选取色素合成通路上的关键基因,利用R语言gplots包(http:cran.r-project.org/web/packages/gplots/index.html)中的heatmap.2模块对这些基因的表达水平进行聚类分析。对不同颜色的6组样品在关键基因的不同表达水平作热图分析,并通过样品之间两两对照比较各基因的表达水平。
1.6 数据分析
采用SPSS软件比较数据均值,并进行单因素方差分析(ANOVA),以P>0.05为差异不显著,以P<0.05为差异显著。
2 结果
2.1 实验样品RNA的提取及质量检测
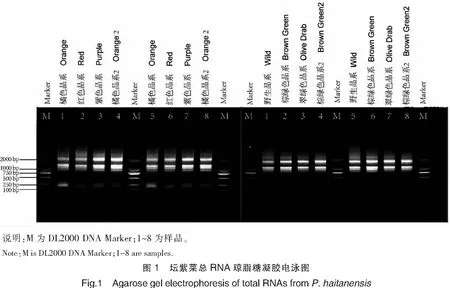
用于送测的RNA样品浓度介于500~1000 ng/μL之间,总量大于50 μg,A260/A280值在1.9~2.1之间,A260/A230值大于1.8。电泳结果(见图1)显示,所有样品条带完整、清晰、无拖尾,都具有2条 28 S,3条18 S,以及1条5 S条带。
2.2 坛紫菜不同色素突变体的色度值测定
不同色素突变体的表观颜色差异显著,从色度值可以明显看出来,不同颜色的品系的色度值区分明显。橘色品系的a值平均值最大(21.95±0.29),翠绿色品系的a值平均值最小(-6.90±0.24)。橘色品系与红色品系的a值差异不明显(P>0.05),但橘色品系明显高于紫色品系和野生品系(P<0.05);棕绿色品系明显比翠绿色品系的a值高(P<0.05)。因此,本研究将色度值相近的几个品系归为一类,分别为红黄组和绿组,红黄组包括橘色品系、红色品系、紫色品系和野生品系,绿组包括翠绿色品系和棕绿色品系(见图2A)。红黄组的a值平均为(18.66±3.50),绿组的a值平均为(-3.1±3.72),两组样的差异明显(见表1)(P<0.05)。而在b值平均值上,两组样品无明显差异(P>0.05)。

表1 红黄组和绿组的色度值统计分析
说明:上标字母不相同表示显著差异。
Note:Superscripts represent significant difference among treatments.
2.3 叶状体藻胆蛋白和Chl a的含量
在PE含量方面,红色品系含量最高,约为75 mg/g;紫色品系约为70 mg/g;橘色品系约为65 mg/g;野生品系约为50 mg/g;棕绿色品系和翠绿色品系的含量最少,分别为20 mg/g 和15 mg/g。在PC含量方面,紫色品系最多,约为27 mg/g;野生品系约为17 mg/g;棕绿色品系、翠绿色品系和红色品约为10 mg/g;橘色品系约为2 mg/g。而对于APC而言,紫色品系和野生品系的含量最高,之后依次是棕绿色品系、翠绿色品系、橘色品系和红色品系,其含量均不超过10 mg/g(见图2a)。Chla含量测定结果显示,翠绿色品系的Chla含量约为8 mg/g,显著高于其他品系(P<0.05),其中,棕绿色品系、橘色品系和野生品系约为6 mg/g,而红色品系和紫色品系含量约为4 mg/g(见图2b)。
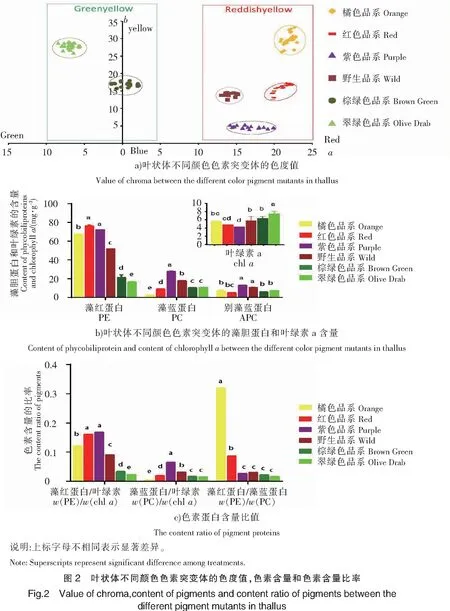
通过各品系色素蛋白含量的比值可以发现:紫色和红色品系的w(PE)/w(Chla)约为16,橘色品系的w(PE)/w(Chla)约为12,野生品系的w(PE)/w(Chla)约为9,翠绿色品系和棕绿色品系的w(PE)/w(Chla)均小于5。紫色品系的w(PC)/w(Chla)最高,约为6;橘色品系的w(PC)/w(Chla)最低,约为0.3。橘色品系的w(PE)/w(PC)最高,约为30;红色品系w(PE)/w(PC)约为8.5;紫色品系、野生品系、棕绿色品系和翠绿色品系没有显著差异,w(PE)/w(PC)都不高于5(见图2c)。
2.4 Chl a和藻胆蛋白合成关键酶的表达分析
通过相关基因表达水平的聚类分析发现,在橘色品系、紫色品系和棕绿色品系中hemA基因的表达水平较高(见图3)。在Chla和藻胆蛋白的合成通路中,谷氨酰-tRNA经由hemA等催化反应生成5-氨基酮戊酸(ALA)(见图4),之后,5-氨基酮戊酸经过催化合成原卟啉Ⅸ,再经过Mg-鳌合酶(CHLI、CHLD 和CHLH)催化生成镁原卟啉Ⅸ。在本实验中,Mg-鳌合酶在橘色品系、紫色品系和野生品系中的表达水平较高。此外,叶绿素合成酶(CHLG)是合成Chla的关键酶,镁原卟啉Ⅸ经过CHLG等一系列反应生成Chla。本研究发现,CHLG在橘色品系、红色品系、野生品系和翠绿色品系中显著上调表达。

在藻胆蛋白的合成通路中,血红素氧化酶(HMOX1)是催化血红素合成胆绿素的关键酶,原卟啉Ⅸ经过一系列反应合成血红素,血红素再经过HMOX1催化合成胆绿素。在本实验中,HMOX1在橘色品系、紫色品系、野生品系和棕绿色品系的表达水平高于其他品系。胆绿素再经过铁氧还蛋白氧化还原酶(HY2)等一系列反应催化,最终合成藻胆蛋白。而HY2在橘色品系、红色品系、野生品系和翠绿色品系中的表达水平较高。

3 讨论
本研究中,红黄组品系的平均PE含量比绿组高3.5倍,而PC和APC含量却没有显著差异。同时,红黄组的平均Chla含量显著低于绿组(P<0.05),进而造成两组藻体在颜色上的差异。张倩[24]对皱紫菜(Pyropiacrispata)色素突变体的研究数据表明,红色品系皱紫菜(PC-ZH)的PE含量明显高于其他绿颜色的皱紫菜。黄慧珍[1]也发现,坛紫菜野生品系的PE含量是翠绿色品系的十多倍。本研究中,橘色、紫色、红色和野生品系的w(PE)/w(Chla)高,其中橘色、紫色和红色藻体的w(PE)/w(Chla)大于10,翠绿色和棕色品系的w(PE)/w(Chla)小于5。在色泽的差异上,橘色、紫色、红色和野生品系a值显著大于翠绿色和棕色品系,所以橘色、紫色、红色和野生品系呈现红色,而翠绿色和棕色品系呈现绿色。
在叶绿素和藻胆蛋白合成基因的表达中(见图4),橘色品系、紫色品系和棕绿色品系的hemA相关基因的表达水平较高,说明坛紫菜藻体可能大量合成ALA,为Chla和藻胆蛋白的合成提供更多前体,有利于藻体的色素合成。李爽[25]将hemA基因克隆到pET28a载体上,并在大肠杆菌中诱导表达,通过分离纯化得到谷氨酰tRNA还原酶。重组菌发酵液上清中ALA含量达40.2 mg /L,通过过筛试验和紫外分光光度检测验证显色物质为卟啉类。
在合成通路后续反应中,镁离子鳌合酶催化合成镁原卟啉Ⅸ,镁离子鳌合酶是原卟啉Ⅸ合成镁原卟啉Ⅸ的关键酶。在色素合成通路中,镁离子鳌合酶催化镁原卟啉Ⅸ的合成,决定了通路色素合成的走向(见图4)。本研究在坛紫菜转录组中发现的CHLI、CHLD 和CHLH是镁离子鳌合酶的亚基,参与组成镁离子鳌合酶,进而参与Chla的合成。小球藻突变体的研究中CHLI、CHLD和CHLH表达水平的降低,引起突变体Chla合成缺陷,导致小球藻突变体光合作用降低,最终造成突变体藻体颜色比野生型浅[1]。在本研究中,橘色品系和野生品系的CHLI、CHLD和CHLH基因表达水平高于其他品系(见图3)。此外,通过红黄组间比较,发现橘色品系和野生品系的Chla含量较高(见图2b),说明藻体可能大量催化原卟啉Ⅸ(Protoporphyrin Ⅸ)合成镁原卟啉Ⅸ(Mg Protoporphyrin Ⅸ),进而合成Chla。在Chla合成通路中,CHLG是催化镁原卟啉合成Chla的关键酶。在盐生杜氏藻(Dunaliellasalina)[26]和茶树[27]的研究中均发现,CHLG表达水平的降低,会造成植株的黄化,生长缓慢。在本研究中,野生品系和翠绿色品系CHLG基因表达水平较高,并且野生品系和翠绿色品系的Chla含量也高(见图2b)。此外,研究发现,油菜(BrassicanapusL.)中HMOX1的表达水平高,会抑制Chla的合成,转向合成胆绿素,造成油菜失绿的现象[28]。牟钰[29]对白菜(BrassicacampestrisL.ssp.chinensis)的研究发现,血红素加氧酶在血红素代谢过程中限制了血红素的降解,使血红素含量积累,血红素积累后抑制ALA的合成,ALA合成受阻致使叶绿素合成减少,最终导致叶色变异。
而红藻在血红素氧化酶(HMOX1)和铁氧还蛋白氧化还原酶(HY2)等一系列生化反应下,催化血红素合成藻胆蛋白。Emborg等[30]发现拟南芥中血红素加氧酶发生突变,使血红素合成的光敏生色团合成受阻。同样,本研究发现红黄组藻体的HMOX1和HY2上调表达,而橘色品系、红色品系、紫色品系和野生品系的PE含量明显高于其他品系。
因此,本研究推测,HMOX1和HY2的高表达水平,可能会抑制Chla的合成,并大量合成胆绿素,最终导致藻体颜色上表现出失绿[28]。而在绿组中,棕绿色品系HMOX1的表达水平高于翠绿色品系,然而棕绿色品系在CHLG的表达水平却低于翠绿色品系,最终导致棕绿色品系的PE含量显著高于翠绿色品系(P<0.05),而Chla含量低于翠绿色品系,进而导致棕绿色品系比翠绿色品系的颜色更深。
4 结论
综上所述,红黄组品系藻体PE含量高导致w(PE)/w(Chla)高,绿组品系藻体Chla含量高导致w(PE)/w(Chla)低,从而导致红黄组品系藻体呈现红色,绿组品系藻体呈现绿色。进一步通过转录组分析发现,绿组品系藻体中,Mg-鳌合酶和叶绿素合成酶表达水平上调,合成更多Chla,使得藻体呈绿色;红黄组品系藻体中,血红素合成时血红素氧化酶和铁氧还蛋白氧化还原酶上调,催化血红素合成胆绿素,最终合成藻胆蛋白,促使藻体颜色变深,呈红黄色。本研究有助于进一步理解坛紫菜色素合成通路中关键酶的作用,为探究坛紫菜色素突变体的形成机制提供了理论依据。
