碳酸钙对凝结芽孢杆菌CGMCC 9951芽孢形成的影响
2020-07-04田晶晶李长福周艳林周子吕古绍彬
田晶晶,吴 影,2,李长福,周艳林,周子吕,古绍彬,2,3,*
(1.河南科技大学食品与生物工程学院,河南 洛阳 471023;2.河南省食品微生物工程技术研究中心,河南 洛阳 471023;3.食品加工与安全国家级实验教学示范中心,河南 洛阳 471023)
近年来,凝结芽孢杆菌(Bacillus coagulans)由于具有增加肠道原有益生菌数量[1]、治疗腹泻增强免疫[2-3]、改善肠易激综合征[4]、降低胆固醇[5]、抑制致病菌的生长[6]等益生特性,被广泛应用于食品、药品、保健、畜牧水产等[7]。该菌作为最具潜力的益生菌之一,受到国内外学者广泛关注[8]。目前,凝结芽孢杆菌已先后被美国食品与药品监督管理局、欧洲食品与饲料菌种协会和国际乳品联合会认定为一般认为安全的(generally recognized as safe,GRAS)菌种,并被列入美国农业部和美国饲料控制委员会名单。我国于2004年批准在饲料中添加,于2005年批准其作为人用整肠药物;并于2016被国家卫生健康委员会(原国家卫计委)列入《可用于食品的菌种名单》。作为新型益生菌,凝结芽孢杆菌常以芽孢形式添加。芽孢杆菌的芽孢是营养细胞的休眠体,在胃酸环境中被激活萌发后具有和营养细胞一样的益生特性,且芽孢更具有耐酸、耐胆盐、耐高温等极强的耐受特点,因此工业生产过程中芽孢比营养细胞具有更好的工业性能[9]。有研究指出,凝结芽孢杆菌芽孢在进入人体后4~6 h内即可萌发形成营养细胞,并繁殖发挥益生作用,其中能够顺利通过消化系统的芽孢高达85%[10]。
目前,关于凝结芽孢杆菌的芽孢化途径及调控机制鲜有报道,有关细菌芽孢形成机理的研究主要集中于枯草芽孢杆菌和梭状芽孢杆菌[11],且较明确的是芽孢杆菌芽孢化过程主要经历8 个阶段,其中芽孢化启动对芽孢形成至关重要,而芽孢化启动调控因子Spo0A含量及磷酸化水平则是芽孢启动与否的关键环节[12-13]。研究发现Spo0A的磷酸化是由KinA、KinB、KinC、KinD、KinE 5 种组氨酸激酶调控,组氨酸激酶种类越高,所能应答的环境刺激范围就越广[14]。磷酸化的Spo0A能够直接调控与芽孢形成相关的一系列基因的表达,如参与调控母细胞中的sigma因子(σH,σF,σE,σK,σG)表达等[15-16]。
Moeller等[17]研究发现,并不是所有芽孢杆菌的芽孢都具有同等稳定性,刺激形成的因素不同,芽孢的抗逆性也会存在差异。Olivier等[18]发现,较高温度下形成的芽孢具有更强的耐热性能;培养基中矿物质离子(Ca2+、Mn2+、Mg2+)的添加也能增加形成芽孢的耐热性能,但也降低了芽孢其他的抗逆性。芽孢杆菌在芽孢形成时,需摄入大量Ca2+,以确保生成足够的吡啶二羧酸钙,后者可使芽孢中的生命大分子物质形成稳定凝胶,从而提高其耐热性[19]。同时,Ca2+是芽孢形成过程中相关蛋白酶及蛋白水解酶重要的辅因子[20],因此能够显著促进芽孢的形成。碳酸钙还可稳定发酵液pH值,防止过酸环境对芽孢形成的影响。关于碳酸钙添加对芽孢形成及耐受性方面的研究却鲜见相关报道,本实验旨在研究凝结芽孢杆菌CGMCC 9951在碳酸钙作用下的芽孢形成情况及抗逆性,探究碳酸钙在凝结芽孢杆菌芽孢形成中的促进作用,以期为工业化生产凝结芽孢杆菌芽孢提供技术参考。
1 材料与方法
1.1 菌株与试剂
凝结芽孢杆菌CGMCC 9951为河南科技大学食品与生物工程学院微生物育种与代谢调控研究室分离保藏。
种子及发酵培养基:葡萄糖15 g,蛋白胨15 g,酵母粉10 g,硫酸镁5 g,蒸馏水1 000 mL,pH 8.0±0.05,115 ℃灭菌30 min;计数培养基:种子培养基添加2%的琼脂,115 ℃灭菌30 min。
磷酸盐缓冲液(phosphate buffered saline,PBS):称取8.0 g氯化钠、0.2 g氯化钾、0.24 g磷酸二氢钾、1.44 g磷酸氢二钠,溶解于800 mL蒸馏水中,2 mol/L氢氧化钠溶液调整pH 7.4,定容至1 000 mL混匀室温保存备用。
Trizol提取试剂盒、4S Red Plus核酸染色剂(BBI A606695)、琼脂糖、第一链cDNA合成试剂盒 (Thermo Scientific™ EP0733)、SG Fast qPCR Master Mix(High Rox) 生工生物工程(上海)股份有限公司。
1.2 仪器与设备
高速冷冻离心机 美国赛洛捷克有限公司;PH400型台式pH计 安莱立思仪器科技公司;DYY-6C型稳压稳流电泳仪 北京六一生物科技有限公司;H6-1微型电泳槽 上海精益有机玻璃制品仪器厂;FR980凝胶成像系统 上海复日科技有限公司;SMA4000微量分光光度计 美林恒通仪器有限公司;StepOne型荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪美国应用生物系统公司;PCR仪 美国Bio-Rad公司。
1.3 方法
1.3.1 种子培养
将保存在-80 ℃的甘油保藏管接种到装有30 mL种子液的250 mL三角瓶中,230 r/min、37 ℃恒温振荡培养16 h,然后将其接种于相同种子液中连续活化3 次备用。
1.3.2 摇瓶培养
将种子液以3%的接种量接到含有30 mL种子液的250 mL三角瓶中,230 r/min、37 ℃恒温振荡培养(68±2)h进行摇瓶培养。
1.3.3 活菌总数及芽孢数测定
活菌总数测定:采用稀释涂布平板计数法。将样品用0.85%无菌生理盐水逐级稀释到10-5、10-6、10-7倍,分别取100 µL稀释液均匀涂布在平板上,置于37 ℃的恒温培养48 h后观察计数。
芽孢数测定:将样品放入80 ℃水浴10 min[21],然后立即将样品置于冰水中冷却至40 ℃左右,参照活菌计数法进行涂布和培养操作,于37 ℃的恒温培养4~5 d后观察计数。
1.3.4 碳酸钙对芽孢形成的影响
1.3.4.1 碳酸钙添加时间、添加量及培养温度对芽孢形成的影响
通过考察碳酸钙不同添加时间(0、8、16、24、32 h),不同添加量(4%、5%、6%、7%、8%),及碳酸钙添加情况下不同温度培养(35、37、40、45、50 ℃)芽孢形成情况,研究添加碳酸钙对凝结芽孢杆菌CGMCC 9951芽孢形成的影响。
1.3.4.2 碳酸钙对培养过程pH值的影响
将摇瓶培养至16 h,处理组添加6%的碳酸钙,以未加碳酸钙为对照组,每隔4 h测定培养基中pH值的变化,考察添加碳酸钙对培养过程pH值的影响。
1.3.5 芽孢抗逆性测定[22]
在5 mL离心管中加入4 mL已有芽孢形成的培养液,置于80 ℃水浴10 min灭活营养细胞,用PBS清洗3 次后加入等体积PBS,4 ℃保藏备用。芽孢存活率按下式计算:

1.3.5.1 温度对芽孢抗性的影响
取制备好的芽孢悬浮液2 mL,分别放置于85、90、95、100 ℃水浴10 min,冷却后采用稀释涂布平板计数法测定存活芽孢数,以未经温度处理的芽孢悬浮液作为对照。
1.3.5.2 pH值对芽孢抗性的影响
取制备好的芽孢悬浮液2 mL,5 000 r/min离心5 min弃上清液,分别加入2 mL pH 1.5、2.0、3.0、4.0的PBS,混匀37 ℃处理1 h和2 h后采用稀释涂布平板法测定存活芽孢数,以pH 7.4的PBS中芽孢悬浮液作为对照。
1.3.5.3 胆盐对芽孢抗性的影响
将制备好的芽孢悬浮液取2 mL,5 000 r/min离心5 min去上清液,分别加入2 mL胆盐质量分数为0.03%、0.1%、0.3%、0.5%、0.7%的PBS,37 ℃孵育2 h后采用稀释涂布平板法测定存活芽孢数,以无胆盐的PBS处理为空白对照组。
1.3.6 real-time PCR检测目的基因转录水平
根据NCBI中凝结芽孢杆菌kinC(Gene ID:29813636)、kinE(Gene ID:29812950)、spo0A(Gene ID:29813832)和内参基因GAPDH(Gene ID:29813473)序列,设计并合成引物(表1),引物由生工生物工程(上海)股份有限公司合成。

表1 目的基因及GAPDH引物Table 1 Primers for target genes and GAPDH
参照UNIQ-10柱式Trizol总RNA抽提试剂盒提取总RNA。参照第一链cDNA合成试剂盒的使用方法,在PCR仪上进行反转录反应,合成cDNA产物。以此为基础,进行real-time PCR,反应体系为:20 μL的总体系中加入2×SG Fast qPCR Master Mix 10 μL,10 μmol/L的上下游引物各0.4 μL,超纯水7.2 μL,模板cDNA 2 μL。PCR循环条件:95 ℃预变性3 min;95 ℃变性3 s,60 ℃退火30 s,45 次循环。使用StepOne型荧光定量PCR仪进行反应。
1.4 数据处理
图表采用Origin软件进行绘制。采用Duncan新复极差法进行多重比较,数据通过SPSS(Version 17.0)软件进行统计分析。
2 结果与分析
2.1 添加碳酸钙对芽孢形成的影响
2.1.1 碳酸钙添加时间对芽孢形成的影响
在凝结芽孢杆菌CGMCC 9951培养到0、8、16、24、32 h,分别向盛有30 mL发酵液的250 mL三角瓶中添加6%的碳酸钙,研究其对凝结芽孢杆菌芽孢形成的影响。由图1可知,碳酸钙添加时间对芽孢形成的促进作用差异极显著(P<0.01),在16 h添加碳酸钙对芽孢形成的促进效果最好,芽孢形成量达4.05×106CFU/mL。进一步分析发现,该菌在12~16 h菌体生长逐渐进入稳定期(图2),因此在该时期加入碳酸钙既不影响细胞的生长繁殖,又有利于促进芽孢的形成。

图1 碳酸钙添加时间对凝结芽孢杆菌CGMCC 9951芽孢形成的影响Fig. 1 Effect of CaCO3 addition time on sporulation of B. coagulans CGMCC 9951
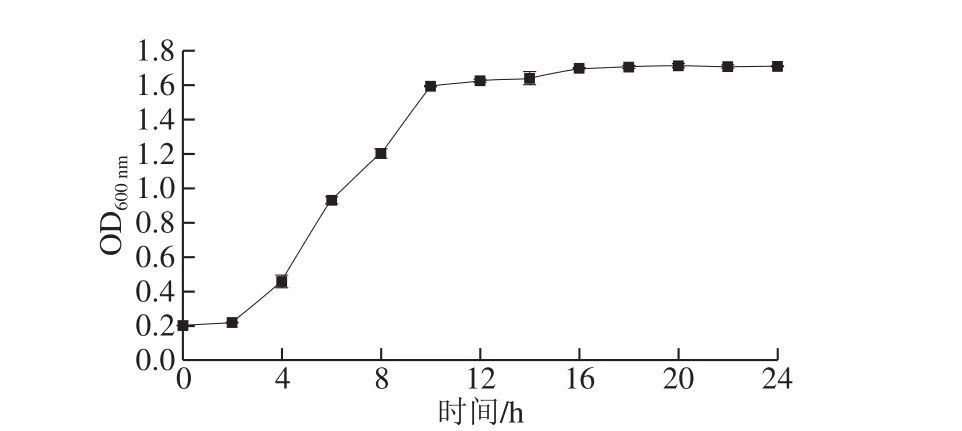
图2 凝结芽孢杆菌CGMCC 9951生长曲线Fig. 2 Growth curve of B. coagulans CGMCC 9951
2.1.2 碳酸钙添加量对芽孢形成的影响
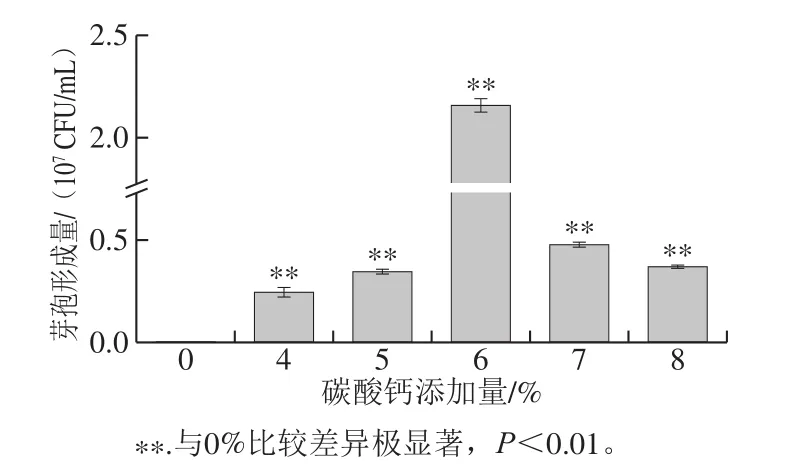
图3 碳酸钙添加量对凝结芽孢杆菌CGMCC 9951芽孢形成的影响Fig. 3 Effect of CaCO3 concentration on sporulation of B. coagulans CGMCC 9951
如图3所示,未添加碳酸钙组,在7 d后几乎观察不到芽孢的存在,碳酸钙添加对芽孢形成量却具有显著影响,且在一定范围内随着碳酸钙添加量的增加,芽孢形成量逐渐增加,当添加量为6%时芽孢形成量达到最大2.16×107CFU/mL,随着碳酸钙添加量的进一步增加,芽孢形成量开始逐渐下降。
2.1.3 培养温度对芽孢形成的影响

图4 培养温度对凝结芽孢杆菌CGMCC 9951芽孢形成的影响Fig. 4 Effect of temperature on sporulation of B. coagulans CGMCC 9951
温度是诱导芽孢形成的重要环境因子[23-24]。CGMCC 9951在37 ℃培养16 h后,将培养温度分别调整到35、40、45、50 ℃,研究在有无碳酸钙添加情况下温度对CGMCC 9951芽孢形成的影响。结果发现在无碳酸钙添加情况下,不同培养温度对凝结芽孢杆菌芽孢的形成时间和形成量的影响差异显著(P<0.05)(图4A),在40 ℃以下时,培养至7 d 仍无芽孢形成;而当培养温度达到为45 ℃时,培养3 d即可产生芽孢,当培养温度达到50 ℃时,培养7 d,芽孢形成量最大,可达到4.56×106CFU/mL。但在相同培养基中添加6%碳酸钙,培养至3 d时,各温度处理均能观察到芽孢的形成,且37 ℃处理组中芽孢数最大,可达4.53×107CFU/mL(图4B);随着温度的进一步升高,发酵液蒸发量显著增加,黏度激剧上升,水分活度降低,反而影响芽孢形成。
2.1.4 添加碳酸钙对培养基pH值的影响
碳酸钙可以调节培养基的pH值,而pH值环境对芽孢形成及活性具有显著影响。由图5A可知,16 h添加6%的碳酸钙可使培养基pH值从4快速上升到5.94,在18 h,pH值达到6.48时即可观察到芽孢形成,20 h后培养基pH值开始继续缓慢上升。而对照组培养至172 h,pH值才达到芽孢化启动中性偏碱环境。碳酸钙添加组,在70 h培养结束后pH值逐渐升高至8.18,镜检观察芽孢形成达到最大时,稀释涂布芽孢数为4.53×107CFU/mL。而无碳酸钙添加组在220 h时pH值为8.53(图5B),此时芽孢达到最大1.89×107CFU/mL。本研究结果显示碳酸钙加入能快速改善环境pH值条件,有效缩短芽孢形成时间,增加芽孢形成量。

图5 碳酸钙添加对培养基pH值的影响Fig. 5 Effect of CaCO3 concentration on pH of medium
2.2 添加碳酸钙对芽孢抗逆性的影响
理想的益生菌须具备较强抗逆性和繁殖能力,以抵抗严酷的生产加工过程以及动物体内的低酸和高胆盐环境。上述研究发现碳酸钙添加不仅可促进芽孢形成提前,且促孢效果明显,但该条件下所形成芽孢的抗逆性及是否会影响其作为益生菌使用仍需探究。为此,研究温度、pH值、胆盐对CGMCC 9951芽孢活性的影响。如图6所示,该菌在碳酸钙添加条件下形成的芽孢,经过95 ℃水浴10 min后,芽孢存活率仍能高达81.25%。

图6 温度对凝结芽孢杆菌CGMCC 9951芽孢活性的影响Fig. 6 Effect of temperature on spore activity of B. coagulans CGMCC 9951
胃酸环境是益生菌进入体内必须经历的一个关键过程,其酸耐受能力严重影响益生特性发挥。研究发现在碳酸钙添加条件下形成的芽孢具有良好的耐酸性能,而在pH 3.0处理2 h后的芽孢萌发率仍达到76.79%;同时还观察到,酸处理该芽孢还可促进其快速萌发(表2)。在相同条件下,经酸处理和未经处理的芽孢萌发情况出现明显差异,酸处理后的芽孢其萌发速度明显高于对照组,在pH 3.0处理1 h时,芽孢萌发率是对照组的1.18 倍,pH 4.0处理1 h后芽孢萌发率是对照组的1.5 倍,pH 4.0处理2 h后的其萌发率仍然达到对照组的1.48 倍。

表2 凝结芽孢杆菌CGMCC 9951芽孢在酸处理后的萌发情况Table 2 Germination rate of B. coagulans CGMCC 9951 spores under acidic conditions
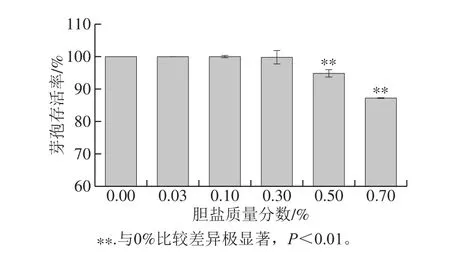
图7 胆盐对凝结芽孢杆菌CGMCC 9951芽孢活性的影响Fig. 7 Effect of bile salt concentration on spore activity of B. coagulans CGMCC 9951
研究发现,CGMCC 9951在碳酸钙添加情况下形成的芽孢,表现出较强的胆盐耐受能力,其在0.3%胆盐中处理2 h后保持99.79%的高芽孢存活率,即使在0.7%胆盐条件下,芽孢存活率仍高达87.22%(图7)。
2.3 碳酸钙对启动芽孢形成相关基因的影响

图8 碳酸钙对芽孢化启动关键基因相对表达量的影响Fig. 8 Effect of CaCO3 on the relative expression levels of key genes involved in sporulation initiation
通过对GenBank中凝结芽孢杆菌DSM 1、S-lac、HM-08、BC-HY1、2-6、36D1、B4098、GED7749B等全基因组数据,以及本研究所用的CGMCC 9951诱导芽孢前后转录组数据分析发现,凝结芽孢杆菌中仅发现了2 个可激活芽孢化启动蛋白Spo0A的组氨酸激酶,分别为KinC和KinE。凝结芽孢杆菌中kinC和kinE是否能在碳酸钙添加下大量表达,并激活Spo0A且达到芽孢化启动所需阈值,从而启动CGMCC 9951的芽孢化过程是揭示碳酸钙诱导芽孢化启动机制的关键。以凝结芽孢杆菌ATCC 7050TkinC、kinE和spo0A基因序列为基础,设计相关引物,在碳酸钙添加情况下,对上述基因进行real-time PCR分析,研究碳酸钙添加对kinC、kinE、spo0A表达的影响。结果发现,在培养16 h添加碳酸钙后的2~4 h,kinC、kinE、spo0A的转录水平比未添加碳酸钙组转录水平显著升高。18 h和20 h,kinC的相对表达量分别为对照组的2.20 倍和61.07 倍,kinE的相对表达量分别为对照组的6.63 倍和23.49 倍,spo0A的相对表达量分别为对照组的3.71 倍和17.32 倍。由此可见,碳酸钙的添加,改变环境pH值条件,这种变化可能通过某种途径激活了kinC、kinE的大量表达,从而对Spo0A进行磷酸化并保持在较高水平,进而诱导芽孢化启动进程。
3 讨论与结论
芽孢杆菌芽孢的形成主要受恶劣生存环境的影响,有研究证实大多芽孢杆菌芽孢化启动均是在中性偏碱环境下进行[25],而酸性条件则不利于芽孢起始[26]。本研究发现,37 ℃条件下6%的碳酸钙在培养16 h添加能有效改善环境pH值,极大促进凝结芽孢杆菌CGMCC 9951芽孢的产生。Dawes等[27]报道枯草芽孢杆菌(Bacillus subtilis 168)芽孢形成最适pH值为6.5~7.8,且在该范围内芽孢形成量恒定。Mazas等[28]报道蜡状芽孢杆菌ATCC 7004、4342和9818芽孢形成的最适pH值为7.0,芽孢形成率均在90%左右,且在pH 6.5~8.3均能获得良好的芽孢产量,而在最适pH值范围外pH值升高或降低,细胞生长和芽孢形成量均会降低。研究还发现,过量碳酸钙添加将导致发酵液pH值快速上升,这不仅影响菌体的正常生长代谢过程,而且超过了芽孢起始最适pH值范围,从而影响了芽孢形成。因此适量碳酸钙添加,有利于维持芽孢化启动环境形成,从而更好促进芽孢大量启动,缩短芽孢形成进程。
Moeller等[17]研究发现,芽孢形成介质的组成影响芽孢对某些胁迫的抗性,在芽孢形成培养基中添加半胱氨酸、胱氨酸或硫脯氨酸制备的枯草芽孢杆菌芽孢对过氧化氢(H2O2)和环境相关的紫外线辐射(290~400 nm)的抗性高于用脯氨酸制备的芽孢或不加任何添加剂的芽孢。同时,Olivier等[18]证明解淀粉芽孢杆菌、凝结芽孢杆菌、耐热芽孢杆菌在高温培养下形成的芽孢比较低温度下形成的芽孢耐热性能更强;而在培养基中添加矿物质离子(Ca2+、Mn2+、Mg2+)形成的芽孢耐热性能增加的同时降低了抗压性能。凝结芽孢杆菌CGMCC 9951在碳酸钙刺激下形成的芽孢在95 ℃存活率达81.25%,该特点能满足益生菌制剂生产中高温挤压成型的要求,可有效保持高的益生菌活性;同时CGMCC 9951在碳酸钙刺激下形成的芽孢还表现出良好的耐酸性能,且酸环境刺激可加速其萌发,这为其益生特性发挥奠定了良好基础。胆盐是由肝细胞分泌的胆汁酸与甘氨酸或牛磺酸结合而形成的钠盐或钾盐,它主要参与脂肪的消化与吸收,肠道中的胆盐质量分数为0.03%~0.3%[6]。本实验条件下所获得的CGMCC 9951芽孢能够在0.03%~0.3%胆盐中几乎全部存活,使其较快适应肠道环境,快速存活繁殖发挥益生作用。
众所周知,芽孢形成是一个耗能和耗时的过程,当菌体处于营养饥饿状态,细胞亚群间可能会优先选择向胞外释放毒素蛋白进行相互残杀,并利用被残杀的细胞释放物作为自身生长和细胞维持所需要的物质,而非立即启动芽孢化进程[29-30]。对枯草芽孢杆菌芽孢化启动过程研究发现,KinA、KinB、KinC、KinD和KinE蛋白激酶均可通过磷酸中继转移系统激活芽孢化启动蛋白Spo0A。在对数生长末期和稳定期早期,主要为kinC、kinD、kinE表达,它们的产物可激活产生低浓度的Spo0A-P,而低浓度的Spo0A-P利于菌体生物膜的形成;在稳定期后,kinA和kinB则大量表达,并激活产生大量的Spo0A-P,当Spo0A-P积累达到一定阈值后,菌体便启动芽孢化进程[29]。因此,KinA和KinB被认为是激活Spo0A磷酸化并启动芽孢化最主要组氨酸激酶,Trach等[25]甚至认为在缺乏kinA和kinB的菌株中几乎观察不到芽孢的形成。然而项目组研究却发现,当在对数生长末期向培养基中添加一定量的碳酸钙,能将kinC相对表达量提高到61.07 倍,kinE的相对表达量提高到23.49 倍,并诱发大量芽孢的形成,芽孢形成数量达到108CFU/mL以上。Ledeaux等[31-32]也发现在kinA和kinB双缺失的枯草芽孢杆菌中,kinC的大量表达可诱导芽孢形成,同时其还可绕过spo0F和spo0B通过旁路途径直接激活Spo0A,且KinC和KinE对Spo0F具有很强的亲和力[29]。
分析发现,枯草芽孢杆菌和凝结芽孢杆菌中的KinC和KinE,除C端催化区域比较保守外,N端信号感受区结构却明显不同。KinC在枯草芽孢杆菌中由428 个氨基酸组成,由N端3 个跨膜区将其锚定在细胞膜上,并通过N端序列感知刺激信号;而凝结芽孢杆菌中的KinC由358 个氨基酸组成,与枯草芽孢杆菌的KinC同源性仅为42.4%,且未发现可能的跨膜区域,说明其可能是以游离的形式存在胞质中,并通过N端序列感知刺激信号。枯草芽孢杆菌中KinE由738 个氨基酸构成,其N端含有2 个PAS(Per ARNT Sim)结构域,而凝结芽孢杆菌中的KinE则由504 个氨基酸构成,与枯草芽孢杆菌同源性仅为50.64%,且N端仅含有1 个PAS结构域。因此,凝结芽孢杆菌中如何感知细胞内外环境变化而启动kinC和kinE转录和表达,而KinC和KinE是通过识别何种因子或与配基结合而被激活发生自磷酸化,随后通过何种途径激活Spo0A并启动芽孢化是本研究将持续关注问题。
此外,对CGMCC 9951中KinC和KinE两个激酶及芽孢启动主要调控因子Spo0A的表达量进行研究发现,在碳酸钙加入4 h后,芽孢形成基因kinC、kinE、spo0A的相对表达量显著提高,且kinC相对表达量是kinE的2.6 倍,kinC在凝结芽孢杆菌CGMCC 9951芽孢化启动中是否承担着主要作用,同时碳酸钙的添加在改变pH值环境以及提供大量芽孢耐受性相关吡啶二羧酸钙的同时,是否影响胞内钙库水平,进而引起钙信号相关级联反应存在,都将是本研究在后续的工作中持续关注的问题。
