三仙汤联合参芪扶正注射液对脓毒症患者免疫功能的影响
2020-07-03瞿荣兰钟骏慧罗真春
李 安 瞿荣兰 钟骏慧 樊 艺 罗真春
(重庆市中医院,重庆 400021)
脓毒症是感染引起宿主反应失调导致的危及生命的器官功能障碍,免疫抑制能够导致病情进一步的恶化,为脓毒症患者死亡的主要原因[1]。中医学对脓毒症的主要治疗思路为扶助正气,清除内外之邪,这与现代医学的免疫治疗方法类似[2-3]。三仙汤是由仙茅、淫羊藿与仙鹤草组成,为河南名医干祖望先生常用补虚扶正方剂,曾被其戏称为中药“小激素”。该方具有补虚扶正、益气提神的作用。参芪扶正注射液的主要成分为黄芪、党参,具有升阳固脱、益气固表、甘温除热等功效。本研究主要探讨了脓毒症患者在西医规范化治疗的基础上给予三仙汤联合参芪扶正注射液,对患者免疫功能的影响。现报告如下。
1 资料与方法
1.1 病例选择 西医诊断标准参照《中国严重脓毒症/脓毒性休克治疗指南(2014):规范与实践》[4]:机体器官功能障碍;序贯器官功能衰竭评分(SOFA评分)≥2分;低血压(MAP<65 mmHg),补液无法纠正,需使用血管活性药物;血乳酸>2 mmol/L。中医诊断标准:中医辨证分为虚实夹杂证。纳入标准:年龄19~75岁;符合上述诊断标准;本次研究经院伦理委员会讨论批准进行,患者及家属知情同意。排除标准:年龄≤18岁者;患有晚期恶性肿瘤、原发性免疫缺陷病、多发伤、重型颅脑损伤以及对本研究用药过敏者;中途放弃治疗或数据不全者。
1.2 临床资料 选取2016年1月至2019年1月期间本院收治的脓毒症患者70例。按照随机数字表法分为观察组与对照组各35例。观察组男性18例,女性17例;平均年龄(64.32±6.55)岁;感染原发部位为肺部16例,肺腔11例,泌尿系统3例,皮肤软组织3例,多发伤2例。对照组男性16例,女性19例;平均年龄(65.13±6.04)岁;感染原发部位为肺部15例,腹腔11例,泌尿系统4例,皮肤软组织3例,多发伤2例。两组临床资料比较,差异无统计学意义(P>0.05)
1.3 治疗方法 所有入组患者均参照《严重脓毒症和脓毒性休克的治疗指南》[5]进行规范化治疗。主要包括广谱抗生素使用、液体复苏治疗、外科手术、器官功能支持、替代治疗、纠正水/电解质紊乱等。观察组患者在规范化治疗基础上给予三仙汤(方药组成:仙茅、淫羊藿、仙鹤草各30 g。本院药剂科中药房提供药材并代煎,每剂药加1 000 mL水,煎取300 mL,每次口服或鼻饲100 mL,每日3次)联合参芪扶正注射液(丽珠集团利民制药厂,国药准字Z19990065)250 mL静滴,每日1次。两组疗程均为10 d。
1.4 观察项目 分别于入ICU第1日、第3日、第7日、第10日,检测各组急性生理学及慢性健康状况评分(APACHEⅡ评分)、SOFA评分;清晨抽取外周血,ELI⁃SA法检测外周血中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)、白细胞介素-10(IL-10)水平;散射比浊法检测外周血中免疫球蛋白(IgA、IgG、IgM)水平;流式细胞仪检测外周血中T淋巴细胞亚群。
1.5 统计学处理 应用SPSS22.0统计软件。计量资料以(±s)表示,两样本均数比较采用独立样本t检验,多个样本均数间比较采用单因素方差分析。计数资料用率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 两组治疗前后APACHEⅡ、SOFA评分比较 见表1。单因素方差分析结果显示,两组各观察时间点间的APACHEⅡ评分、SOFA评分存在明显统计学差异(P<0.01)。两组第7日、第10日的APACHEⅡ评分、SOFA评分均明显低于第1日,差异均有统计学意义(P<0.01)。观察组第7日、第10日的APACHEⅡ评分、SOFA评分均明显低于对照组,差异均有统计学意义(P<0.01)。
表1 两组治疗前后APACHEⅡ、SOFA评分比较(分,±s)
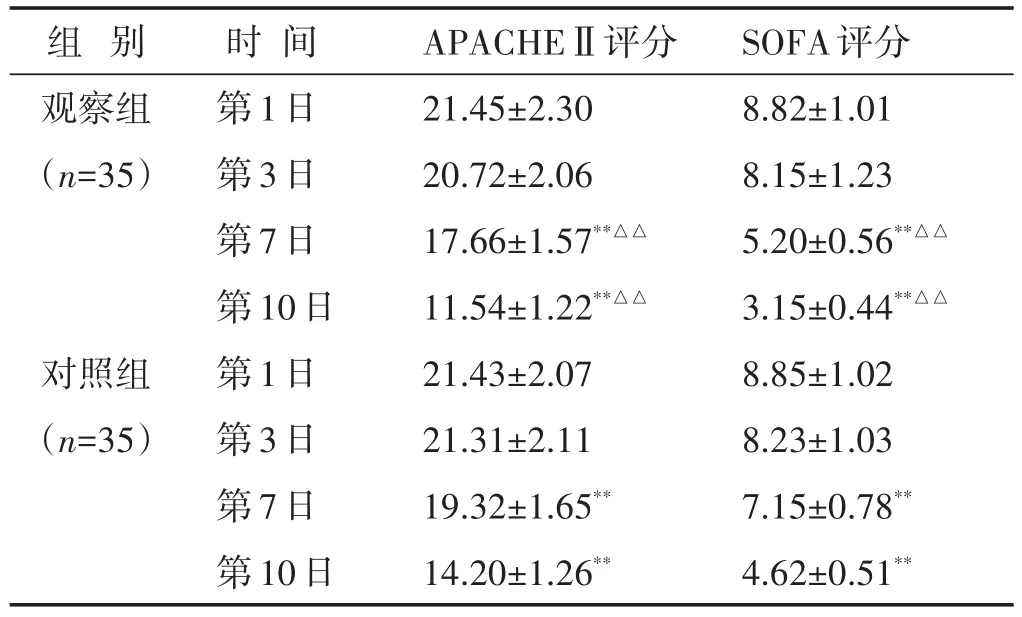
表1 两组治疗前后APACHEⅡ、SOFA评分比较(分,±s)
与本组第1日比较,∗∗P<0.01;与对照组同时间点比较,△△P<0.01。下同
组别观察组(n=35)对照组(n=35)时间第1日第3日第7日第10日第1日第3日第7日第10日APACHEⅡ评分21.45±2.30 20.72±2.06 17.66±1.57**△△11.54±1.22**△△21.43±2.07 21.31±2.11 19.32±1.65**14.20±1.26**SOFA评分8.82±1.01 8.15±1.23 5.20±0.56**△△3.15±0.44**△△8.85±1.02 8.23±1.03 7.15±0.78**4.62±0.51**
2.2 两组治疗前后外周血细胞因子水平比较 见表2。两组治疗后不同时间点,外周血中TNF-α、IL-6水平均较第1日时有不同程度的下降(P<0.05)。观察组第3日、第7日、第10日的外周血TNF-α水平均明显低于对照组,差异有统计学意义(P<0.01)。观察组第7日、第10日的外周血IL-6水平均明显低于对照组,差异有统计学意义(P<0.05)。两组治疗后外周血中IL-10水平较第1日时无明显改变(P>0.05)。
表2 两组治疗前后外周血细胞因子水平比较(ng/L,±s)
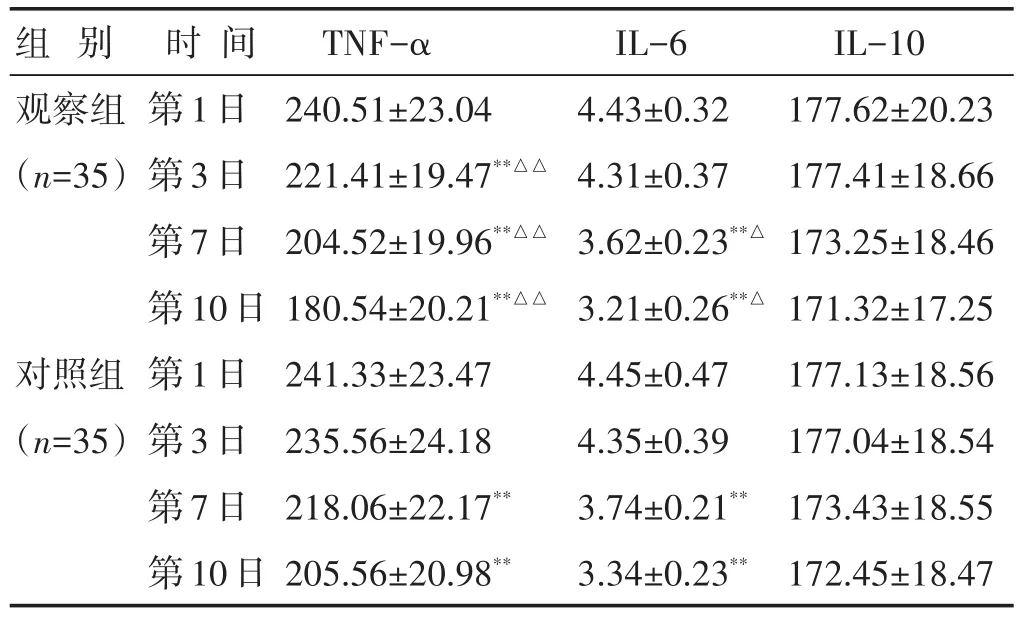
表2 两组治疗前后外周血细胞因子水平比较(ng/L,±s)
与对照组同时间点比较,△P<0.05。下同
组别观察组(n=35)对照组(n=35)IL-10 177.62±20.23 177.41±18.66 173.25±18.46 171.32±17.25 177.13±18.56 177.04±18.54 173.43±18.55 172.45±18.47时间第1日第3日第7日第10日第1日第3日第7日第10日TNF-α 240.51±23.04 221.41±19.47**△△204.52±19.96**△△180.54±20.21**△△241.33±23.47 235.56±24.18 218.06±22.17**205.56±20.98**IL-6 4.43±0.32 4.31±0.37 3.62±0.23**△3.21±0.26**△4.45±0.47 4.35±0.39 3.74±0.21**3.34±0.23**
2.3 两组治疗前后外周血中免疫球蛋白比较 见表3。两组治疗后各时间点外周血IgA、IgG、IgM水平与第1日比,均有不同程度的升高(P<0.05)。观察组第3日、第7日、第10日外周血IgA水平、第7日、第10日外周血IgG水平均明显高于对照组,差异有统计学意义(P<0.01)。
表3 两组治疗前后外周血IgA、IgG、IgM水平比较(g/L,±s)

表3 两组治疗前后外周血IgA、IgG、IgM水平比较(g/L,±s)
组别 时间IgA IgG IgM观察组(n=35)对照组(n=35)第1日第3日第7日第10日第1日第3日第7日第10日1.65±0.12 2.41±0.21**△△2.93±0.23**△△2.68±0.21**△1.67±0.15 2.26±0.19**2.71±0.20**2.57±0.22**10.32±1.59 10.69±1.32 12.80±1.54**△△13.91±1.47**△△10.11±1.09 10.35±1.11 10.37±1.27 10.29±1.15 0.88±0.11 0.93±0.12 1.26±0.10**1.33±0.14**0.89±0.09 0.93±0.11 1.23±0.13**1.29±0.11**
2.4 两组治疗前后外周血CD4+、CD8+、CD4+/CD8+比较 见表4。两组治疗后不同时间点CD4+T细胞数、CD4+/CD8+比值较第1日有不同程度的升高,CD8+T细胞数较第1日有不同程度的降低(P<0.05)。观察组第7日、第10日CD4+T细胞百分比、CD4+/CD8+比值明显高于对照组,差异有统计学意义(P<0.05或P<0.01)。两组治疗后各时间点的CD8+T细胞百分比无明显统计学差异(P>0.05)。
表4 两组治疗前后外周血CD4+、CD8+、CD4+/CD8+比较(±s)
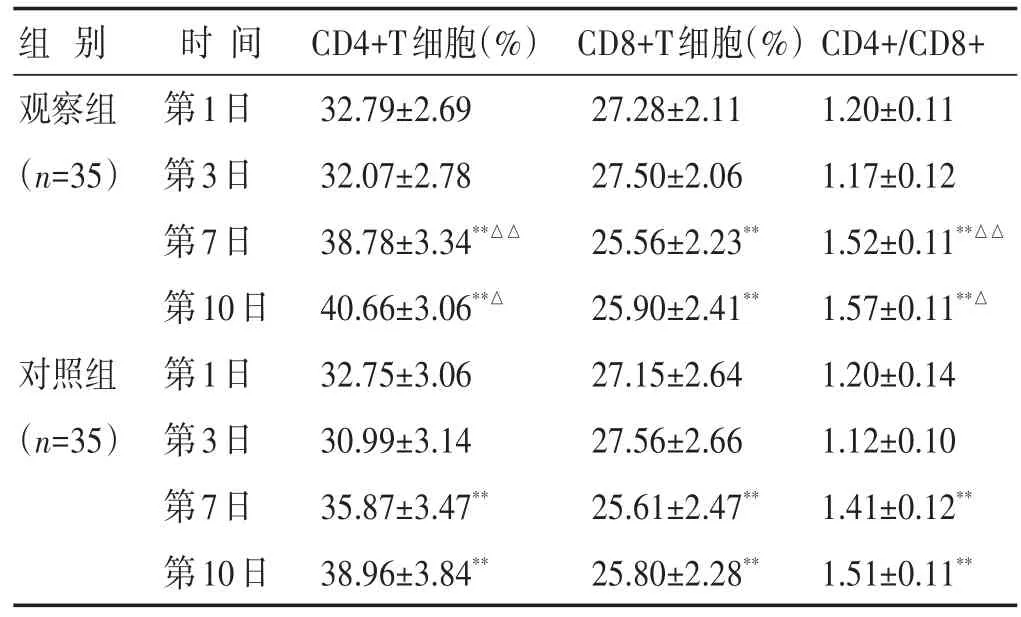
表4 两组治疗前后外周血CD4+、CD8+、CD4+/CD8+比较(±s)
组别观察组(n=35)对照组(n=35)时间第1日第3日第7日第10日第1日第3日第7日第10日CD4+T细胞(%)32.79±2.69 32.07±2.78 38.78±3.34**△△40.66±3.06**△32.75±3.06 30.99±3.14 35.87±3.47**38.96±3.84**CD8+T细胞(%)27.28±2.11 27.50±2.06 25.56±2.23**25.90±2.41**27.15±2.64 27.56±2.66 25.61±2.47**25.80±2.28**CD4+/CD8+1.20±0.11 1.17±0.12 1.52±0.11**△△1.57±0.11**△1.20±0.14 1.12±0.10 1.41±0.12**1.51±0.11**
3 讨论
据统计,全球每年有超过1 800万严重脓毒症病例,还以每年1.5%~8.0%的速度上升,全球每天约14 000人死于其并发症[6]。研究证实,免疫抑制为脓毒症患者死亡的主要原因,免疫系统受损不仅使感染得不到有效控制,也增加了继发感染的发生率,导致病情进一步的恶化[7]。脓毒症发病时,患者机体内各种细胞因子释放、形成复杂的细胞因子网络,炎症反应与相应的抑炎机制共存,免疫系统呈现紊乱的状态[8]。相关研究证实,异常增加的细胞因子对机体免疫反应呈现负向调控作用,是病情进一步恶化的主要原因[9]。
中医学认为,脓毒症的病因在于外感六淫毒邪,导致内生热毒、瘀血、气机逆乱、虚实夹杂[10]。机体遭受邪气侵袭时会出现正气受损,脓毒症病程中存在正气亏虚。因此,扶助正气、恢复正气为脓毒症的主要治则。益气、扶正贯穿于脓毒症治疗的整个过程中[11]。而中医正气的作用也与现代医学的免疫治疗方法相类似,主要治疗思路是通过恢复正气,清除内外之邪,维持机体健康[12]。三仙汤配方比例大概是:淫羊藿12~20 g,仙茅4~12 g;仙鹤草12~40 g。用于扶正补虚,现代医学叫提高免疫力,凡无外邪的各种疾病而神疲怠惰者,都可使用。淫羊藿性温,味辛,入肝、肾经。《本草纲目》记载淫羊藿“益精气,坚筋骨,补腰膝,强心力”。仙茅性温,味甘、辛,入肾肝二经,有补肾阳、强筋骨、祛湿寒、明目、益精止血、解毒消肿之能。仙鹤草性味苦涩而平,除用于收敛止血外,还能强壮扶正补虚。参芪扶正注射液的主要成分为黄芪、党参,具有升阳固脱、益气固表、甘温除热等功效[13]。党参补中益气,养血生津[14];黄芪排脓止痛、活血生血、补气升阳[15]。本研究结果显示,对脓毒症患者在规范化治疗的基础上给予参芪扶正注射液,治疗第7天、第10天的APACHEⅡ评分、SOFA评分均明显低于单纯西医治疗。可见,使用参芪扶正注射液能够提高脓毒症患者整体的健康状况,降低对机体器官功能的损害。
IL-6为机体重要的促炎性细胞因子,TNF-α是参与炎症反应多个环节的免疫调节介质。研究证实,IL-6、TNF-α能够在一定程度上反映脓毒症患者的机体炎症反应程度[16],对患者的预后也有一定的预测作用。IL-10是机体抑制性细胞因子,有明显的抗炎效果。本研究中,观察组治疗后外周血中的TNF-α、IL-6水平下降程度均较对照组明显,表明三仙汤联合参芪扶正注射液对脓毒症患者机体非特异性免疫的积极调节作用。免疫球蛋白能够通过识别和吞噬抗原、抑制炎症因子等机制发挥积极的免疫调节作用。本研究中,观察组治疗后外周血中的IgA、IgG水平均明显高于对照组,可见三仙汤联合参芪扶正注射液能够积极调节脓毒症患者体液免疫功能。T淋巴细胞凋亡是引起脓毒症患者发生免疫功能紊乱的主要原因,CD4+/CD8+比值在一定程度上能够反映脓毒症患者免疫抑制的程度,当机体免疫功能下降时,CD4+/CD8+比值呈下降趋势。本研究发现,三仙汤联合参芪扶正注射液治疗组能够在一定程度上提升CD4+细胞比例,降低CD8+细胞比例,进而提高CD4+/CD8+比值,从而调节脓毒症患者的免疫状态。
综上所述,三仙汤联合参芪扶正注射液能够抑制促炎因子的过度释放,减轻炎症反应,增强机体免疫功能,改善脓毒症患者免疫抑制的状态。
