NLR、RDW-CV对合并COPD的NSCLC患者术后预后评估价值
2020-07-02罗鹏勇冯书黄实仁欧宗兴
罗鹏勇 冯书 黄实仁 欧宗兴
肺癌和慢性阻塞性肺疾病(Chronic obstructive pulmonary disease, COPD)作为常见的呼吸系统疾病,预计未来几十年其死亡原因分别排第六位和第四位[1],这严重危害人民健康和生命安全。有研究显示50%~70%肺癌患者同时患有不同程度气流受限的COPD[2-3]。非小细胞肺癌(non small cell lung cancer, NSCLC)约占肺癌的85%,早期NSCLC以手术治疗为主,而晚期NSCLC、小细胞肺癌则以化疗为主或姑息手术治疗[4]。尽管如此,绝大多数肺癌患者预后仍不理想,5年生存率和长期生存率较低。多项研究表明,COPD对肺癌预后有不良影响[5-7],因此合并COPD可能会使NSCLC患者预后变得更差。
气道慢性炎症是导致肺癌初始致突变反应增强的重要病理生理机制之一,COPD患者持续气道炎症可能导致支气管上皮发生改变,从而有利于癌变[8]。CRP、血小板、中性粒细胞和淋巴细胞比值 (neutrophil to lymphocyte ratio, NLR)、血小板和淋巴细胞比值等炎性指标在COPD、肺癌及其他肿瘤已被用来单独评估[9-11]。红细胞分布宽度变异系数(coefficient of variation of red cell distri-bution width, RDW-CV)是衡量外周血中红细胞体积异质性的参数,近年来其作为一个新的炎性指标已被证实[12],而且研究表明癌症的进展与机体慢性炎症密切相关。此外,国外有学者表明RDW-CV与COPD不良预后有关[13]。因此NRL、RDW-CV可能在NSCLC及COPD的疾病进展中发挥着作用,从而影响合并COPD的NSCLC的预后。
中性粒细胞、淋巴细胞、RDW-CV均是肺癌术前常规实验室检查项目,目前关于NRL、RDW-CV在合并COPD的NSCLC手术治疗预后方面报道较少。因此,本研究旨在研究术前NLR、RDW-CV在合并COPD的NSCLC患者手术治疗后的预后价值,为指导合并COPD的NSCLC患者的预后评估、临床诊治提供新的思路和根据。
资料及方法
一、 研究对象
纳入2011年1月至2014年8月在海口市人民医院心胸外科行手术根治的159例NSCLC患者,其中99例合并COPD,所有肺癌患者均经病理确诊,且合并COPD的患者均行肺功能检查,其肺功能指标均满足:0.5≤FEV1/FVC<0.7、FEV1/预计值%≥50%、FEV1≥1.2L。对以上所有患者进行回顾性分析。本研究临床资料从海口市人民医院数据库提取。
二、排除标准
1) 术前放化疗治疗等抗肿瘤治疗;2) 合并其它类型肿瘤;3) 合并急性感染、哮喘、活动性肺结核、严重支气管扩张、间质性肺炎、免疫系统方面疾病;4) 术后严重并发症1月内死亡;5) 术前有血液系统疾病及骨髓造血系统方面疾病;6) 术前使用糖皮质激素等免疫抑制药物。
三、实验仪器及方法
采用日本SYSMEX XN9000全自动血液分析仪器检测中性粒细胞及淋巴细胞计数、红细胞分布宽度变异系数。从海口市人民医院数据库中提取患者术前1周血常规及术前肺功能报告、及患者肿瘤病理等临床资料。肺癌TNM分期采用国际肺癌研究会制定的第八版国际肺癌分期标准。不吸烟:从不吸烟或吸烟量未达到每天1支,且每周少于4次,连续累积6个月者;吸烟:每天至少吸1支烟且连续或积累达到6个月者,或者每周吸烟超过4次,但平均每天不足1支[14]。随访评估:患者术后每半年随访1次,直至随访结束或患者死亡。OS:从确诊肺癌开始肺癌确诊到随访结束或患者死亡日期终止。最长随访时间为84月,最短为1月,中位随访日期为34月。
四、统计方法
运用SPSS 23.0 软件进行分析。使用ROC曲线确定NLR、RDW-CV的最佳截点。运用Kaplan-Meier法对患者OS进行分析,单因素及多因素COX风险回归模型分析肺癌患者预后因素。非正态分布数据分布用中位数(四分位距)表示,连续变量组间比较用Mann-Whitney U检验,分类变量用卡方检验。P<0.05有统计学意义。
结 果
一、患者临床病理变量
本研究共纳入病理资料完整的159例NSCLC患者,其中男性120人(75.5%),女性39人(24.5%),年龄最小的27岁,最大的84岁,中位年龄62岁。肺癌TNM分期Ⅰ、Ⅱ期患者116人(73.0%),Ⅲ期患者43人(27.0%)。其中99例(62.3%)肺癌患者合并COPD,其余患者肺功能正常。
二、NRL及RDW-CV的ROC曲线特点及其最佳截点
NLR的ROC曲线下方面积是0.735,其95%置信区间是0.634~0.835,根据统计分析的特异性及灵敏性,计算出最大Youden指数对应的NLR最佳截点为2.56(P<0.001)。RDW-CV的ROC曲线下方面积是0.651,其95%置信区间是0.534~0.767,根据特异性和灵敏性计算出最大的Youden指数对应的RDW-CV最佳截点为12.85%(P=0.01)。NLR、RDW-CV预测生存状态的最佳截点,定义患者NLR≥2.56、RDW-CV≥12.85%为高水平,而小于截点则为低水平(见图1)。
三、NRL及RDW-CV的水平与患者临床病理的关系
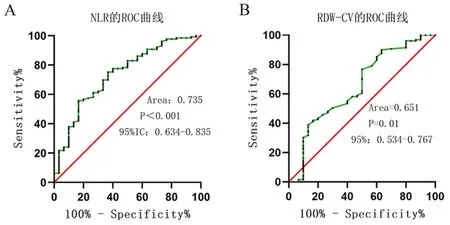
图1 NLR、RDW-CV的ROC曲线
A:NLR的非小细胞肺癌总生存期的ROC曲线;B: RDW-CV的非小细胞肺癌总生存期的ROC曲线
合并COPD的NSCLC患者的NLR水平是2.76 (2.28~3.54) [M(P25~P75)],不合并COPD患者NLR水平是2.19 (1.43~3.15) [M(P25~P75)],二者比较有统计学意义(U值:2120.00;Z值:-3.020;P=0.003)。合并COPD的NSCLC患者的RDW-CV为13.40 (12.90~14.60) [%,M(P25~P75)],而不合并COPD的患者RDW-CV是13.20 (12.70~14.08) [ %,M(P25~P75)],是否合并COPD与RDW-CV水平无统计学意义(U值:2482.00;Z值:-1.735;P=0.083)(见图2)。进一步分析99例合并COPD的NSCLC患者发现,高NLR与淋巴结情况(P=0.001)、TNM分期(P=0.019)、吸烟(P=0.04)显著相关,高RDW-CV水平与肿瘤大小显著相关(P=0.047)(见表1)。
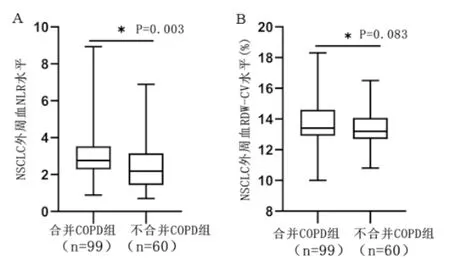
图2 是否合并COPD的NSCLC患者与外周血NLR、RDW-CV水平的关系
A:合并COPD的非小细胞肺癌患者外周血NLR水平显著高于不合并COPD的非小细胞肺癌患者(P=0.003);B:非小细胞肺癌患者是否合并COPD与患者外周血RDW-CV水平无显著相关(P=0.083)。
四 NLR、RDW-CV与患者OS的关系
运用Kaplan-Meier法分析了99例合并COPD卡方检验,P<0.05有统计学意义。
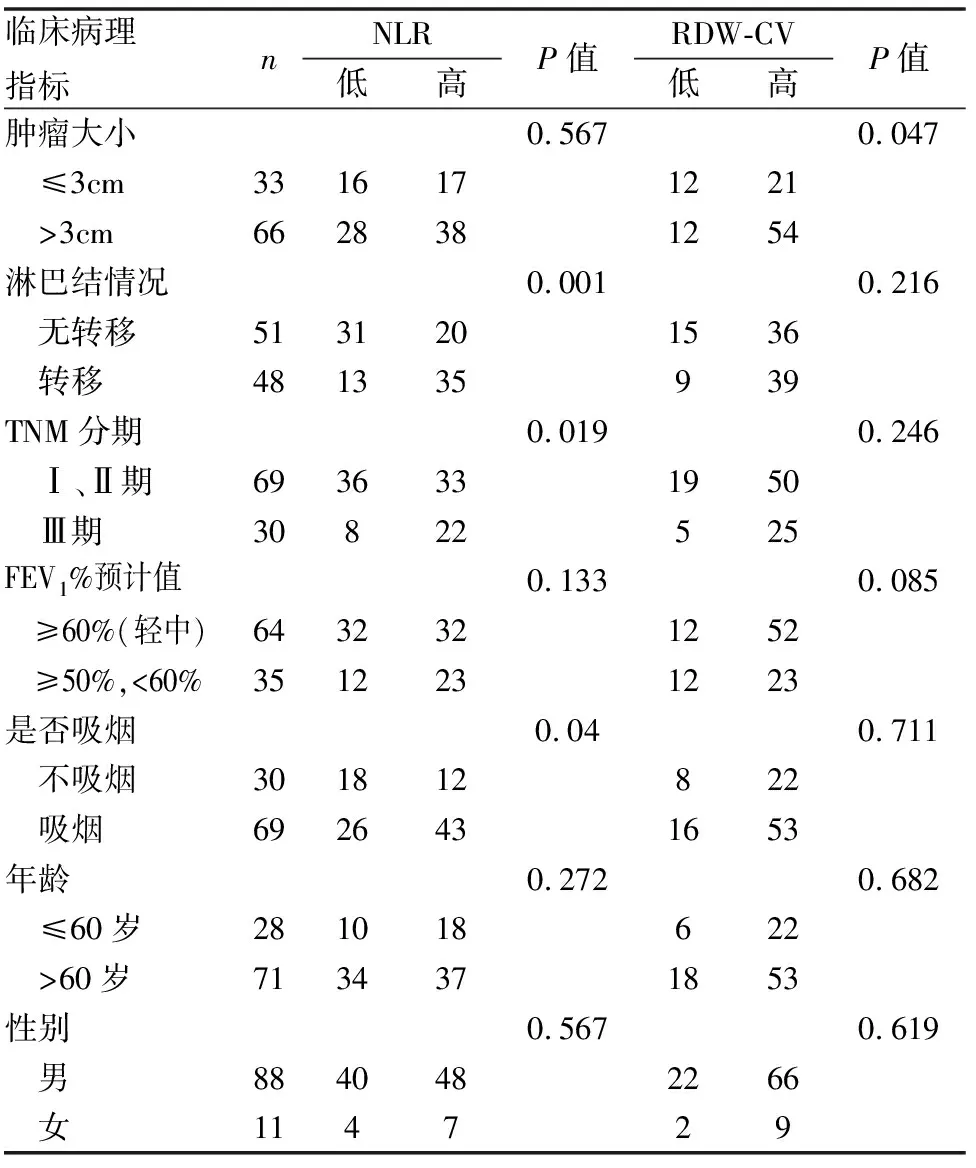
表1 外周血NLR和RDW-CV与合并COPD的NSCLC患者临床病理关系
的NSCLC患者中,NLR≥2.56的患者其总生存期(P<0.001)显著短于NLR<2.56的患者,此外RDW-CV≥12.85%的患者总生存期(P=0.024)显著短于RDW-CV<12.85的患者,其比较差异均具有统计学意义。进一步根据NLR与RDW-CV水平将99例患者分为3组进行生存分析,组一为NLR≥2.56且RDW-CV≥12.85%的患者,组二为仅NLR≥2.56或仅RDW-CV≥12.85%的患者,组三为NLR<2.56且RDW-CV<12.85的患者。结果显示组三患者总生存期比组二患者长(P=0.043),组二患者总生存期长于组一患者(P=0.009),三组患者间总生存期比较具有统计学意义(P<0.001)(见图3)。
五、合并COPD的NSCLC患者不良预后因素分析
单因素COX回归分析表明肿瘤大小(P=0.023)、淋巴结转移(P=0.003)、FEV1/预计值%(P=0.033)、吸烟(P=0.024)、NLR水平(P<0.001)、RDW-CV水平(P=0.028)是合并COPD的NSCLC患者的不良预后因素。进一步多因素COX回归分析显示肿瘤大小(P=0.004)、淋巴结情况(P=0.009)、FEV1/预计值%(P=0.005)、NLR(P=0.022)、RDW-CV(P=0.017)是患者预后的独立危险因素(见表2)。
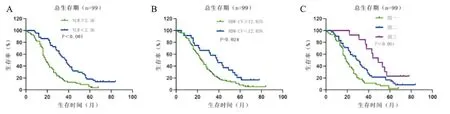
图3 NLR、RDW-CV与合并COPD的NSCLC患者OS的Kaplan-Meier生存分析
A: NLR≥2.56的患者(n=55)OS显著短于NLR<2.56的患者(n=44)(P<0.001);B: RDW-CV≥12.85%的患者(n=75)OS短于RDW<12.85%的患者(n=24)(P=0.024);C: 组一患者OS短于组二患者(P=0.009),组二患者OS短于组三患者(P=0.043),三组患者间OS比较有统计学意义(P<0.001)。组一:NLR≥2.56且RDW-CV≥12.85%的患者(n=44),组二:仅NLR≥2.56或仅RDW-CV≥12.85%的患者(n=42),组三:NLR<2.56且RDW-CV<12.85%的患者(n=13)。

表2 合并COPD的NSCLC总生存期预后的单因素及多因素COX回归分析
P<0.05有统计学意义。
讨 论
近二十年以来,随着我国开始步入老年化社会,肺癌及COPD的病死率均逐年升高,寻找一个易得且有效的预后指标对促进个体风险分层和管理至关重要,我们的研究证明了NLR和RDW-CV这两个炎性指标与合并COPD的NSCLC的OS缩短有关,且二者都是患者预后不良的独立危险因素。
NLR作为全身炎症指标已被广泛研究和报道,但其在肺癌中的作用机制仍需进一步研究。一方面,炎症通过肿瘤微环境有助于肿瘤细胞增殖和活化、促进新生血管的生成和转移、破坏适应性免疫等而导致不良预后[15],而炎症指标NRL可以反映全身的炎症情况。另一方面,NLR的升高一定程度上反映中性粒细胞计数升高和(或)淋巴细胞计数降低,Wislez等在肺腺癌中的研究表明,中性粒细胞通过促进肿瘤细胞的能动性或侵袭性来影响癌症的进展,从而导致预后不良[16]。此外,中性粒细胞还通过产生网状DNA结构与A549肺癌细胞胞膜接触,进而促进肿瘤细胞的在组织上粘附从而引起肿瘤转移[17]。而T淋巴细胞和NK细胞被认为在抑制肿瘤生长和迁移方面起重要作用,淋巴细胞的减少进而会使得机体毒性T细胞介导的抗肿瘤细胞免疫功能下降[18]。我们的研究也证明NLR升高与肺癌淋巴结情况、TNM分期有关,这似乎也说明了机体的慢性炎症在肿瘤进展和转移中发挥重要作用。一项免疫抑制治疗147例晚期非小细胞肺癌研究中,NLR≤2.5比NLR>2.5患者的OS及PFS明显较好[19],而且Guo和Zhao都证明了NLR升高是NSCLC不良预后的独立危险因素,这些和我们研究结果一致[19-20]。关于NLR在COPD上的研究亦有不少。众所周知,中性粒细胞及其释放的炎症因子介导非特异性炎症反应在COPD的发生和进展过程中起重要作用。有研究指出Th1细胞、Th17细胞及调节性T细胞等淋巴细胞免疫调节失衡在COPD的进展尤为重要[21]。多项研究表明NLR升高与气流受限程度相关,而且可以预测COPD的不良预后[22-23],这些结果均提示NLR可以较好的评估NSCLC和COPD预后,且与合并COPD的NSCLC患者不良预后相关。
近些年来,RDW被发现与肺癌[24]、胃癌[25]、肝癌[26]、心血管疾病[27]、COPD[28]等疾病不良预后相关,RDW的测量通常由RDW-CV和RDW-SD两个指标表示,可根据需要用于不同疾病的检测。但关于RDW-CV和NSCLC及COPD的准确机制仍不明确,首先,RDW-CV升高已被证实与炎性指标升高相关[29],NSCLC和COPD的慢性炎症反应及其产生的介质不仅影响了铁转运与代谢,缩短了红细胞寿命,而且还会造成机体处于高水平氧化应激状态,二者都导致未成熟的红细胞提前释放入血,而引起RDW-CV升高。其次,COPD和NSCLC患者常常会因造血原料缺乏导致贫血,从而使RDW-CV升高。我们发现RDW-CV与肺癌的TNM分期相关,国外也有研究支持RDW水平与肺癌TNM分期呈正相关[24],此外,我们进一步证明RDW-CV与患者OS缩短相关,而且是预后的独立危险因素。此前也有研究表明RDW与NSCLC术后的住院时间、住院死亡率以及长期生存率有关[30]。因此,RDW-CV可以作为合并COPD的NSCLC患者术后不良预后的血清标志物。
总而言之,我们的研究表明NLR、RDW-CV作为临床易得且廉价的实验室指标可以作为合并COPD的NSCLC其术后的预后评估,而二者联合评估的效果更佳,有助于术后风险评估及治疗方案的选择。
本研究作为一项临床回顾性研究,仍具有一定的局限性。首先,研究的样本量较少而不能排除统计过程中可能出现的Ⅱ型错误。其次,该研究是单中心研究,所有对象均来自海南省。此外,对于不同TNM分期的肿瘤患者我们没有考虑其手术方式的不同以及其术后有无化疗。
