基于TLR4/MyD88信号通路探讨大黄灵仙方缓解胆管细胞炎症反应的作用研究
2020-07-02吴华帅俞渊陈金梅甘苡蓉李承积
吴华帅,俞渊,陈金梅,甘苡蓉,李承积
(1.广西中医药大学,广西 南宁 530001;2.广西中医药大学第一附属医院肝胆外科,广西 南宁 530023)
胆管炎症反应是胆石症发病的关键病理环节。研究表明,胆管炎症引起的炎性狭窄,易造成胆管梗阻,长时间的梗阻常使胆汁引流不畅,容易形成胆石症[1]。胆管炎症与结石互相作用、互为因果,造成患者的长期病痛及疾病反复发作。长期受结石、淤积胆汁及炎症物质的刺激,胆道甚至易发生癌变,导致胆管癌[2]。如何预防和缓解胆道炎症反应,是治疗胆石症等胆道疾病的关键。
前期研究发现,大黄灵仙方能有效缓解胆管周围组织炎性损伤[3]。大黄灵仙方是治疗胆石症的经验要方,以生大黄、威灵仙、芒硝、金钱草、枳壳、鸡内金、泽兰、柴胡、郁金、磁石、黄芪、甘草为主要药物,全方共奏疏肝利胆、攻下排石之功效。但从药理角度而言,大黄灵仙方如何干预胆石症的机制不甚明了。研究表明,TLR4/MyD88信号通路在调节胆道炎症机制反应上具有关键性作用[4]。本研究将从TLR4/MyD88信号通路探讨大黄灵仙方减轻胆管细胞炎症损伤的具体机制,进一步明确大黄灵仙方的作用靶点,为临床应用奠定其科学基础。
1 材料与方法
1.1 实验动物
选用清洁级健康SD大鼠50只,体质量200~250 g。由广西食品药品检验所实验动物中心提供,动物合格证号SCXX桂2019-0001。实验室温度恒定20~26 ℃,湿度控制40%~70%,饲养环境为多层层流架,标准饲料喂养,三级过滤纯净水自由饮用。大鼠适应性喂养1周后开始实验。
1.2 分组标准
所有大鼠随机分为5组:空白组、内毒素脂多糖(LPS)对照组、LPS+中药治疗组、LPS+信号阻断剂(PDTC+SB203580)组、LPS+PDTC+SB203580+中药组,每组大鼠10只。
1.3 方药制备
由生大黄15 g,威灵仙30 g,芒硝10 g,金钱草30 g,枳壳12 g,鸡内金10 g,泽兰15 g,柴胡12 g,郁金12 g,磁石12 g,黄芪30 g,甘草5 g组成,使用中药配方颗粒剂(由江阴天江药业有限公司提供) ,购于广西中医药大学第一附属医院。
1.4 实验试剂
6×DNAloading buffer(货号:RT201-01)、DNA Marker(货号:RT201-02)均购自天根生化科技(北京)有限公司;PrimeScript TM RT reagent Kit with gDNA Eraser(Perfect Real Time,RR047A)、TB GreenTM Premix ExTaqTM II(货号:RR820A)、引物合成均购自日本Takala公司;Trizol(货号:15596026)购自MRC公司;Mouse Anti-βactin mAb(货号:TA-09)购自北京中杉金桥生物技术有限公司;TLR4 Antibody(货号:19811-1-AP)、MYD88 Antibody(货号:23230-1-AP)、HRP标记羊抗兔二抗(货号:SA00001-2)、HRP标记羊抗鼠二抗(货号:SA00001-1)均购自安诺伦生物科技有限公司;大鼠白介素1β(IL-1β)ELISA Kit(货号:CSB-E08055r)、大鼠白介素6(IL-6)ELISA Kit(货号:CSB-E04640r)、大鼠TNF-αELISA Kit(货号:CSB-E69066r)均购自武汉华美生物工程有限公司;RIPA裂解液(货号:RR0020)、BCA蛋白浓度测定试剂盒(货号:PC0020)均购自Solarbio(北京)公司;ECL底物液(货号:WBKLS0100)购自默克公司。
1.5 实验方法
1.5.1 造模与给药
大鼠胆管炎症模型参考Zhao法[5]进行:在大鼠胆总管一次注射5 mg/kg LPS以构建肝内胆管感染动物模型。鉴于动物模型的时效性,中药给药拟于造模前 3天开始灌胃给药,一直延续至成模后72 h,每天2次,间隔12 h,灌胃液体量为每天2 mL/100 g体质量。根据前期研究结果[6],大黄灵仙方给药剂量为320 mg/(kg·d),并同时满足每天灌胃液体量为2 mL/100 g体质量的要求;空白组和LPS对照组及LPS+信号阻断剂(PDTC+SB203580)组可给予等量蒸馏水代替。PDTC按120 mg/(kg·d)剂量大鼠进行腹腔注射,SB203580按照10 mg/(kg·d)大鼠腹腔注射。信号通路阻断剂每天注射1次,连续干预3 d。
1.5.2 标本采集
成模后72 h处死各组大鼠,除毛、横行开腹,大鼠全身肝素化,灌注预热,待肝脏变成均一的土黄色,在外科显微镜下用牙刷轻柔地将肝实质组织去掉,剩下完整的胆管树,用于胆管细胞分离或直接提取蛋白和RNA进行相关指标检测。
1.6 观察指标与检测方法
1.6.1 病理切片并HE染色,观察胆管周围组织病理性改变
胆管树分离完成后,切取小部分组织,用0.9%NaCl溶液冲洗,吸干水分后予以4%福尔马林溶液进行固定,脱水石蜡包埋,切片后HE染色,观察胆管周炎性改变。
1.6.2 实时荧光定量PCR检测TLR4/MyD88信号通路及下游炎症因子相关基因表达
在DNA Engine Opticon TM2连续荧光检测系统 (M J Research公司) 中进行扩增反应。反应条件为:95 ℃ 30 s,1 Cycle;95 ℃ 5 s,60 ℃ 30 s,40 Cycles为反应条件绘制溶解曲线,检测TLR4/MyD88信号通路上因子的mRNA表达量,最终数据以2-△△Ct进行分析。RT-qPCR实验过程中所检测的mRNA表达水平,都进行3个重复孔实验,最后结果取平均值,3个重复孔间CP、Tm数值相差±0.5,以保证实验操作稳定,数据重复性好,并且真实可靠。各基因及内参基因GAPDH引物采用Primer 5.0软件设计(见表1)。

表1 目的基因荧光定量PCR引物序列
1.6.3 WesternBlot检测TLR4/MyD88信号通路及下游炎症因子相关蛋白表达
提取胆管细胞总蛋白,再使用MULTISKAN-GO型酶标仪(购自Thermo公司)进行蛋白质定量,SDS-PAGE电泳。电泳结束后,使用半干转印仪器(Bio-Rad)将蛋白转印至PVDF膜(15 V,45 min)。转印结束后,使用5%脱脂乳室温封闭 PVDF膜1 h;随后分别4 ℃过夜孵育兔源一抗。过夜孵育后的PVDF膜使用TBST缓冲液洗涤3次,每次5min。随后室温孵育HRP标记二抗1 h,TBST缓冲液洗涤3次后,采用ECL发光液进行显影检测。使用NIH Image J软件分析各组WB检测蛋白条带灰度值,以目的蛋白灰度值与内参β-actin灰度值的比例进行比较。
1.7 数据统计
2 结果
2.1 各组胆管组织HE染色观察
结果显示,空白组大鼠胆管组织可见胆管细胞完整、正常,结构清晰,细胞核大小形态正常,核仁清晰,胞浆染色均匀,未见细胞增生,未见炎性细胞浸润。LPS组、LPS+ PTDC+SB203580组可见大量胆管细胞变性、增生,汇管区大量淋巴细胞、浆细胞浸润,胆小管扩张淤胆。与之相比,LPS+中药组、LPS+PTDC+SB203580+中药组的胆管细胞变性、增生及胆管内炎性细胞浸润情况大有改善,极少见细胞坏死及纤维组织增生,炎性改变基本恢复正常。各组大鼠胆管组织HE染色病理切片见图1。

注:a:正常组;b:LPS组;c:LPS+PTDC+SB203580组;d:LPS+中药组;e:LPS+PTDC+SB203580+中药组图1 各组大鼠胆管组织病理变化(HE染色×200)
2.2 各组大鼠胆管组织TLR4/MyD88信号通路及下游炎症因子相关基因表达比较
统计结果显示,与空白组比较,LPS对照组、LPS+PTDC+SB203580组的TLR4、Myd88、IL-1、IL-6、TNF-αmRNA 表达,均增加明显,差异均具统计学意义(P<0.05)。与LPS对照组比较, LPS+中药组、LPS+PTDC+SB203580+中药组的TLR4、Myd88、IL-1、IL-6、TNF-αmRNA表达,则降低明显,差异均具统计学意义(P<0.05)。与LPS+中药组比较,LPS+PTDC+SB203580+中药组的TLR4、Myd88、IL-1、IL-6、TNF-αmRNA表达,有所降低,但无明显差异(P>0.05)。结果见表2。
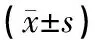
表2 TLR4/MyD88信号通路相关因子mRNA表达情况
注:与空白组比较,▲P<0.05;与LPS对照组比较,★P<0.05
2.3 各组大鼠胆管组织TLR4/MyD88信号通路及下游炎症因子相关蛋白表达比较
统计结果显示,与空白组比较,LPS对照组、LPS+PTDC+SB203580组的TLR4、Myd88、IL-1、IL-6、TNF-α蛋白表达,均上升明显,差异均具统计学意义(P<0.05)。而与LPS对照组比较, LPS+中药组、LPS+PTDC+SB203580+中药组的TLR4、Myd88、IL-1、IL-6、TNF-α蛋白表达,则下降显著,差异均具统计学意义(P<0.05)。与LPS+中药组比较,LPS+PTDC+SB203580+中药组的TLR4、Myd88、IL-1、IL-6、TNF-αmRNA表达,有所下降,但两组之间无明显差异(P>0.05)。结果见表3。各组大鼠胆管组织TLR4、Myd88、IL-1、IL-6、TNF-α蛋白表达电泳图见图2。
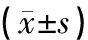
表3 TLR4/MyD88信号通路相关因子蛋白表达情况
注:与空白组比较,▲P<0.05;与LPS对照组比较,★P<0.05

注:1:正常组;2:LPS组;3:LPS+PTDC+SB203580组;4:LPS+中药组;5:LPS+PTDC+SB203580+中药组图2 各组大鼠胆管组织相关蛋白电泳图
3 讨论
胆石症,在中医方面可依据其临床表现归属于“胁痛”“黄疸”等范畴。《灵枢·胆经》曰:胆,足少阳之脉,是动则病口苦,善呔息,心胁痛,不能转侧。《伤寒论》曰:“结胸实热,脉沉而紧,心下痛;按之实硬,寒热往来,身黄如桔色”。中医认为,外感六淫、情志不畅、饮食失节或蛔虫上扰,导致肝胆气机不畅,肝失疏泄,郁久化热,湿热蕴蒸于肝胆,与胆汁互结,日久成石,堵塞于胆道而发为胆石症。亦或因久病耗阴、脾胃虚弱,引起精血不足,肝阴不足,疏泄失常,累及胆腑,胆汁通降不畅,久积成石。因此,六腑以通为用,对于胆石症的治疗,疏利肝胆、清热利湿是主要原则[7]。金钱草、柴胡、鸡内金、郁金及泽兰等药物同奏清热利湿、疏利肝胆之效,为治疗胆石症的经验要药。中医大家朱良春认为,肝脏体阴而用阳,慢病日久易耗伤阴血,故治疗时不可一味使用疏肝利胆之药物,应适量加入白芍、黄芪等养阴柔肝、补气升阳之品[8]。
从现代医学角度而言,胆石症的发病机制与胆道炎症反应密切相关[9]。胆管炎症导致了胆管慢性纤维化、胆道狭窄以及胆汁流体动力学改变,促进了胆结石的形成。胆道炎症首先表现为胆管内表面不平整,逐渐发展为胆管纤维化,胆管扩张或者狭窄,导致胆汁通过时发生流体动力学改变,进一步引起胆汁淤滞,同时炎症导致胆囊收缩功能减弱,胆汁过分浓缩,胆汁中的胆固醇及胆色素呈过度饱和状态,沉淀结晶,从而形成胆道结石。胆管炎症生物分子学机制研究表明,在胆管细胞炎性损伤过程中, LPS激活了TLR4/MyD88信号通路加重炎性反应引起结石并导致结石复发率的上升[10]。基于此,药物治疗胆石症通常以削弱炎症信号通路,减轻炎症反应为主要靶点机制,从而达到减少结石形成为目的。
控制长期慢性胆管炎症对胆石症的治疗有着至关重要的作用。大黄灵仙方是广西中医药大学第一临床医学院肝胆外科治疗胆石症的经验要方。从中医角度而言,大黄灵仙方契合了胆石症的病因病机,重在清热利湿、疏肝利胆排石。前期实验研究表明,大黄灵仙方能有效缓解胆道炎症,改善肝脏胆固醇代谢和胆汁酸代谢,能有效防治胆石症[11]。
在本研究中,从大黄灵仙方与炎症信号通路关系角度出发,探讨大黄灵仙方通过调控LR4/MyD88信号通路缓解胆道炎症的具体机制。研究显示,LPS对照组大鼠胆管组织病理形态学方面较空白组差,胆管组织TLR4、Myd88、IL-1、IL-6、TNF-α基因及蛋白表达明显增高,提示经LPS诱导后的对照组大鼠其TLR4/MyD88信号通路呈现出高表达状态,大鼠胆管炎症反应明显。LPS+中药组、LPS+PTDC+SB203580+中药组的大鼠在胆管病理组织形态学方面较LPS对照组有明显改善,其胆管组织TLR4、Myd88、IL-1、IL-6、TNF-α基因及蛋白表达显著下降,表明了大黄灵仙方能有效调控胆管炎症状态,其机制与通过下调TLR4/MyD88信号通路各节点分子蛋白相关。本课题结果证实了大黄灵仙方能够有效改善胆管细胞病理形态结构,下调TLR4/MyD88炎性信号通路的表达水平,通过抑制TLR4、MyD88的活化,阻断下游炎症因子的表达,修复胆管损伤,促使胆道恢复至非炎症状态,从而预防及治疗胆石病。
