甘薯蔗糖转运蛋白基因IbSUT3 的克隆及功能分析
2020-07-02王丹丹柳洪鹃王红霞史春余
王丹丹 柳洪鹃 王红霞 张 鹏,* 史春余
1 山东农业大学农学院, 山东泰安 271018; 2 中国科学院分子植物科学卓越创新中心 / 植物生理生态研究所植物分子遗传国家重点实验室, 上海 200032
在高等植物中, 光合同化物从源器官到库器官的长距离运输以蔗糖为主要形式[1]。蔗糖不仅可以作为碳源为植物生长发育提供营养物质, 而且可以作为信号物质参与植物体内的信号转导过程[2]。在源器官中, 蔗糖以共质体或质外体的途径被装载到韧皮部细胞, 通过筛管运输后再以共质体或质外体途径卸载到库器官中[3]。在质外体的装载或卸载过程中, 蔗糖转运蛋白(sucrose transporters or carriers, SUTs or SUCs)起重要作用[4]。
蔗糖转运蛋白是一种典型的膜结合蛋白, 属于MFS家族, 具有12个典型的跨膜结构域, 存在于植物的组织或细胞中, 利用胞内外的H+浓度对蔗糖进行跨膜运输[5]。迄今为止, 已经发现拟南芥、水稻、马铃薯、玉米等多种植物蔗糖转运蛋白基因[6-9]。反义抑制PtaSUT4、StSUT4、NtSUT1的转基因植株表现出生长受阻, 源叶中蔗糖含量升高, 库器官中蔗糖含量降低, 生物量下降[10-12]。AtSUC2和AtSUC4突变体的种子和幼苗对干旱、高盐、冷胁迫和ABA 处理超敏感, 并且叶片中的蔗糖含量较高, 而根中的蔗糖含量较低[13]。目前, 关于蔗糖转运蛋白的研究主要集中于其如何介导蔗糖在源库间的运输与分配以及如何参与逆境、糖信号的响应。
甘薯作为以地下器官为产品的双子叶作物, 其产量形成与光合产物的运输密切相关, 因此弄清关键性膜蛋白的运输机制对提高甘薯产量至关重要。李岩从甘薯中分离出IbSUT1和IbSUT2, 并在酵母中验证其转运功能,免疫定位发现IbSUT2定位于筛管伴胞复合体; 同时发现IbSUT1x编码的蛋白定位于酵母细胞膜且不具有蔗糖转运功能[14-15]。上述报道指出, 虽然甘薯蔗糖转运蛋白的研究已取得部分进展, 但仍有大量信息值得深入挖掘。本研究首先采用RT-PCR 结合RACE 技术, 从甘薯中克隆得到IbSUT3基因, 并对其进行生物信息学分析;利用酵母突变菌株SUSY7/ura3 对其转运功能进行验证;利用烟草原生质体进行亚细胞定位分析; 通过实时荧光定量PCR, 研究IbSUT3组织表达模式以及在非生物胁迫(干旱、高盐、低温)和外源ABA 处理下的表达特性, 研究其在胁迫处理下的响应机制, 为深入研究IbSUT3基因的功能奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 植物材料 选用“泰中6 号(鉴定编号为国品鉴2013003)”为甘薯[Ipomoea batatas(L.) Lam.]试验材料。将甘薯组培苗单节点扩繁后种于组培瓶中, 每瓶 3 棵,置光照培养箱中培养, 16 h 光照/8 h 黑暗, 温度25 ℃, 光照强度600 μmol m-2s-1, 用于胁迫处理。用于亚细胞定位的烟草为本氏烟草(Nicotiana benthamianaDomin), 种子撒播于花盆中, 待烟草生长1 个半月后, 用于原生质体的提取。
1.1.2 菌种与质粒 大肠杆菌DH5α 购自北京全式金生物有限公司。酵母菌株 SUSY7/ura3、酵母表达载体P416、GFP 表达载体PUC18 均由中国科学院植物生理研究所张鹏老师实验室提供。
1.1.3 试剂 RNA 提取试剂盒RNAprep Pure plant Kit购自TIANGEN 公司(中国); SMARTer-RACE 试剂盒购自Clontech 公司; 逆转录试剂盒 ReverTra Ace qPCR RT Master Mix 购自TOYOBO 公司; pMD18T 载体、Marker、SYBR Premix Ex Tap 荧光定量试剂盒均购自宝生物工程(大连)有限公司。脱落酸(ABA)购自Sigma 公司(美国)。
1.2 材料处理
选择生长3 个月且长势一致的大田甘薯植株5 株, 分别取叶片(leaf, L; 即第3 片展开叶)、叶柄(petiole, B)、茎(stem, J)、白须根(white root, WR)、发育根(developmental root, DR; 即指刚开始膨大的块根)和成熟根(mature root,MR; 即指膨大时间较长的块根), 用于荧光定量PCR 的测定, 研究IbSUT3基因在不同组织中的表达情况。将甘薯组培苗培养到株高 4 cm, 分别进行低温(4 ℃)、高盐(200 mmol L-1NaCl)、干旱(300 mmol L-1Mannitol)以及脱落酸(25 µmol L-1ABA)胁迫处理, 分别于胁迫处理9、12 和24 h 取样, 每个时间点取3 株植株地上部叶片, 液氮速冻。
1.3 IbSUT3 基因的克隆
从4 cm 高的组培苗取约100 mg 叶片, 液氮研磨至粉末状, 转至1.5 mL 离心管中, 利用试剂盒提取总RNA。根据植物SUT 基因的保守序列设计简并引物E3-F 和E3-R(表1), 扩增IbSUT3基因的EST 序列并测序。根据测序结果设计3'和5'端特异性引物(Sp-R1,2 和Sp- F1,2)(表1),参照RACE 试剂盒SMART RACE cDNA Amplification Kit(Clontech)说明书进行IbSUT3基因的3'端和5'端扩增并测序。序列拼接并设计扩增全长的引物IbSUT3-F 和IbSUT3-R (表1), 以叶片cDNA 为模版进行PCR 扩增, 程序为98℃预变性5 min; 98℃变性10 s, 55℃退火10 s, 72℃延伸15 s, 32 个循环; 72℃延伸10 min。以1%琼脂糖凝胶电泳检测扩增结果。
1.4 IbSUT3 基因的生物信息学分析
经测序所得的氨基酸序列, 利用NCBI 的ORF Finder,参照 Kozak 法则分析该基因的开放阅读框。采用ProtParam (http://web.expasy.org/protparam) 分析蛋白质的理化性质、亲疏水性以及跨膜结构; DNAman 进行氨基酸多序列比对; MEG5.2 的NJ 算法进行系统进化树的构建,设bootstrap 值为1000。
1.5 qRT-PCR 分析
胁迫处理前后的样品, 加液氮迅速研磨成粉末, 根据试剂盒的操作步骤提取组织RNA, 反转录为cDNA (统一浓度为100 ng µL-1)。运用Primers3Plus 设计IbSUT3基因的实时荧光定量PCR 引物(表1)。以甘薯Actin为内参基因, 每个样品3 个平行, 3 次生物学重复, 采用2-ΔΔCt方法分析试验结果。所用操作软件为Bio-Rad CFX Manager,反应程序为95℃ 1 min; 95 ℃ 15 s, 55 ℃ 30 s, 72 ℃ 45 s,共39 个循环; 溶解曲线, 65℃到95 ℃, 每5 s 增加0.5℃。
1.6 酵母功能验证
前人常使用酿酒酵母突变株SUSY7/ura3 对蔗糖转运功能进行验证, 该菌株只能够利用胞内蔗糖而不能利用胞外蔗糖, 只有在导入具有蔗糖转运功能的外源蛋白的情况下才能在以蔗糖为唯一碳源的培养基上正常生长[16]。运用PrimerPrimer 5.0 设计带有酶切位点(CalI 和SmaI)的引物SUT3m-F 和SUT3m-R (表1), 通过PCR 扩增得到带有酶切位点的IbSUT3基因的开放阅读框(ORF)区。构建酵母表达载体 P416-IbSUT3, 转化酵母菌株SUSY7/ura3。挑取正确表达的单克隆菌斑, 用0.9%NaCl调制OD~1, 然后稀释成10-1、10-2、10-3和10-4, 取10 µL分别点于含2%蔗糖和2%葡萄糖的酵母培养基中。培养基配方为1.7 g L-1酵母基础培养基YNB (Difco), 2%蔗糖(Difco)或2%葡萄糖(Difco), 5 g L-1硫酸铵, 20 mg L-1色氨酸和1.5%琼脂糖, 用HCl 调节至pH 为5.0。30℃培养3 d后, 观察菌斑生长情况。
1.7 亚细胞定位分析
运用PrimerPrimer 5.0 设计带有酶切位点(SalI 和SpeI)的引物SUT3g-F 和SUT3g-R (表1), 通过PCR 扩增得到带有酶切位点且不含有终止密码子的IbSUT3基因的ORF区。构建GFP 表达载体CaMV35S:IbSUT3-GFP (PUC18),转化烟草叶片原生质体。提取烟草叶片原生质体参考Drechsel 的方法[17]; 采用PEG 介导法, 将GFP 融合蛋白转入原生质体参照Abel 的方法[18]。
用配备 603/1.2 NA UPLSAPO 油镜(Olympus)的Olympus FV1000 共聚焦扫描显微镜观察烟草叶片原生质体。通过用473 nm 激光激发并在487 nm 和521 nm 之间发射, 观察到GFP 荧光。通过用559 nm 激光激发并在606 nm 至673 nm 之间发射, 观察到叶绿体自发荧光。
1.8 数据处理
所有试验数据均由3 次重复试验获得, 应用DPSS 软件分析差异显著性, 运用最小显著性差数法(LSD)进行单因素方差分析, 差异显著性水平均为P<0.005。

表1 引物信息Table 1 Information of primers
2 结果与分析
2.1 IbSUT3 基因的获得及序列分析
2.1.1IbSUT3基因的克隆 为了分析甘薯蔗糖转运蛋白的功能, 本研究克隆了一个基因(GenBank 登录号为MN233361)并命名为IbSUT3。通过简并引物扩增得到IbSUT3基因的EST 序列, 长度为267 bp。再根据NCBI和PrimerPrimer 5.0 软件设计3'-RACE 和5'-RACE 的基因特异性引物, 进行5'-DNA 和3'-DNA 克隆, 得到的片段长度分别为426 bp 和1425 bp, 拼接两者得到IbSUT3基因的全长。根据拼接序列设计引物扩增全长, 得到1607 bp的序列片段(图1)。
2.1.2IbSUT3基因编码蛋白的理化性质 ORF 大小为1518 bp, 编码的蛋白质有505 个氨基酸。该蛋白的分子量为53.82 kD, 等电点(pI)为9.19; 正电荷残基(Asp + Glu)有31 个, 负电荷残基(Arg + Lys)有41 个; 总的亲水性平均系数为0.572, 预测IbSUT3基因编码的蛋白为疏水性蛋白。TMHMM 软件预测蛋白跨膜结构域显示,IbSUT3基因编码的蛋白具有12 个跨膜结构域(图2)。
2.1.3IbSUT3序列比对和进化树分析 将IbSUT3编码的氨基酸序列与拟南芥(Arabidopsis thaliala)、烟草(Nicotiana tabacum)、马铃薯(Solanum tuberosum) 3 个代表性物种中的SUTs编码氨基酸进行序列多重比对(图3)显示,该基因编码的蛋白与其他物种的SUTs 蛋白的氨基酸序列具有较高同源性, 保守区域分析发现IbSUT3基因所编码的蛋白同属于MFS 蛋白家族, 暗示其功能的高度保守。
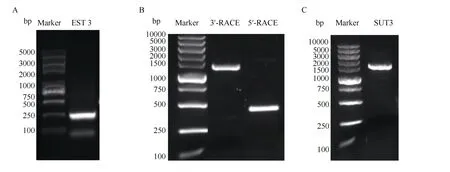
图1 IbSUT3 基因扩增结果Fig. 1 PCR amplified products of IbSUT3

(图3)
为进一步了解IbSUT3与其他物种基因之间的进化关系, 选取不同物种的SUT 蛋白序列, 使用MEGA5.2 软件,采用Neighbor-Joining 原理构建系统进化树(图4)。分析发现,IbSUT3编码的蛋白属于Group I 亚族, 并且IbSUT3、IbSUT1y、IbSUT2y、NtSUT1以及NtSUT3处在同一进化支上, 说明它们的亲缘关系较近。
2.2 IbSUT3 酵母功能验证
为确认IbSUT3基因编码的蛋白是否具有转运蔗糖的功能, 构建酵母菌株表达载体, 并转化酵母。结果表明,在含有2%蔗糖作为唯一碳源的培养基上,IbSUT3转化的SUSY7/ura3 酵母菌株相比空载体转化的酵母菌株能更好地生长(图5-A); 但在含有2%葡萄糖为唯一碳源的培养基上,IbSUT3及空载体转化的SUSY7/ura3 酵母菌株生长情况没有差异(图5-B)。IbSUT3的表达使SUSY7/ura3 酵母菌株能够在蔗糖为唯一碳源的培养基上生长, 说明IbSUT3编码了一种具有转运蔗糖功能的蛋白。
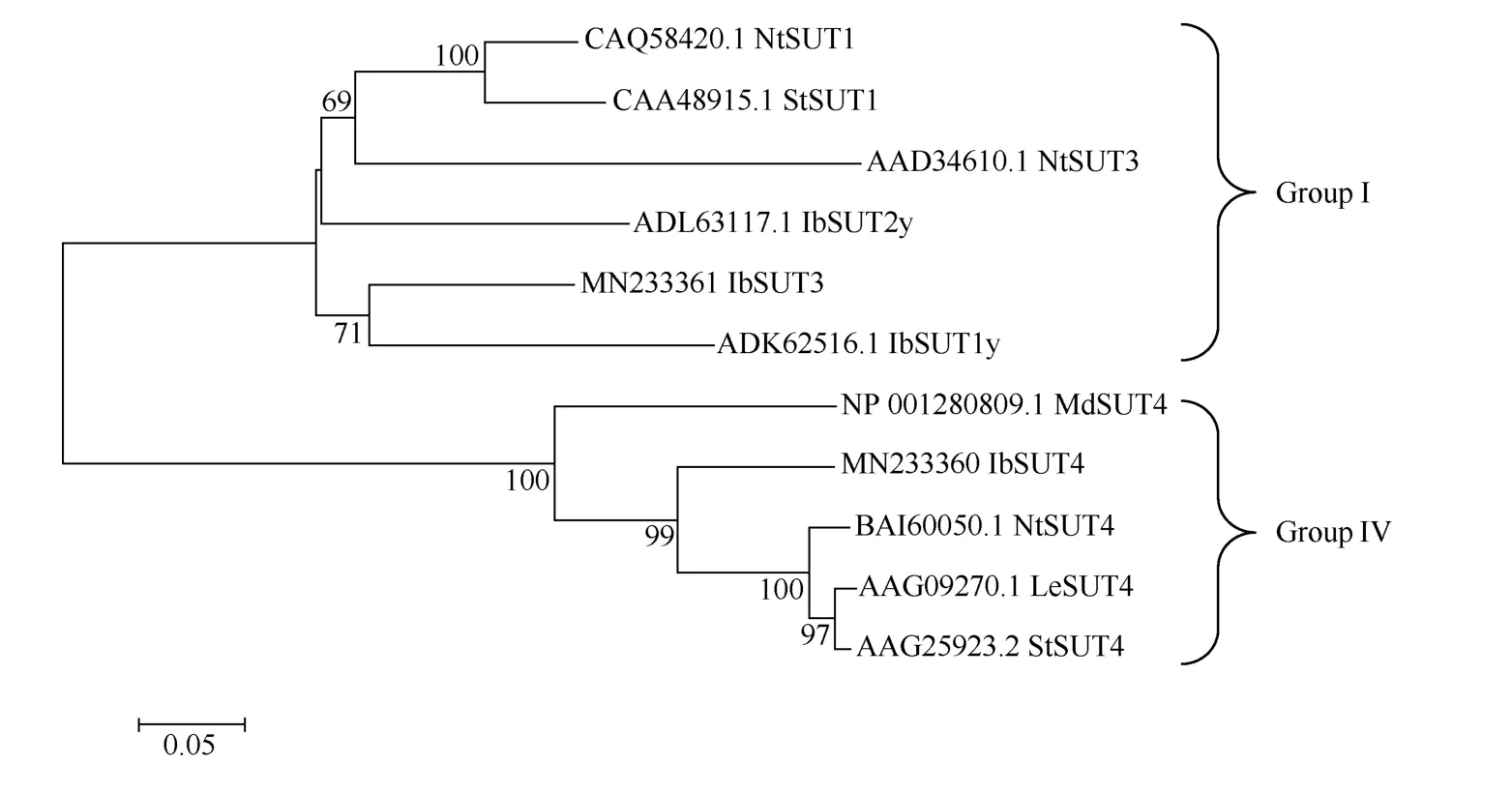
图4 IbSUT3 与其他植物SUTs 蛋白的系统发生分析Fig. 4 Phylogenetic analysis between IbSUT3 and SUTs proteins from other plants species

图5 IbSUT3 功能分析Fig. 5 IbSUT3 function analysis
2.3 IbSUT3 蛋白亚细胞定位
为探索IbSUT3 蛋白在植物亚细胞结构中的分布, 构建了IbSUT3基因的GFP 表达载体CaMV35S::IbSUT3-GFP。将载体转化到烟草原生质体中, 借助绿色荧光蛋白信号确定目标蛋白在原生质体内的分布。PEG 介导原生质体转化18 h 后, 通过共聚焦激光扫描显微镜观察显示,转CaMV35S-GFP 载体的烟草原生质体内绿色荧光分布在整个原生质体膜、胞质和细胞核中, 转 CaMV35S::IbSUT3-GFP(图6)载体的烟草原生质体内绿色荧光蛋白均匀分布于质膜, 说明IbSUT3 蛋白分布于质膜上。
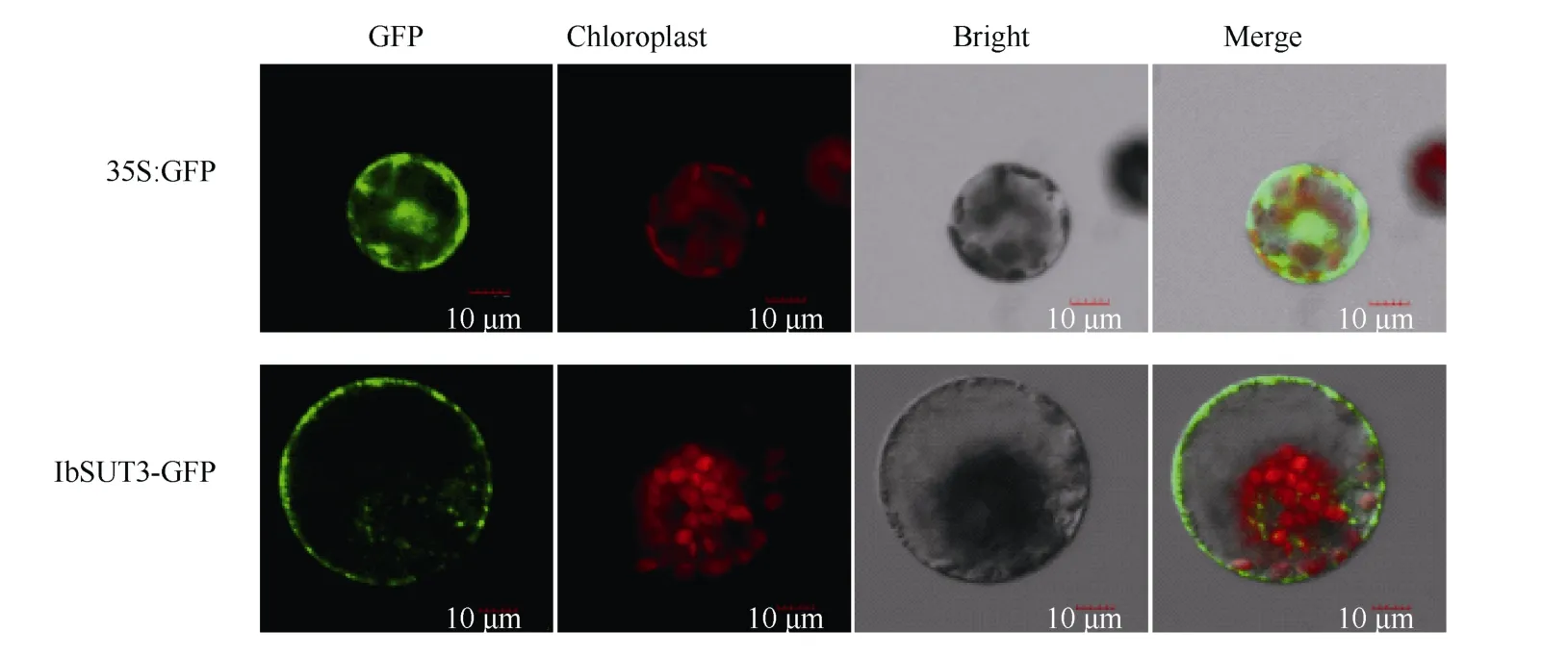
图6 IbSUT3 亚细胞定位分析Fig. 6 Analysis of IbSUT3 subcellular localization
2.4 IbSUT3 基因的表达模式分析
2.4.1IbSUT3基因在不同组织中的表达 分别提取甘薯植株不同部位的RNA 进行qRT-PCR 检测, 分析IbSUT3基因在不同组织中的表达模式表明,IbSUT3基因在整株植物中具有相对较高的表达, 其中在L (叶片)中相对表达最高, 在J (茎)中相对表达量最低(图7)。
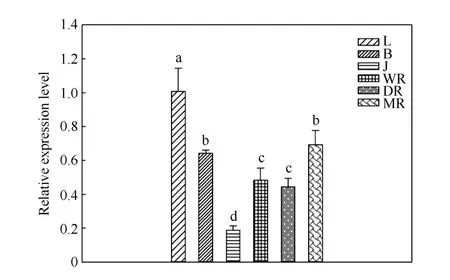
图7 IbSUT3 基因在不同组织中的表达Fig. 7 Expression of IbSUT3 in different tissues
2.4.2IbSUT3基因在非生物胁迫及外源ABA 处理下的表达模式 低温(4 ℃)、高盐(200 mmol L-1NaCl)、干旱(300 mmol L-1Mannitol)以及脱落酸(25 µmol L-1ABA)处理均可诱导IbSUT3基因的表达(图8)。与对照处理(0 h)相比, 胁迫处理9~24 h时IbSUT3基因的表达均呈现上升的趋势, 仅在干旱处理12 h 时出现下降趋势, 但下降不显著。在低温、高盐及干旱处理条件下, 与9 h 和24 h 相比, 处理12 h 时IbSUT3基因的表达量较低, 这可能与该取样时间在夜间有关。
3 讨论
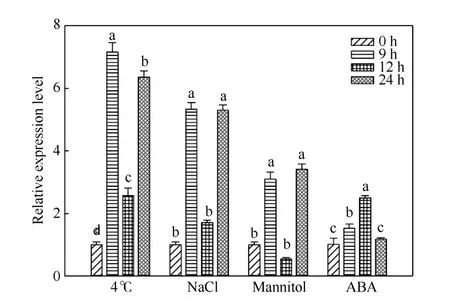
图8 IbSUT3 在胁迫处理下的表达模式Fig. 8 Expression profiles of IbSUT3 under stresses
由于蔗糖是光合作用的主要产物, 是植物贮藏、运输和利用糖分的主要形式, 其运输和分配的结果将直接影响作物的产量和品质[19], 所以分离、鉴定甘薯中的蔗糖转运蛋白, 深入了解其功能, 不仅有助于了解甘薯体内光合产物的运输、分配过程, 而且可以分析其对产量和品质的影响, 进而为实现甘薯高产优质提供理论依据。本研究填补了甘薯蔗糖转运蛋白研究的空缺, 首次成功克隆了甘薯IbSUT3基因, 该基因编码的蛋白属于Group I 亚族, 定位于质膜且具有转运蔗糖的功能。IbSUT3基因在叶片中高表达且响应多种胁迫处理, 暗示IbSUT3可能参与蔗糖装载过程、参与植物抗逆反应。
3.1 IbSUT3 具有蔗糖转运功能
SUTs 家族在植物中最典型的功能是将蔗糖转运到韧皮部中, 以实现光合同化物的长距离运输。因此对于SUTs 的研究, 首先需要分析其是否具有转运功能。本研究从甘薯品种“泰中6 号”中克隆得到的IbSUT3基因, 其编码的蛋白通过在缺陷酵母中进行异源表达, 发现可以互补缺陷酵母的蔗糖吸收, 说明其编码的蛋白具有蔗糖转运的功能(图5)。拟南芥AtSUC4和小麦的TaSUT2A、TaSUT2B和TaSUT2D等均通过此试验验证了蛋白的转运功能[20-21]。
3.2 IbSUT3 基因在叶片中表达较高
已有研究指出Group I亚族的蔗糖转运蛋白主要在源器官中表达, 并且对蔗糖的韧皮部装载和长距离运输起着非常关键的作用[22-24]。在反义抑制StSUT1的马铃薯植株中,SUT1基因的表达量下降, 植株生长迟缓, 而且在叶片中积累大量的可溶性糖和淀粉, 最终导致块茎产量降低[22]。反义抑制NtSUT1的烟草植株表现出植株生长减缓, 叶片中蔗糖的输出速率大大降低, 导致蔗糖在叶片中大量积累[25]。本研究发现,IbSUT3基因编码的蛋白属于Group I亚族(图4)且在源叶中高表达(图7), 这暗示着该基因编码的蛋白参与了蔗糖在韧皮部的装载。源叶中的蔗糖能够及时高效地装载到韧皮部, 对光合产物从源器官到库器官的运输至关重要, 对甘薯产量的形成意义重大。
3.3 IbSUT3 基因响应多种非生物胁迫
Xu 等[26]通过分析 5 种双子叶植物(Arabidopsis thaliana、Glycine max、Solanum tuberosum、Solanum lycopersicum、Populusspp.)和4 种单子叶植物(Zea mays、Oryza sativa、Triticum aestivum、Hordeum vulgare)中SUTs对逆境处理的响应情况, 证明SUTs 在植物抵抗逆境过程中发挥重要作用。在盐胁迫下, 所有芹菜组织中的AgSUT1基因的表达均降低, 根系中降低更为显著, 这可能表明在盐胁迫下根系对蔗糖代谢需求降低[27]。AtSUC2和AtSUC4在低温、高盐、干旱及外源ABA 处理下基因的表达发生明显变化, 且通过ABA-依赖的信号通路抵抗胁迫[13]。上述研究均证实SUTs 作为重要的调控因子参与逆境响应, 但是关于甘薯IbSUT3基因是否参与逆境响应尚未明确。本研究发现非生物胁迫均可诱导IbSUT3基因的表达发生显著变化, 且在低温、高盐及干旱处理下的表达模式呈现相同规律(图8), 这意味着IbSUT3可能以相同的机制响应这3 种胁迫处理。IbSUT3基因在非生物胁迫下的诱导表达, 表明该基因在甘薯抗逆中发挥重要作用。
