儿童幽门螺杆菌根除治疗过程中肠道菌群的变化
2020-06-30于佳鹭李在玲
于佳鹭 李在玲
北京大学第三医院儿科(北京 100191)
儿童幽门螺杆菌感染率地区差异较大,分布在1.8%~65.0%[1],发展中国家感染率更高,目前三联标准化方案的根除率已不能满足临床需要。肠道菌群作为人体“第二基因库”,可通过能量传递、物质代谢、免疫调节等诸多方面维持肠道内环境稳定,影响疾病转归。此外研究发现,抗生素、质子泵抑制剂等药物可改变肠道菌群构成,这种改变可能导致菌群紊乱,引起消化系统合并症。因此,肠道菌群与幽门螺杆菌根除治疗之间存在着密切联系。本研究通过16 SrDNA测序分析幽门螺杆菌感染儿童肠道菌群结构,探究儿童幽门螺杆菌根除治疗过程中肠道菌群动态变化,并通过寻找显著性差异菌群,评估肠道微生物对幽门螺杆菌根除治疗的影响。
1 对象及方法
1.1 研究对象
选择2019年7月—11月在北京大学第三医院儿科就诊的幽门螺杆菌感染儿童作为研究对象。纳入标准:①年龄5~16 岁;②符合我国儿童幽门螺杆菌感染诊治专家共识[2]诊断标准,并有根除治疗适应症;③排除合并血液病、恶性肿瘤、炎症性肠病、嗜酸粒细胞性胃肠炎者,且4周内无抗生素、质子泵抑制剂、益生菌使用史;④排除治疗期间有其他幽门螺杆菌感染患者接触史者,治疗期间无合并使用其他药物。
幽门螺杆菌根除治疗均选用三联标准化方案:口服奥美拉唑、阿莫西林、克拉霉素抗感染14 天,治疗后至少停药1 个月复查13C 呼气试验判断疗效。留取患儿治疗前、治疗7 天和14 天时新鲜粪便进行16SrDNA测序。
治疗效果评判标准:至少停药1个月后复查13C呼气试验,呼气试验阴性判定为治疗成功,呼气试验阳性为治疗失败。既往史判定标准:1年内有幽门螺杆菌感染史并进行三联标准化治疗14天,至少停药1个月后复查13C呼气试验阳性,在本次复治后复查13C呼气试验阴性者判定为复治成功;既往无幽门螺杆菌根除治疗史,本次初治后复查13C 呼气试验阴性者判定为初治成功。根据取样时间分为治疗前组、治疗7天组、治疗14天组;根据治疗效果分为治疗成功组、治疗失败组;根据既往史分为复治成功组、初治成功组。
本研究方案经北京大学第三医院伦理委员会批准,研究对象或家属均签署知情同意书。
1.2 方法
1.2.1 临床资料收集 记录符合标准患儿的年龄、性别及临床表现,记录根除治疗过程中是否规律用药、有无合并用药,并记录治疗过程中症状改善及不良反应发生情况。
1.2.2 16 SrDNA 测序方法 采集新鲜、没有接触空气和地面的中间段粪便置MGIEasy 粪便样本采样管内,2 小时内冰袋冷藏运送至实验室,-80 ℃低温保存。应用QIAamp Fast DNA Stool Mini Kit(货号51604,Qiagen,德国)进行DNA提取。应用Thermo NanoDrop 2000紫外微量分光光度计和1%琼脂糖凝胶电泳进行质检。应用PCR扩增基因序列V3-V4区。引物序列分别为341F:5’-CCT ACG GGR SGC AGC AG-3’,806 R:5’-GGA CTA CVV GGG TAT CTA ATC-3’。PCR产物使用2%浓度琼脂糖凝胶进行电泳检测,回收DNA片段后应用Qubit 2.0(Invitrogen,U.S.)进行文库构建,HiSeq/MiSeq平台PE250策略(Illumina,Inc.,CA,USA)对V3-V4区进行双末端测序。
1.2.3 数据处理与生物学分析 使用UPARSE 根据 97%相似度对所有Clean Reads 进行OTU 聚类,选取OTU代表性序列,使用RDP数据库(http://rdp.cme.msu.edu/),利用RDP Classifer(http://rdp.cme.msu.edu/)进行物种注释分析(置信度阈值设置为0.8)。α多样性分析微生物群落的丰度和多样性,菌群丰度指数有Chao1指数,指数越大表示样本中物种数量越多;多样性指数包括Shannon、Simpson指数,Shannon指数越大、Simpson指数越小说明样本群落多样性越高。β多样性分析用于比较不同组菌群结构的差异,主坐标分析(PCoA分析)中,样本距离越接近表示菌群结构越接近。Adonis分析通过线性模型分析不同分组因素对样本差异的稀释度并进行显著性分析,R2表示不同组对样本差异的解释度,R2越大表示样本稀释度越高,P值越小,表明组间差异显著性越强。LEfSe 采用线性判别分析(LDA 积分)估算每个物种丰度对差异效果影响的大小,使用秩和检验对不同组间进行显著性差异分析,找出对组间划分产生显著性差异影响的物种。
1.3 统计学分析
采用SPSS 22.0 统计软件进行数据处理。正态分布计量资料以均数±标准差表示,非正态分布计量资料以中位数(四分位数间距)表示,组间比较采用非参数秩和检验。计数资料以百分比表示,组间比较采用Fisher 精确概率法。α 多样性指数采用秩和检验进行组间比较(若两组样品比较则使用R 3.5.1中的wilcox.test函数,若两组以上的样品比较则使用kruskal.test函数),β多样性指数应用R软件包中的“R vegan”计算。LEfSe分析以LDA阈值为2筛选差异物种,并进一步通过组间秩和检验(显著性筛选阈值为P<0.05)筛选属水平差异菌。以P<0.05表示有统计学意义。
2 结果
2.1 治疗过程中儿童临床症状改变
共纳入符合标准的患儿32例。中位年龄10岁(范围5~16岁),平均10.59岁;男性19例(59.4%),女性13例(40.6%)。临床表现主要有腹痛28例(87.50%)、食欲不振23例(71.87%)、嗳气19例(59.38%)、恶心15例(46.88%)、反酸2例(6.25%),没有无症状感染者。纳入患儿均规律用药,无漏服、停药、合并用药等情况。患儿在治疗过程中临床症状较前改善,表现为腹痛、恶心、嗳气程度减轻及发作频率减少,食欲改善。治疗期间未监测到明显的腹泻、便秘、呕吐等症状。
根据取样时间分为治疗前组31例(男19例、女12例)、治疗7天组11例(男8例、女3例)、治疗14天组8例(男3例、女5例),年龄分别为(10.52±3.39)岁、(10.00±3.41)岁、(10.25±3.20)岁。三组间性别、年龄差异无统计学意义(P=0.325、0.905)。
根据治疗效果分为治疗成功组22例(男14例、女8例)、治疗失败组10例(男5例、女5例),年龄分别为(10.80±3.36)岁和(10.50±3.45)岁。两组间性别、年龄差异无统计学意义(P=0.820、0.700)。
根据既往根治病史分为复治成功组5例(男4例、女1例)、初治成功组18例(男11例、女7例),年龄分别为(12.00±3.54)岁和(9.83±3.43)岁。两组间性别、年龄差异无统计学意义(P=0.230、0.620)。
2.2 肠道菌群种类及丰度差异
幽门螺杆菌感染儿童肠道菌群优势菌门依次为厚壁菌门、拟杆菌门、变形菌门、放线菌门、疣微菌门。治疗成功组与失败组儿童肠道菌群在门水平差异无统计学意义(P>0.05);但在应用三联疗法根除幽门螺杆菌过程中,厚壁菌门、拟杆菌门比例下降,变形菌门比例升高(图1)。

图1 不同分组门水平菌群profiling 柱状图
分析幽门螺杆菌感染儿童肠道菌群特点发现,拟杆菌属、栖粪杆菌属、大肠杆菌/志贺菌属、双歧杆菌、Gemmiger属、克雷伯菌属为主要优势菌属(图2)。与治疗成功组相比,普氏菌属在治疗失败组相对丰度升高,差异有统计学意义(Z=3.61,P<0.001)。
幽门螺杆菌根除治疗前、治疗7 天和14 天比较,各菌群相对丰度均发生改变,差异有统计学意义(P<0.05);治疗7天和14天,粪杆菌属、罗斯菌属、双歧杆菌属、Gemmiger属、瘤胃球菌属丰度均降低,而大肠杆菌/志贺菌属、克雷伯菌属、链球菌属丰度均升高。见表1。
与复治成功组相比,初治成功组儿童双歧杆菌属、粪杆菌属、Gemmiger属、瘤胃球菌属、副杆菌属相对丰度升高,克雷伯菌属相对丰度降低,差异有统计学意义(P<0.05)。见表2。

表1 治疗过程中肠道菌群在属水平差异性比较[M(P25~P75)]
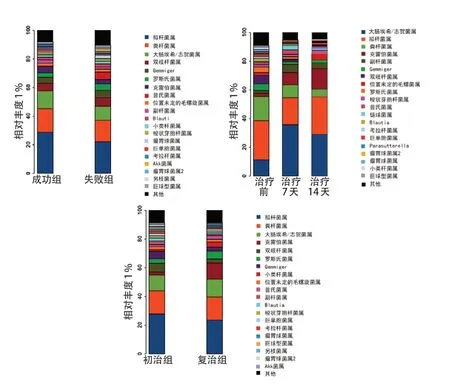
图2 不同分组属水平菌群profiling 柱状图
2.3 肠道菌群α与β多样性
治疗成功组、失败组之间α多样性指数Chao1、Shannon、Simpson差异均无统计学意义(P>0.05);β 多样性分析中,PCoA 分析显示治疗成功、失败组肠道菌群结构接近,Adonis 分析显示治疗成功、失败组肠道菌群结构差异无统计学意义(R2=0.037,P=0.170)。
治疗前、治疗7 天、治疗14 天组之间α 多样性指数Chao1、Shannon、Simpson差异有统计学意义(P<0.05);治疗7天、治疗14天的Chao1、Shannon指数呈现降低趋势。见表3。β多样性分析中,PCoA分析显示治疗前组肠道菌群结构与治疗7 天、治疗14天组菌群结构差异较大(图3);Adonis分析显示,治疗前、治疗7天、治疗14天组菌群结构存在显著差异(R2=0.103,P=0.001)。
2.4 肠道菌群显著性差异分析
LEfSe 分析及组间秩和检验发现,治疗失败组弓形杆菌属、肠道巴恩斯菌属、Coprobacter、粪球菌属、霍尔德曼菌属、假单胞菌属高于治疗成功组,差异有统计学意义(LDA>2)。与初治成功组相比,不动杆菌属、魏斯菌属、萨特菌属、普罗维登斯菌属在复治成功儿童中显著升高(LDA>2),另枝菌属、丹毒丝菌属、梭状芽胞杆菌属、粪杆菌属、Gemmiger 属显著降低(LDA>2)。

表2 初治/复治成功儿童肠道菌群在属水平差异性比较[M(P25~P75)]

图3 治疗前、治疗7 天及14 天组肠道菌群主坐标分析(PCoA 分析)

表3 治疗成功组与失败组不同治疗时间α多样性比较
3 讨论
人肠道微环境在3 岁左右趋于稳定,其中拟杆菌门和厚壁菌门占90%。健康儿童粪便优势菌群由厚壁菌门(50.8%)、拟杆菌门(42.7%)组成,厚壁菌门/拟杆菌门比例约为1.2,变形杆菌门、放线菌门和梭杆菌门共计少于5%[3]。厚壁菌门/拟杆菌门比例升高是一种与炎症反应有关的微生物特征[4]。本研究中,幽门螺杆菌感染儿童肠道内拟杆菌门比例为28.5%,变形菌门比例为16.1%,厚壁菌门/拟杆菌门比例为1.7,其中优势菌属主要为拟杆菌、栖粪杆菌、大肠杆菌/志贺菌、双歧杆菌、Gemmiger、克雷伯菌。对成人幽门螺杆菌感染的研究发现,大肠杆菌通过影响亚硝酸盐代谢促进胃黏膜恶变[5],临床上可作为提示慢性幽门螺杆菌感染进展为胃癌的生物标志物[6]。本研究中幽门螺杆菌感染儿童肠道内大肠杆菌属比例升高,提示如儿童慢性幽门螺杆感染迁延不愈,可能未来进展为成人胃癌的风险升高。
不同治疗效果儿童肠道菌群α、β多样性差异无显著性,说明治疗效果对菌群多样性影响不明显。但在根除治疗7 天、14 天时儿童肠道菌群的α 以及β多样性均降低,提示在幽门螺杆菌根除治疗过程中,药物容易破坏肠道菌群,导致物种多样性降低并引起菌群紊乱。应用质子泵抑制剂(proton pump inhibitor,PPI)可导致小肠细菌过度生长发生率升高、菌群失调、艰难梭菌感染等并发症[7-8]。相关研究发现,长期口服PPI治疗过程中,肠球菌属、链球菌属、葡萄球菌属比例增加,梭菌属比例减少,导致小肠细菌过度生长、艰难梭菌感染等疾病[9]。此外,抗生素也可引起菌群紊乱。有研究发现,应用克林霉素后小鼠肠道菌群多样性明显降低,毛螺旋菌属水平下降,肠杆菌属水平升高,同时艰难梭菌感染率升高[10]。本研究纳入的患儿既往无长期PPI使用史,在治疗过程中未出现呕吐、腹泻、腹胀等临床症状,且均未检测出艰难梭菌。但在治疗过程中肠道菌群的多样性与均一性降低,大肠杆菌/志贺菌、链球菌、葡萄球菌等菌属比例升高;而罗斯菌、双歧杆菌、Gemmiger、毛螺菌、瘤胃球菌等产短链脂肪酸的优势菌属丰度降低,这些菌属的丰度降低除引起菌群紊乱外,还可导致肠道短链脂肪酸生成减少,影响肠道物质代谢与免疫调节。
普氏菌可通过激活Toll样受体2促使抗原呈递细胞产生Th 17 极化细胞因子,并可诱导上皮细胞产生IL-8、IL-6和CC亚族趋化因子配体20(CC chemokine ligand 20,CCL20),从而介导黏膜的炎症反应[11]。高新基等[12]研究发现,普氏菌与成人胃贲门腺癌发生率呈正相关。因此普氏菌丰度高的儿童消化道炎症反应更重,更容易出现黏膜损伤,不利于根除治疗。弓形杆菌为革兰阴性致病菌,可产生细胞肠毒素,对胃肠道产生致病性,粪肠球菌、假单胞菌也可定植于消化道产生致病性,这类肠道致病菌的生长可能导致治疗失败。肠道巴恩斯菌属于卟啉单胞菌科,可以调节肠道微生物组成、抑制梭状芽胞杆菌等致病菌的生长[13],但有研究表明,巴恩斯菌与TNF-α水平呈正相关性[14],因此,巴恩斯菌可能通过影响炎性因子水平影响消化道炎症反应的程度,从而影响根除治疗效果。
粪杆菌可通过产生短链脂肪酸、水杨酸等代谢产物发挥抗炎作用[15],丹毒丝菌、部分梭状芽胞杆菌也可产生短链脂肪酸。短链脂肪酸参与肠道物质、能量代谢与免疫调节,可通过阻断NF-κB 等信号通路发挥抗炎作用。此外,梭状芽胞杆菌影响FOXP3+CD4+Treg细胞的数量和功能,诱导结肠Treg细胞分化并表达高水平的IL-10,发挥抗炎作用[16]。另枝菌可减轻炎症反应。相关研究发现,另枝菌减轻葡聚糖硫酸钠盐诱导的小鼠结肠炎程度,发挥肠道保护作用[17]。因此,肠道内粪杆菌、另枝菌、丹毒丝菌、梭状芽胞杆菌可能通过肠道保护作用协助幽门螺杆菌感染儿童初次根治成功。萨特菌是一种耐胆汁微需氧弯曲杆菌,通过对肠道黏液及胞外基质蛋白的黏附,影响TLR4-TRAM-TRIF通路,诱导上皮细胞产生IL-8,促进炎症反应,引起多种胃肠道疾病[18]。普罗维登斯菌属于条件致病菌,可引起腹泻、胃肠炎等消化道疾病,魏斯菌大部分为产乳酸的有益菌,少数如W.viridescens、W.cibaria、W.confusa有致病性,可通过产生细菌素如weissellicin 110 (W.cibaria)、weissellicin D、L、M、Y (W.hellenica) 等引起多种感染性疾病的发生[19],这些肠道致病菌的生长可能引起幽门螺杆菌初治失败。
综上所述,幽门螺杆菌根除治疗影响肠道菌群结构,可能引起小肠细菌过度生长、艰难梭菌感染等并发症,肠道致病性细菌的生长可能影响幽门螺杆菌根除效果,导致根除治疗失败。
