微RNA-129-5p 靶向Fas 相关死亡功能域蛋白基因对体外培养人椎间盘髓核细胞凋亡的影响
2020-06-30高军胜
姜 岩,张 陆,高军胜,张 冲,刘 杰
郑州人民医院骨科,郑州 450000
椎间盘退行性变是导致下腰痛的主要原因之一[1],超过80%的人在其一生中会经历一次或多次下腰痛或肩颈痛,严重影响生活质量[2]。椎间盘由外围的纤维环、中心的髓核和上下终板构成,已有研究证明,椎间盘髓核细胞的异常凋亡是引起髓核细胞数量减少的关键因素,从而引起椎间盘退行性变[3]。Fas 相关死亡功能域蛋白(FADD)是Fas/FasL系统信号转导通路中介导细胞凋亡的胞浆死亡信号蛋白,它可以调节半胱氨酸蛋白酶(Caspase)蛋白表达,诱导细胞的凋亡[4]。
微RNA(miRNA)是一类由19 ~ 25个核苷酸组成的非编码单链小RNA,通过降解靶基因mRNA或阻止其蛋白翻译对靶基因进行调节,研究发现miRNA参与调节椎间盘退行性变的生理病理过程[5]。miRNA-129-5p(miR-129-5p)是近年发现的一种肿瘤抑制miRNA[6-8],陈宇飞[9]的研究发现,发生退行性变的椎间盘髓核组织中miR-129-5p 表达下调,上调其表达对椎间盘有保护作用,且miR-129-5p 可以靶向作用Ⅰ型胶原基因和整合素α1 基因而影响细胞生物学功能。但miR-129-5p 在髓核细胞中是否影响细胞的凋亡及相关机制尚不清楚。本研究通过体外实验探究miR-129-5p 是否通过调控FADD 影响人椎间盘髓核细胞(hNPC)凋亡。
1 材料与方法
1.1 材料和仪器
hNPC 购自美国ScienCell 公司;胎牛血清、DMEM 培养液购自美国HyClone 公司;胰蛋白酶、噻唑蓝(MTT)、二甲基亚砜(DMSO)购自美国Sigma 公司;膜联蛋白V-异硫氰酸荧光素/碘化丙啶(Annexin V-FITC/PI)凋亡检测试剂盒购自美国Coulter公司;聚偏二氟乙烯膜、双荧光素酶报告基因检测试剂盒、电化学发光液购自北京索莱宝科技有限公司;Lipofectamine 2000 转染试剂、miR 阴性对照物(miR-NC)、miR-219-5p 模拟子(miR-219-5p mimics)、抑制子阴性对照物(inhibitor NC)、miR-219-5p 抑 制 子(miR-219-5p inhibitor)、FADD 小 干扰RNA(FADD siRNA)和小干扰RNA 阴性对照物(siRNA NC)购自美国Invitrogen公司;pcDNA-FADD过表达载体由南京金瑞斯生物科技公司构建;兔抗人β-actin多克隆抗体、兔抗人Bcl-2多克隆抗体、兔抗人Bax 多克隆抗体、兔抗人Cleaved Caspase-3多克隆抗体、兔抗人FADD 多克隆抗体购自美国Proteintech Group 公司;辣根过氧化物酶(HRP)标记的二抗购自武汉博海生物工程有限公司;引物由生工生物工程(上海)股份有限公司合成;MCO-18AC型CO2培养箱购自日本SANYO公司;流式细胞仪购自美国BD公司。
1.2 细胞培养
将hNPC 培养于含有10%胎牛血清的DMEM 培养基中,置于37℃、5% CO2培养箱中培养,每隔24 h更换1 次培养液,待细胞贴壁约80%时加入胰蛋白酶进行消化传代。
1.3 细胞转染与分组
收集融合度约40%的hNPC,加入胰蛋白酶消化并重悬,以1×105个/孔的密度接种至24孔板,常规培养24 h。按照LipofectamineTM2000转染试剂使用说明将miR-NC、miR-219-5p mimics、inhibitor NC、miR-219-5p inhibitor、pcDNA、pcDNA-FADD、miR-219-5p inhibitor+siRNA NC、miR-219-5p inhibitor+FADD siRNA 分别转染至hNPC,标记为miR-con 组、miR组、anti-miR-con组、anti-miR组、pcDNA组、pcDNAFADD 组、anti-miR-siRNA-con 组、anti-miR-siRNA组;以未转染的细胞为空白对照,记为Blank 组。
1.4 实时荧光定量聚合酶链反应(PCR)检测miR-219-5p的表达
将转染48 h 的细胞充分研磨,TRIzol 法提取总RNA,检测RNA 纯度和浓度。使用反转录试剂盒(日本TaKaRa 公司)将RNA 反转录成cDNA,按照荧光定量试剂盒(日本TaKaRa 公司)使用说明配制反应体系,以β-actin 为内参,置于实时荧光定量PCR 仪上进行扩增,每个样品重复3 次,采用2-△△Ct法 分 析 实 验 结 果。miR-219-5p 正 向 引 物为5′-GGGTCTTAACGCAAACCT-3′,反 向 引 物 为5′-CAGTGCGTGTCGTGGAGT-3′;β-actin 正 向 引 物为5′-CCTGTGGCATCCACGAAACT-3′,反向引物为5′-GAAGCATTTGCGGTGGACGAT-3′。
1.5 流式细胞术检测细胞凋亡
收集转染48 h的细胞,加入预冷的磷酸盐缓冲液(PBS)洗涤细胞,加入胰蛋白酶消化细胞,调整细胞密度为1×106个/mL,依次加入5 μL Annexin Ⅴ-FITC 和10 μL PI,轻轻混匀,室温避光孵育15 min,上流式细胞仪检测细胞凋亡情况。每组设3 个复孔,实验重复3 次。
1.6 蛋白质印迹法检测凋亡蛋白和FADD的表达
收集转染48 h 的细胞,超声粉碎,加入含蛋白酶抑制剂的RIPA 裂解液于冰上裂解5 min,4℃、12 000×g(1 g=9.806 65 m/s2)离 心15 min,收 集上清。将蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳后转至聚偏二氟乙烯膜,加入5%脱脂奶粉封闭2 h。加入稀释过的一抗,4℃孵育过夜,TBST漂洗3次,加入HRP标记的二抗室温孵育2 h。TBST漂洗3次,每次10 min,ECL试剂盒发光显影。将胶片用Quantity One 凝胶分析软件处理,测定各组蛋白条带的光密度,以目的条带和β-actin 条带光密度的比值作为蛋白表达水平。每组设3 个复孔,实验重复3 次。
1.7 荧光素酶报告基因实验
Targetscan 在线预测发现FADD 3′-UTR 上存在miR-219-5p 的结合位点。为进一步验证FADD 是否为miR-219-5p 的靶基因,按照Lipofectamine 2000 使用说明书,将构建好的野生型FADD 3′-UTR-WT(含FADD 3′-UTR 片 段)和 突 变 型FADD 3′-UTR-MUT(FADD 3′-UTR 片段突变体)载体分别与miR-219-5p mimic 共转染至293T 细胞,培养48 h 后检测荧光素酶活性,以相对荧光强度表示(相对荧光强度=萤火虫荧光强度/海肾荧光强度)。
1.8 统计学处理
采用SPSS 20.0 软件对数据进行统计学分析,数据以表示,组间比较采用独立样本t 检验,多组间比较采用单因素方差分析;以P < 0.05 为差异有统计学意义。
2 结 果
2.1 抑制miR-129-5p表达对hNPC凋亡的影响
实时荧光定量PCR 检测结果显示,anti-miR 组hNPC 中miR-129-5p 的 表 达 量 与anti-miR-con 组 相比明显降低(P < 0.05,图1),表明miR-129-5p 的表达被成功抑制。流式细胞术检测结果显示,与antimiR-con 组相比,anti-miR 组hNPC 的凋亡率明显升高(P < 0.05,图2)。蛋白质印迹分析结果显示,与anti-miR-con 组相比,anti-miR 组hNPC 中促凋亡相关蛋白活化型Caspase-3 表达上调(P < 0.05),抑凋亡相关蛋白Bcl-2 表达下调(P < 0.05),Bax 蛋白表达量无明显变化(图3),结果表明抑制miR-129-5p表达能明显促进hNPC 凋亡。
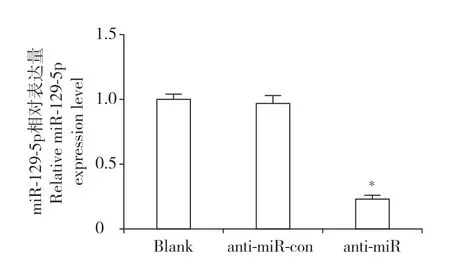
图1 实时荧光定量PCR 检测hNPC 中miR-129-5p的表达Fig. 1 miR-129-5p expression in hNPCs detected by real-time quantitative PCR
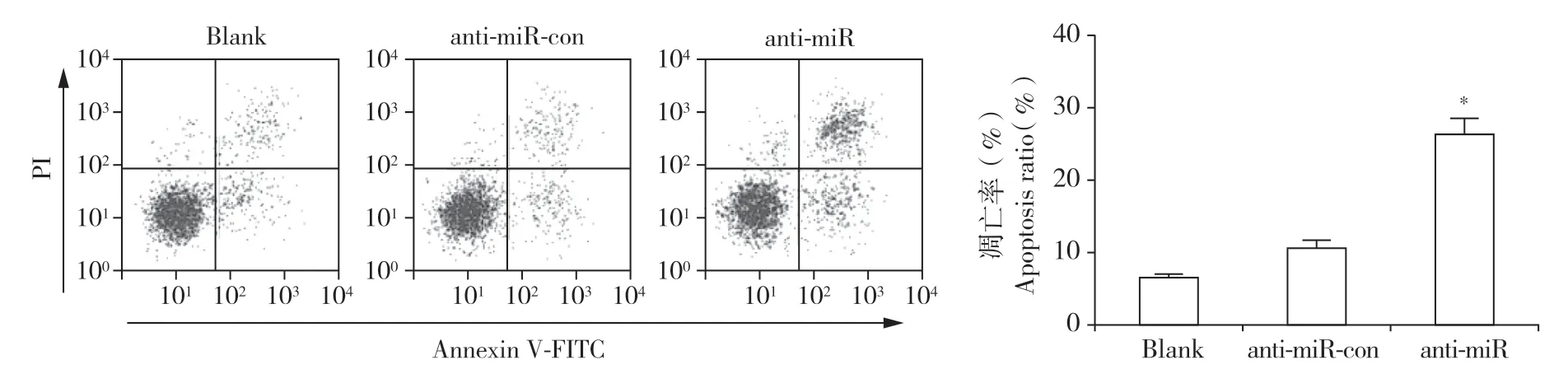
图2 流式细胞术检测抑制miR-129-5p表达后hNPC 的凋亡率Fig. 2 Apoptosis rate of hNPCs after inhibiting miR-129-5p detected by flow cytometry

图3 蛋白质印迹分析检测hNPC 中凋亡蛋白的表达Fig. 3 Expression of apoptotic protein in hNPCs detected by Western blotting
2.2 miR-129-5p靶向FADD影响hNPC凋亡
通过Targetscan在线预测发现,FADD 3′-UTR上存在miR-129-5p的结合位点(图4a);双荧光素酶报告基因实验结果显示,将miR-129-5p mimics与FADD 3′-UTR野生型质粒共转染后细胞荧光素酶活性下降(P < 0.05),与FADD 3′-UTR突变型质粒共转染后细胞荧光素酶活性无明显变化(P > 0.05,图4b);蛋白质印迹分析结果显示,与anti-miR-con 组相比,miR组hNPC 的FADD 表 达 下 调(P < 0.05),anti-miR 组hNPC 的FADD表达上调(P < 0.05,图4c)。
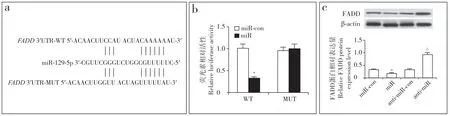
图4 miR-129-5p靶向FADD 的预测和验证结果Fig. 4 Predicting and validation results of miR-129-5p targeting FADDa:FADD 3′-UTR与miR-129-5p 的结合位点 b:双荧光素酶报告实验 c:蛋白质印迹分析a:Binding site of FADD 3′-UTR and mir-129-5p b:Dual-luciferase reporter gene assay c:Western blotting
转 染pcDNA-FADD 至hNPC 后,pcDNA-FADD组hNPC 的FADD 表达量与pcDNA 组相比明显增加(P < 0.05,图5a),细胞凋亡率明显升高(P < 0.05,图5b),表明过表达FADD 可诱导hNPC 凋亡。抑制miR-129-5p 表达后,anti-miR 组hNPC 的FADD 表达量与anti-miR-con 组相比明显增加(P < 0.05,图6a),细胞凋亡率明显升高(P < 0.05,图6b);同时抑制miR-129-5p 和FADD 表达后,anti-miR-siRNA组的FADD 表达量与anti-miR-siRNA-con 组相比明显降低(P < 0.05,图6a),细胞凋亡率也明显降低(P < 0.05,图6b),表明miR-129-5p 抑制后FADD 表达上调促进hNPC 凋亡。
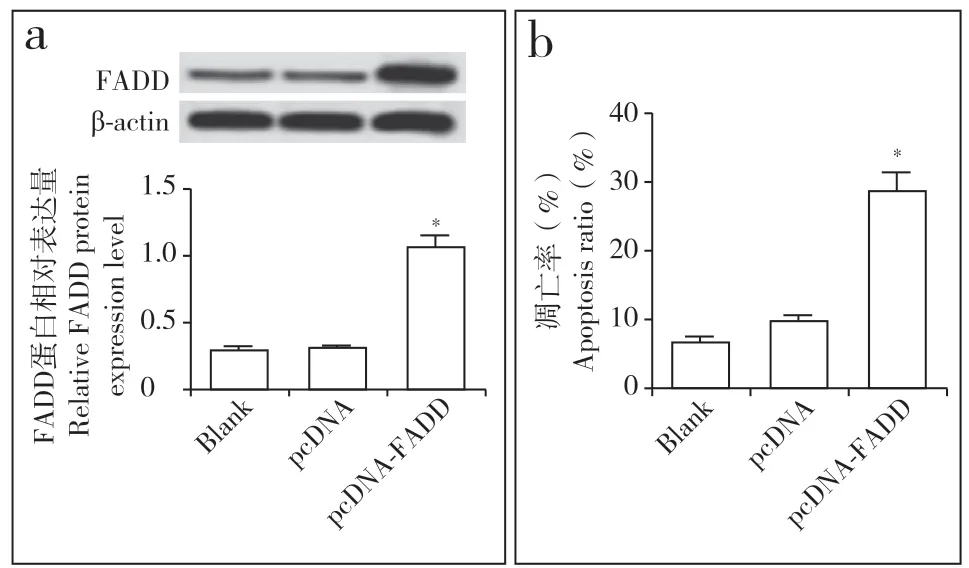
图5 过表达FADD 诱导hNPC凋亡Fig. 5 hNPC apoptosis induced by over-expression of FADD a:蛋白质印迹法检测FADD表达 b:流式细胞术检测hNPC 凋亡a:Detection of FADD expression by Western blotting b:Detection of hNPC apoptosis by flow cytometry
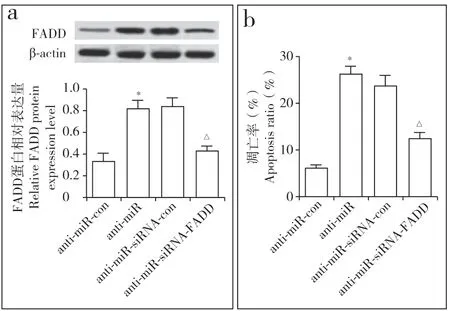
图6 抑制miR-129-5p和FADD 对hNPC 凋亡的影响Fig. 6 Effect of inhibiting miR-129-5p and FADD on hNPC apoptosisa:蛋白质印迹法检测FADD表达 b:流式细胞术检测hNPC 凋亡a:Detection of FADD expression by Western blotting b:Detection of hNPC apoptosis by flow cytometry
3 讨 论
椎间盘退行性疾病引起的慢性腰腿痛、颈肩痛严重影响人们的正常生活[10],目前临床上有多种针对椎间盘退行性疾病的治疗手段,包括药物治疗、物理治疗和手术治疗[11]。椎间盘退行性变是自然老化、退化的生理病理过程,受多种因素影响,是一系列脊柱退行性疾病的前提和病理基础[12-13]。椎间盘组织再生能力有限,发生退行性变后较难逆转[14],患者症状存在反复发作的风险。因此,探索椎间盘退行性变的分子机制对发掘新型治疗手段具有重要意义。
细胞凋亡所造成的椎间盘细胞数量减少、细胞外基质合成减少和成分改变是导致椎间盘退行性变的关键环节[15]。在发生退行性变的椎间盘中可以观察到髓核细胞的凋亡速率明显加快[16]。细胞凋亡的过程中有多种蛋白参与,如Caspase 系列蛋白、Bcl-2 蛋白和p53 蛋白等[17-18]。研究发现,长链非编码RNAGAS5 过表达后Caspase-3 表达上调,凋亡抑制蛋白Bcl-2 表达下调,髓核细胞的凋亡率升高[19]。FADD 基因在组织中表达异常与肿瘤的发生、发展关系密切,在人胶质母细胞瘤细胞中,FADD 过表达可抑制细胞增殖并促进细胞凋亡[20]。FADD 在发生退行性变的hNPC 中高表达,miR-155 通过调控FADD和Caspase-3抑制hNPC凋亡[21]。本研究发现,转染pcDNA-FADD 至hNPC 后,FADD 表达量明显增加,hNPC 的凋亡率也明显增加,表明FADD 过表达可促进hNPC 凋亡。
多种miRNA 可通过作用于细胞凋亡影响椎间盘退行性变的发生和发展。Liu 等[22]的研究发现,体外转染miR-125a 后,髓核细胞凋亡减少,同时Caspase-3、Bax 的蛋白表达量下降,Bcl-2 表达上调。Zhang 等[23]的研究发现,在发生退行性变的椎间盘组织中miR-210 表达降低,导致HOXA9 蛋白表达上调,并通过Fas 通路介导髓核细胞凋亡。Zhao等[24]的研究发现,miR-129-5p 的甲基化通过靶向Beclin-1 在椎间盘退行性变中阻断髓核细胞自噬。陈宇飞[9]的研究发现,miR-129-5p 在发生退行性变的椎间盘髓核组织中低表达,过表达miR-129-5p 可以抑制人椎间盘髓核细胞发生退行性变,对椎间盘起保护作用。本研究发现,在hNPC 中下调miR-219-5p 的表达,hNPC 的凋亡率明显升高,促凋亡蛋白Caspase-3 的表达量明显升高,抑凋亡蛋白Bcl-2的表达量明显下降。通过Targetscan 软件预测发现miR-219-5p 与FADD 有结合位点,荧光素酶报告基因实验证实miR-219-5p与FADD之间存在靶向关系。在hNPC 中,上调miR-219-5p 可抑制FADD 的表达,下调miR-219-5p 可促进FADD 的表达。将miR-219-5p inhibitor 和FADD siRNA 共 转 染 至hNPC 后 发 现与hNPC 凋亡率降低,表明抑制FADD 可逆转miR-219-5p低表达对hNPC凋亡的促进作用,进一步说明miR-219-5p低表达通过上调FADD促进细胞凋亡。
综上所述,抑制miR-219-5p 的表达可促进hNPC 中FADD 表达,hNPC 凋亡率也随之升高,表明miR-219-5p 可靶向作用FADD 调控hNPC 的凋亡,这为椎间盘退行性变的分子治疗提供了新靶点。
