育龄期妇女TORCH-IgM抗体筛查结果分析
2020-06-30黄翠芳曾庆洋王爱兰冼洁能和仕进何思杰
黄翠芳 曾庆洋 王爱兰 冼洁能 和仕进 何思杰
南方医科大学南海医院医学检验科,广东佛山 528244
TORCH 是指由弓形虫(TOX)、风疹病毒(RV)、巨细胞病毒(CMV)、单纯疱疹病毒(HSV)感染而引起的一组疾病,当孕妇感染其中一种或多种病原体后,该病原体可通过胎盘或产道引起胎儿感染,会引起流产、早产或胎儿宫内生长迟缓、畸形、死胎等情况[1]。做好孕产期及孕前的相关筛查工作,有利于尽早发现是否存在被感染的情况。本研究旨在探讨孕妇TORCH 所含项目的血清学指标情况,为孕产妇保健管理提供参考,现报道如下。
1 资料与方法
1.1 一般资料
调查对象为南方医科大学南海医院2015 年1月~2018 年12 月进行孕前筛查和孕期普查的妇女共2425 例。孕前期筛查妇女为168 例,孕期普查的妇女为2257 例,年龄20 ~47 岁。孕期普查的妇女孕周均低于16 周,根据年龄的不同将孕期普查的妇女分为三组:年龄<20 岁的为低龄孕妇组、年龄≥20 岁且<30 岁的为适龄孕妇组、年龄≥30岁的为高龄孕妇组。抽取静脉血3mL,3000r/min,离心15min,2 ~8℃保存不应超过1 周,-20℃不应超过3个月,已稀释的样品可在2 ~8℃保存1 周,标本应避免反复冻融,避免使用高血脂、溶血或黄疸的标本。
1.2 仪器及试剂
采用THERMO 公司提供的MULTI FC 自动酶标仪,TORCH 检测试剂盒由德国维润赛润研发有限公司提供,试剂盒成份包括:微孔条、标准血清、阴性对照血清、酶标记的抗人IgM、浓缩洗液(可稀释至1000mL)、类风湿因子Rf-吸附剂、稀释缓冲液、底物液、终止液。
1.3 方法
1.3.1 方法 利用抗原抗体结合原理,采用酶联免疫(ELISA)方法测定检测TORCH-IgM 抗体,每一项次检测设置空白对照孔1 孔,阴性对照孔1 孔,标准品2 孔,低值质控一孔,并将低值质控设置质控图。
1.3.2 结果判读 根据已测得的标准品OD 平均值与质量控制证书上给出的数据相乘确定临界值范围。当大于临界值上限时,结果为阳性,当小于临界值下限时,结果为阴性,处于临界值上下限之间的标本,重新复查,如果再次落在临界值上下限之间的,发弱阳性结果,并注明建议复查。
1.4 统计学处理
应用SPSS18.0 以及EXCEL 2016 软件进行统计分析,计数资料以率(%)表示,组间阳性率比较采用χ2检验,组间多重比较采用χ2检验,P <0.05为差异有统计学意义。
2 结果
2.1 TORCH IgM 检测结果分析
与其他两种病原体比较,HSVII- IgM 抗体和RV-IgM 抗体阳性检出率较高,阳性率分别为4.70%、4.32%,二者阳性检出率之间差异无统计学意义(P=0.547),CMV-IgM 抗体和TOX-IgM 抗体的阳性检出率较低,阳性检出率分别为0.64%和1.34%,与HSVII-IgM 抗体和RV-IgM 抗体比较,差异有统计学意义(P <0.05),见表1。

表1 TORCH-IgM抗体阳性率比较
2.2 不同年份TROCH-IgM阳性率比较
2015 ~ 2018 年CMV-IgM 和RV- IgM 的阳性率来回波动,但TOX IgM 和HSVII- IgM 的阳性率逐年增加,见图1。
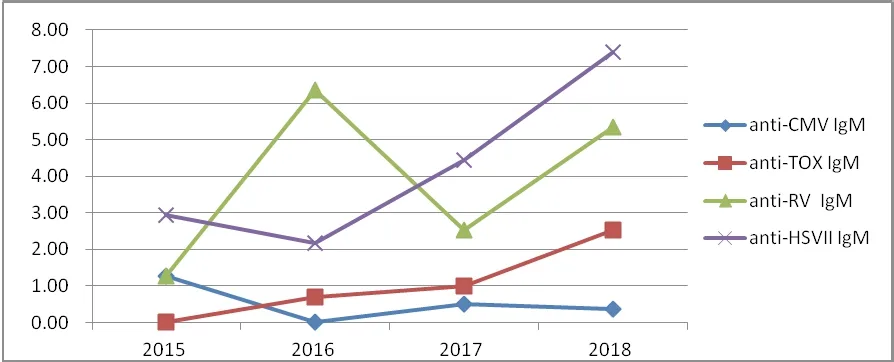
图1 不同年份TROCH-IgM 阳性率比较
2.3 不同年龄组TROCH-Ig阳性率比较
RV-IgM、HSVII- IgM 以 及TOX-IgM 在 低 龄孕妇组的阳性率高于适龄孕妇组及高龄孕妇组,CMV-IgM 抗体在适龄孕妇组高于低龄孕妇组和高龄孕妇组,但各项目检出率在三组年龄组间差异无统计学意义(P >0.05),见表2。
2.4 不同季节TROCH-IgM抗体阳性率比较
TOX-IgM 抗体以秋季感染率较高,但不同季节的阳性检出率比较差异无统计学意义(P >0.05);HSVII- IgM 抗体以春、秋两季感染率较高,但不同季节的阳性检出率比较差异无统计学意义(P >0.05);RV-IgM 抗体在春、夏两季为高发期,并与秋冬季比较差异有统计学意义(P <0.05);CMV-IgM 在秋季的感染率较低,并与其他季节比较差异有统计学意义(P <0.05)。见表3。
3 讨论
TORCH 病毒感染常为隐性感染,对孕妇身体本身影响较小,但是病原体可通过胎盘或产道引起胎儿感染,导致胎儿畸形、早产、黄疸、肝脾肿大、永久性智力低下等疾病,甚至导致胎儿死亡[2]。2011年第1 版的《孕前和孕期保健指南》将TORCH 筛查列为孕前3 个月首选备查项目[3]。目前,国内关于TORCH 感染率的研究结果差异较大,在出现异常妊娠结局的TORCH 阳性病例中,TORCH 感染率会因为地域、卫生环境、人群、生活习惯等因素影响和检测手段的不同而有所差异[4-5],因此对本地区的TORCH 感染情况及其流行特点进行研究将有助于对本地区预防免疫和产前筛查提供指导。

表2 不同年龄组TROCH-IgM抗体阳性率比较[%(n/n)]

表3 不同季节TROCH-IgM抗体阳性率比较[%(n/N)]
本研究结果显示,HSVII-IgM 和CMV-IgM 抗体阳性率分别为4.70%、0.64%,与何天文[6]2016 年报道的广东地区HSVII-IgM、CMV-IgM 阳性率(4.2%、0.68%)相符,RV-IgM 和TOX-IgM 抗体阳性率分别为4.32%、1.34%,明显高于与文献[6-7]报道的广东以及广州地区的研究结果(1.57%、0.17%;1.24%、0.68%),也高于北京等[8-9]地区。人类是HSV 病毒唯一的自然宿主,在人体活细胞内寄宿,以直接接触传染为主,有生殖器疱疹母亲经产道分娩时感染新生儿,从而导致胎儿的一系列中枢神经系统损害[10]。感染HSV 后的新生儿可能会引起广泛的内脏或中枢神经系统感染,有较高死亡率[11]。2015 ~2018 年期间,HSVII- IgM 的阳性率逐年增加,具体原因有待进一步的调查研究,但应加强宣教,孕前或孕期积极筛查。弓形虫生活史属于循环传播型,它的中间宿主为人、猪、羊等,终宿主为猫科动物,本地区TOX-IgM 抗体阳性率相对较高,而且从2015 ~ 2018 年,TOX-IgM 抗体阳性率逐年增加,政府应加强良好卫生习惯的宣传,提高本地区人群,尤其适龄孕妇和产妇对弓形虫病的认识,从而降低TOX 感染率[12]。孕妇感染风疹病毒后,引起胎儿多系统多组织的畸形,约20%的患儿在出生后1 年内死亡,且发展中国家的死亡率较发达国家高[8]。本地区RV-IgM 阳性率明显高于其他地区,因此,对育龄期妇女孕前进行严格的风疹病毒IgM和IgG 抗体筛查,对IgG 抗体阴性者积极注射风疹疫苗是十分必要的[13-14]。
将入选人群分为低龄孕妇组、适龄孕妇组和高龄孕妇组,RV-IgM、HSVII- IgM 以及TOX-IgM 在低龄孕妇组的阳性检出率都高于适龄孕妇组及高龄孕妇组,CMV-IgM 抗体适龄孕妇组高于低龄孕妇组和高龄孕妇组,但各项目检出率在三组年龄组间差异无统计学意义(P >0.05) 。RV-IgM、HSVII- IgM 以及TOX-IgM 在低龄孕妇组的阳性检出率都高于适龄孕妇组及高龄孕妇组,TOX 和RV 感染人体与生活习惯有很大的关系。HSVII 主要的传播途径是性接触,对低龄孕妇应该加强性卫生教育。
不同季节TORCH-IgM 阳性率筛查统计显示,在秋季巨细胞感染率较低,并与其他三个季节相比差异有统计学意义(P <0.05)。在春、夏两季为风疹感染高发期,并与秋冬季比较差异有统计学意义(P <0.05),因此,可建议育龄妇女春夏季受孕时应加强卫生宣传,而对于RV-IgG 阴性的育龄妇女需要进行接种疫苗预防。秋季弓形虫感染率较高,但不同季节的阳性检出率比较差异无统计学意义(P >0.05);春、秋两季HSV 感染率较高,但不同季节的阳性检出率比较差异无统计学意义(P >0.05);可见本地区弓形虫、单纯疱疹病毒感染无明显的季节性差异。
孕妇感染TORCH 病原体受地域、卫生环境、人群、生活习惯等因素影响,其感染率有所差异[15],降低TORCH 病原体感染,应该以预防为主[16]。TORCH 感染的预防应做到以下几点:(1)首先,疾病控制等相关部门应根据当地的TORCH 感染率以及危险因素,对育龄妇女的备孕期和孕期的TORCH 感染防护知识进行宣传教育[17];其次,应加强孕妇孕期的个人卫生及防护,如备孕期和孕期妇女应尽量避免与已感染TORCH 的患者近距离接触,应及时并定期按规定给家养宠物注射疫苗,注意宠物的卫生,尽量减少与宠物的亲密接触,对二次加工的食物要煮熟煮透,切忌进食生肉等[18]。(2)医院应加强TORCH 相关抗体检测意义的宣传,积极做好备孕期妇女以及孕期妇女的TORCH 血清学筛查以便及早发现TORCH 感染,及时采取控制措施[19]:对已感染病原体的适龄妇女建议积极治疗后才怀孕;对风疹IgG 阴性者及时注射风疹疫苗以获得免疫力预防风疹病毒的感染;对已感染的产妇在分娩时应采取剖腹产方式。(3)对高危的新生儿进行TORCH 血清学检测,了解新生儿TORCH 的感染情况[20],对新生儿TORCH 感染的做到早发现、早干预、早治疗,保护新生儿健康,从而提高人口出生质量和促进全民健康,以达到优生的目的。
