秸秆还田条件下腐熟剂对不同质地土壤真菌多样性的影响*
2020-06-30萨如拉杨恒山邰继承高聚林李媛媛
萨如拉,杨恒山,邰继承,高聚林,李媛媛
(1.内蒙古民族大学农学院/内蒙古自治区饲用作物工程技术研究中心 通辽 028042;2.内蒙古农业大学 呼和浩特 010018)
土壤微生物对土壤有机质的变化十分敏感,能对土壤生态机制变化和环境胁迫做出反应。土壤微生物群落的组成和结构变化情况是评价土壤健康程度或者土壤质量的早期重要指标[1]。还田秸秆是土壤有机质的重要来源之一[2];其腐解依靠土壤微生物完成,第1 阶段主要利用秸秆中可溶性物质的增长,以细菌作用为主,开始积累腐殖质。这个过程首先是在喜糖霉菌、白霉菌和无芽孢细菌的作用下,分解水溶性糖和淀粉,之后以芽孢细菌和纤维素分解细菌为主,分解蛋白质、果胶类物质和纤维素等。第2 阶段是腐殖质大量累积阶段,以真菌降解木质素作用为主。第3 阶段是分解腐殖质,以放线菌作用为主[3]。玉米(Zea mays)秸秆腐解过程中土壤微生物的优势种群主要利用糖类和多聚物,在腐解中后期难分解物质逐渐累积,其中微生物对芳香化合物的利用最弱[4]。真菌是降解木质纤维素的优势菌群[5],真菌降解玉米秸秆效率和速率一般远大于细菌。水稻(Oryza sativa)秸秆还田90 d 和180 d,秸秆还田与秸秆不还田土壤的真菌群落结构较为类似,而270 d和360 d 的秸秆还田显著增加了土壤真菌群体数量和多样性指数[6]。喻曼等[7]研究表明,还田作物秸秆腐解前期,革兰氏阴性菌的生物量与半纤维素、纤维素的降解有一定相关性;后期的微生物种群则以木质素分解微生物为主。秸秆还田能提高土壤真菌群落多样性,秸秆还田后土壤真菌优势种群为子囊菌、接合菌和担子菌[8]。但在Banerjee 等[9]的研究中土壤中秸秆和营养物质的添加减少了微生物多样性,真菌中发现毛壳菌、头孢菌膜和镰刀菌为主要分类群。可见不同背景土壤真菌群落结构存在差异。
土壤特性是影响真菌种群的重要因素之一[10],翻压在土壤中的秸秆,在中壤土、重壤土中腐解较快,而在轻壤土中较慢[11]。秸秆在土壤中腐解速率粉沙质低于砂质土[12]。也有研究[13]发现土壤类型(壤土和沙土)对易分解的三叶草(Trifolium repens)的矿化速率没有显著影响,但对于难腐解的小麦(Triticum aestivuml)和黑麦(Secale cereale)的秸秆矿化速率,壤土要明显高于沙土。还田作物秸秆腐解残留率与土壤微生物群落的优势度呈显著负相关[5,14-15];微生物群落在一定程度上影响了秸秆分解的速率[5];优势菌群的相对丰度是影响秸秆性质变化的主要原因[16]。刘增亮等[17]研究赤红壤、红壤和砖红壤下甘蔗(Saccharum officinarum)根系丛枝菌根(AM)真菌多样性,发现3 种不同土壤类型下AM 真菌各属频度存在明显差异。前人对土壤真菌的研究主要集中在不同农艺措施、不同植被、不同时期农田土壤真菌多样性和土壤AM 真菌方面。目前,关于不同质地农田秸秆还田对土壤真菌多样性的影响研究并不完善。
西辽河平原灌区低温持续时间较长,秸秆腐解较慢;虽然秸秆腐熟剂的应用被认为是加速还田秸秆腐解常用的方法,但在半干旱气候井灌条件下秸秆还田配施腐熟剂对土壤真菌群落结构的影响研究很少。研究不同质地土壤真菌的群落结构变化,可为揭示土壤真菌对秸秆还田配施腐熟剂引起的微生境变化的适应与演变趋势,维持土壤生态系统功能的稳定提供理论基础。本研究采用高通量测序法系统比较不同质地土壤秸秆还田配施腐熟剂对土壤真菌群落的影响,解释土壤真菌群落对不同土壤质地和秸秆腐熟剂的响应差异,进而为鉴选适宜的秸秆腐熟剂提供理论依据。
1 材料与方法
1.1 研究区概况
试验于2018年在内蒙古自治区西辽河平原开鲁县蔡家堡(43°36′N,122°22′E,海拔178 m)进行。中壤土和砂壤土为当地主要土壤类型,试验田为多年连作玉米田,2 种质地土壤试验田相距约10 km。 试验区年均气温6.8℃,≥10℃活动积温3 200℃,年均降水量385 mm,生长季内(5—9月份)降水量约为315 mm。试验田具有井灌条件,能保证玉米生长发育的水分需求。
1.2 试验设计与方法
试验采用两因素裂区设计,两因素分别为土壤类型和添加腐熟剂。土壤类型为中壤土(ZR)和砂壤土(SR);添加腐熟剂处理有4 种,分别为中农绿康腐熟剂(中农)、人元秸秆腐熟剂(人元)、农富康腐熟剂(农富康)和不施腐熟剂(对照)。各处理均全量还田玉米秸秆(折干物质约6 750 kg·hm-2)。以小区田间试验方式进行,小区面积60 m2,8 个处理、3 次重复。播前土壤养分状况如表1所示,2 种质地土壤试验田气候类型一致。
中农绿康腐熟剂(中农绿康生物技术有限公司)含纤维素分解菌、益生菌、芽孢杆菌、绿色木霉和酵母菌等高效菌株,有效活菌数≥8.0×107cfu·g-1;人元秸秆腐熟剂(鹤壁市人元生物技术发展有限公司)含细菌、放线菌、丝状菌、酵母菌等多种菌株,有效活菌数≥8.0×107cfu·g-1;农富康秆腐熟剂(河南农富康生物科技有限责任公司)含放线菌、乳酸菌、芽孢杆菌、土著菌、光合细菌、酵母菌、硝化细菌、枯草芽孢杆菌等,有效活菌数≥5.0×108cfu·g-1。
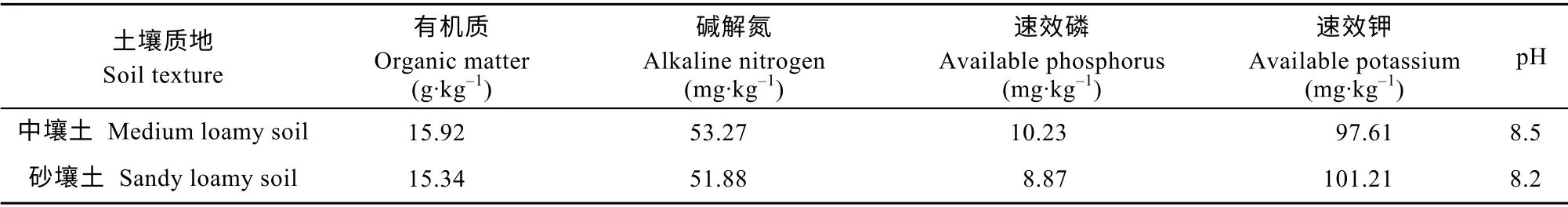
表1 试验地耕层土壤养分含量Table1 Nutrients contents of tillage layer of the test soil
2017年10月上旬实施玉米秸秆还田。还田时先将秸秆机械粉碎,粉碎长度2~3 cm,均匀撒于田面。中农绿康和人元秸秆腐熟剂用量均为30 kg·hm-2,腐熟剂先与锯末按1∶5 拌匀,再均匀撒施于秸秆表面。农富康秸秆腐熟剂使用前需先激活、将菌种做成菌液,具体做法是100 g 秸秆腐熟剂+1 kg 红糖+10 kg 水,密封发酵3~7 d;取菌液45 kg·hm-2均匀喷洒在秸秆表面。各处理均撒施尿素150 kg·hm-2于秸秆的表面,然后机械深翻将秸秆和腐熟剂扣入土壤,翻压深度约40 cm。
2018年5月1日播种,10月1日收获。玉米品种为‘信玉168’,栽培管理同大田生产。
1.3 样品采集、测定项目及其方法
在玉米吐丝期,采用“S”形15 点取样法,采集0~15 cm、15~30 cm、30~45 cm 3 个土层的土壤样品,各处理样品分组和编号如表2所示。每一土样取样量约100 g,装入已灭菌的自封袋中置冰盒带入实验室进行土壤总DNA 提取。
土壤总DNA 用改良的SDS(十二烷基磺酸钠,sodium dodecyl sulfate)高盐缓冲液抽提法[18]提取,用0.8%琼脂糖凝胶电泳检测其是否完整;对真菌ITS1 区进行测序,对原始数据进行拼接,将拼接得到的序列进行质量过滤,并去除嵌合体,得到高质量的Tags 序列。
1.4 数据处理
在相似性97%的水平上对Tags 序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005%作为阈值过滤 OTU,进行组间差异显著性(LEfSe)分析,alpha 指数、Beta 多样性分析[19]。
表2 不同质地土壤秸秆还田配施腐熟剂土壤样品编号Table2 Number of soil samples of different soils with different straw decomposing agents
2 结果与分析
2.1 不同质地土壤秸秆还田配施腐熟剂对真菌OTU 数的影响
24 个样品共得到3 042 个OTUs,对各样品进行OTU 数量韦恩图统计(图1),a、b、c、d、e、f、g和h 相同OTUs 共483 个;其中c 组特有OTU 数最多,g、f 和d 组特有OTU 数较少。砂壤土秸秆还田配施腐熟剂处理特有OTU 数均比对照的多,中壤土则相反。砂壤土配施腐熟剂后减少0~30 cm 土层真菌特有OTU 数,尤其是SR111、SR311 和SR112;中壤土配施腐熟剂后减少0~15 cm 土层真菌特有OTU数,ZR211 和ZR311 明显;配施腐熟剂改变了各土层真菌分布。
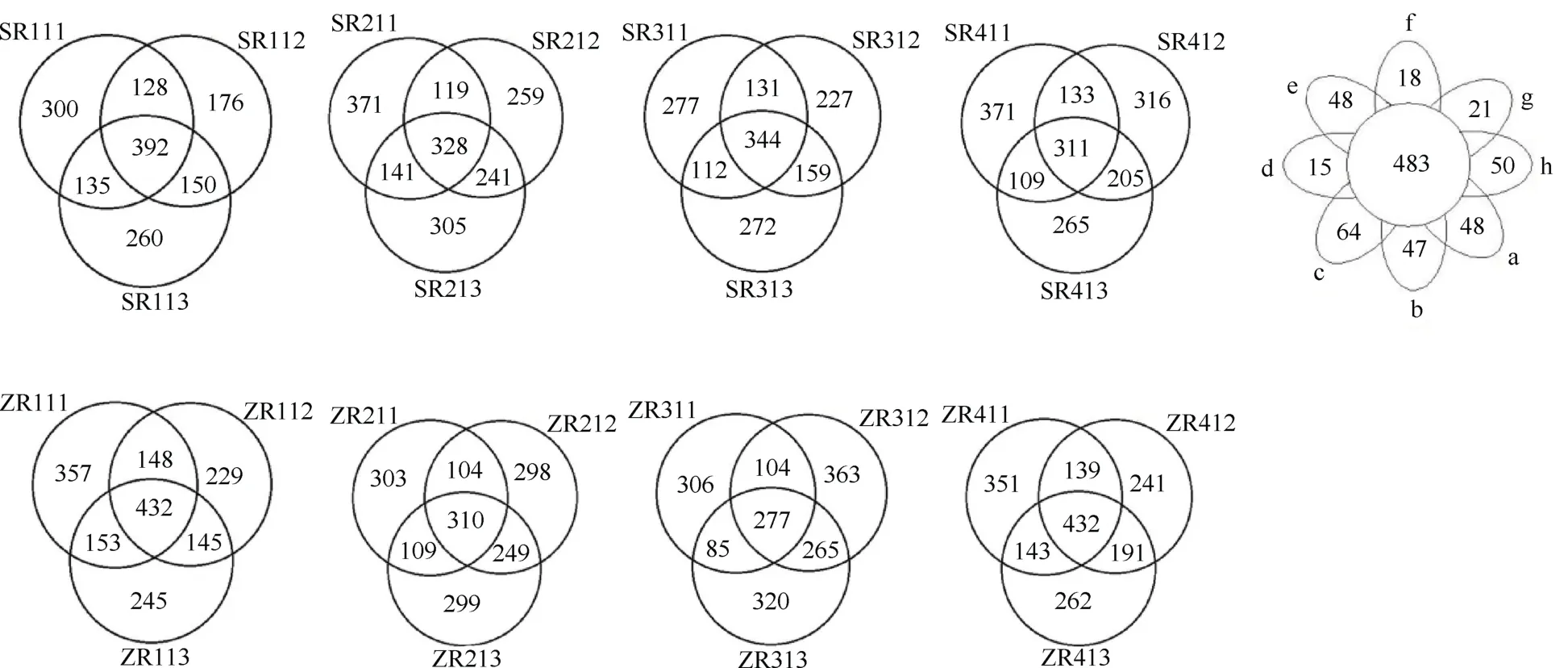
图1 不同组土壤样品中独有和共有真菌OTU 数量的韦恩图Fig.1 Venn diagrams showing the number of shared and exclusive fungal OTU in different groups of the tested soil samples
从表3可知,各处理样品0~15 cm 土壤真菌界、门、纲、目、科、属和种数均比15~30 cm、30~45 cm的多。砂壤土0~15 cm 中,3 种腐熟剂处理门、纲、目、科数均多于对照;15~30 cm和30~45 cm土层中,3种腐熟剂处理科数多于对照;中农处理表层土属和种数多于对照,而人元和农富康处理表层土的属和种数少于对照;15~30 cm 中,中农和人元的属种数多于对照,但农富康的仍少于对照;30~45 cm 中3 种腐熟剂处理属种数均多于对照。中壤土0~15 cm 中,中农处理目、科、属数均多于对照;而其他2 种腐熟剂处理的目、科、属、种数均少于对照;15~30 cm 和30~45 cm 土层中,配施腐熟剂处理科、属、种数均少于对照。
2.2 不同质地土壤秸秆还田配施腐熟剂土壤真菌分布
由图2可知,各组样品优势菌属主要分布在被孢霉门(Mortierellomycota)、子囊菌门(Ascomycota)、担子菌门 (Basidiomycota)、球囊菌门(Glomeromycota)、丝足虫类(Cercozoa)、壶菌门(Chytridiomycota)、Aphelidiomycota、轮虫(Rotifera)、浮霉菌门(Blastocladiomycota),其中被孢霉门、子囊菌门和担子菌门相对丰度较高。a 组、b 组和f 组中真菌相对丰度为子囊菌门>被孢霉门>担子菌门,而c、g、d、h 和e 组中为被孢霉门>子囊菌门>担子菌门。各组样品优势菌属有被孢霉属(Mortierella)、低温酵母属 (Guehomyces)、Tetracladium、Leptosphaeria(引起油菜黑胫病菌)、枝孢菌属(Cladosporium)、Microdochium(引起草坪病害雪霉叶枯病)、链格孢菌(Alternaria)、球囊霉属(Glomus)、锥盖伞属(Conocybe)。优势种有长被孢霉(Mortierella elongata)、Mortierella alpina、耐冷酵母(Guehomyces pullulans)、透明被孢霉(Mortierella hyalina)、Mortierella fimbricystis、Leptosphaeria sclerotioides(低温真菌)、皱枝孢(Cladosporium delicatulum)、Mortierella antarctica、Mortierella gamsii。长被孢霉在a、c、d、h 中相对丰度较大,b、f 中较低;Mortierella alpina在d、g、h 中相对丰度较大,b、f、e、c 中较低,a 中最低;耐冷酵母在a、e、c、g 中相对丰度较大,其中a 的最大,b、f、d、h 中较低。
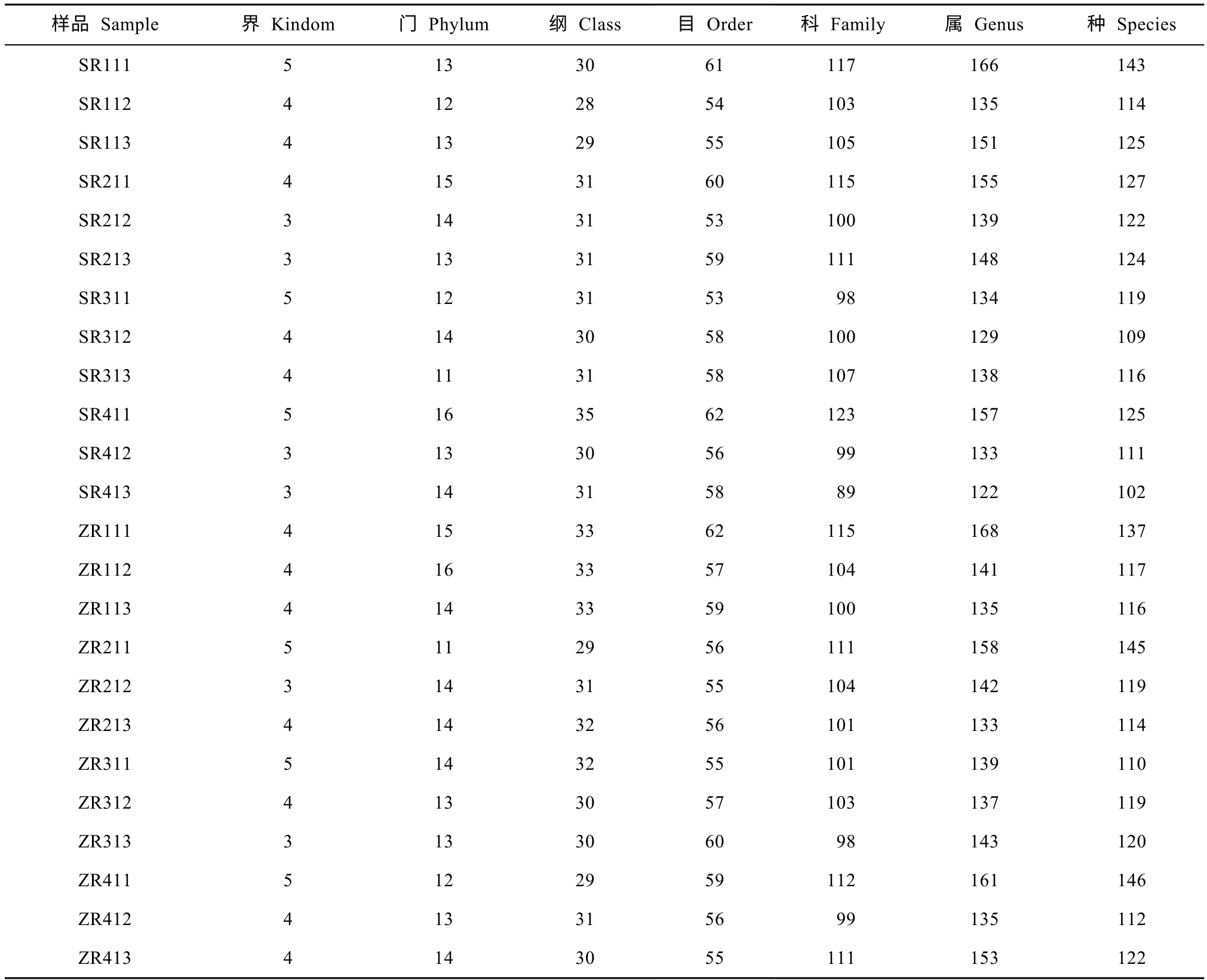
表3 不同组试验样品各等级OTU 物种统计结果Table3 Statistical results of OTU at different levels in different groups of the tested soil samples
同组内样品真菌相对丰度存在差异,由图3可知,各样品优势属均为被孢霉属和低温酵母;除了ZR211 外,中壤土样品真菌第1 优势属均为被孢霉属,其次是低温酵母;ZR211 枝孢菌属相对丰度比低温酵母大;SR112、SR113、SR312、ZR311 中被孢霉属和低温酵母相对丰度相当,均为优势属;SR311 中以上2 个菌属相对丰度相当,均为优势属。
从图3可知,砂壤土真菌相对丰度随着土层下移变化规律为:配施中农和人元处理土壤真菌被孢霉属相对丰度逐渐下降,低温酵母相对丰度增加;配施农富康处理被孢霉属相对丰度增加,低温酵母先增加后下降;对照被孢霉属相对丰度先增加后下降,而低温酵母下降。中壤土真菌相对丰度随着土层下移变化规律为:配施中农处理被孢霉属相对丰度逐渐增加,而低温酵母先下降后增加;人元处理被孢霉属相对丰度先增加后下降,而低温酵母增加;农富康处理被孢霉属相对丰度逐渐增加,而低温酵母降低;对照被孢霉属相对丰度先下降后增加,而低温酵母下降。随土层的下移,砂壤土和中壤土秸秆还田不施腐熟剂处理被孢霉属相对丰度先增加后下降,低温酵母相对丰度下降;配施腐熟剂后(除g 组),15~30 cm 和30~45 cm 土层低温酵母相对丰度大于0~15 cm。
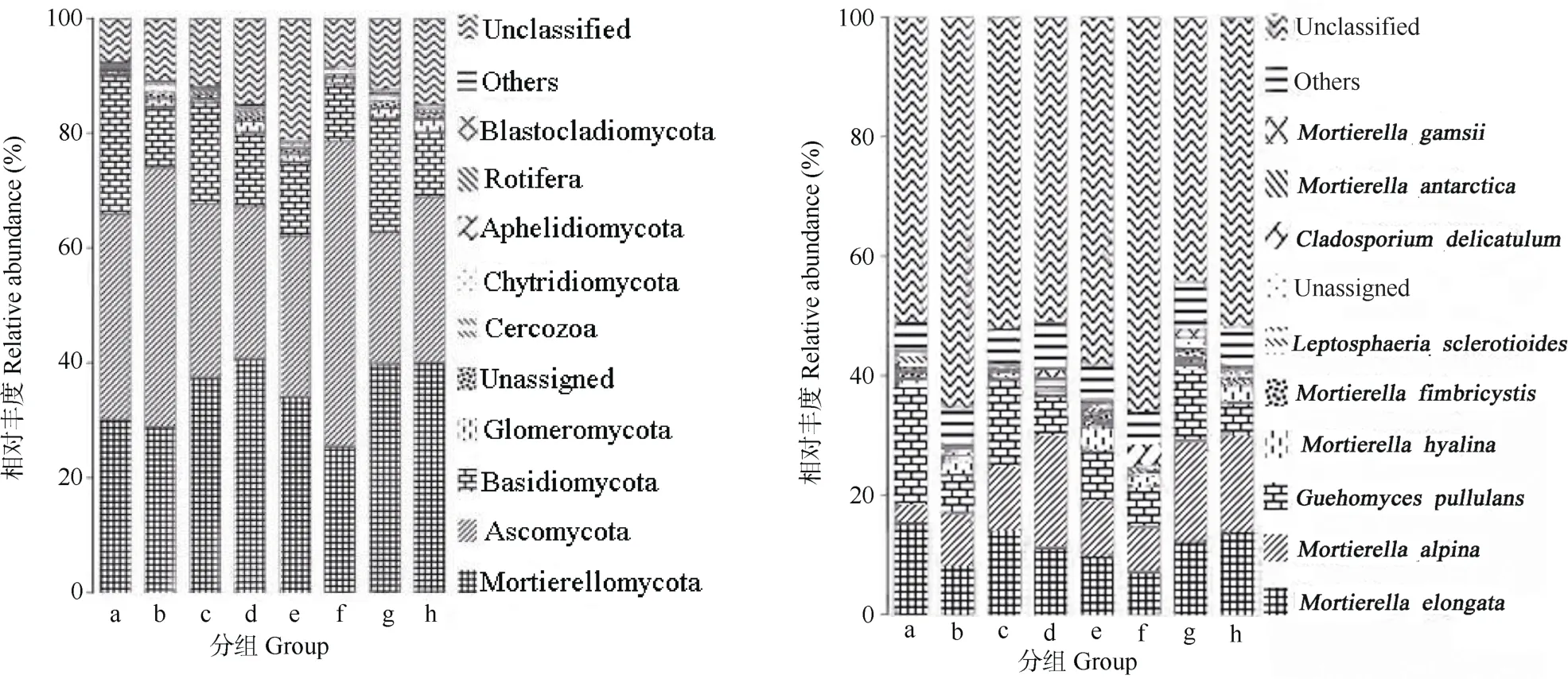
图2 不同组试验样品真菌门、种水平分类学组成和分布Fig.2 Taxonomic composition and distribution of soil fungi on the phylum and species levels in different groups of the tested soil

图3 不同组试验样品真菌属聚类树及相对丰度Fig.3 Horizontal clustering tree and relative abundance of fungi genus the tested soil samples
不同质地土壤真菌相对丰度存在差异,被孢霉属和低温酵母相对丰度均为SR111>ZR111;被孢霉属相对丰度为ZR112>SR112,并且ZR112 中新增加了Cladosporium和球囊霉属,而SR112 低温酵母相对丰度比ZR112 高3.5 倍;被孢霉属相对丰度ZR113> SR113,ZR113 中新增加低温酵母和球囊霉属。被孢霉属相对丰度SR211>ZR211,低温酵母相对丰度则相反,ZR211 中链格孢属(Alternaria)与低温酵母的相当;被孢霉属相对丰度ZR212>SR212,低温酵母相对丰度则相反;被孢霉属相对丰度ZR213>SR213,其余无差异;被孢霉属、低温酵母、Cladosporium相对丰度均ZR311>SR311,被孢霉属、球囊霉属相对丰度均为ZR312>SR312,而低温酵母相对丰度则相反;被孢霉属、低温酵母相对丰度为 SR313>ZR313;Leptosphaeria、Tetracladium、锥盖伞属相对丰度ZR411>SR411,低温酵母相对丰度 ZR412>SR412,而被孢霉属则相反,Cladosporium和锥盖伞属在ZR412 中未出现;ZR413、SR413 被孢霉属、低温酵母相对丰度无差异,锥盖伞属在ZR413 中未出现。
2.3 不同质地土壤秸秆还田处理间有差异的物种分析
从图4横向聚类结果看,担子菌亚门(Basidiomycota)、Aphelidiomycota、新美鞭菌(Neocallimastigomycota)、子囊菌门、毛霉亚门(Mucoromycota)距离较近,枝长较短;芽枝霉门(Blastocladiomycota)、丝足虫类、单毛壶菌、Rotifera、被孢霉门、梳霉门(Kickxellomycota)距离较近,枝长较短;壶菌门、黄藻门(Anthophyta)、油壶菌门(Olpidiomycota)、Streptophycophyta、球囊菌门、隐真菌门(Rozellomycota)距离较近,枝长较短;说明这些菌群在各样品中组成较相似。
纵向聚类结果看,SR411、SR412、SR413、ZR412、ZR413、ZR312、ZR313、ZR111、ZR113距离较近,枝长较短,归为一类;SR212、SR213、ZR211、ZR212、ZR213 距离较近,枝长较短,归类一类;SR111、SR112、SR113、SR311、SR312、SR313、ZR112、ZR311、ZR411 距离较近,枝长较短,归为一类;说明这些样品真菌组成及丰度较相似。
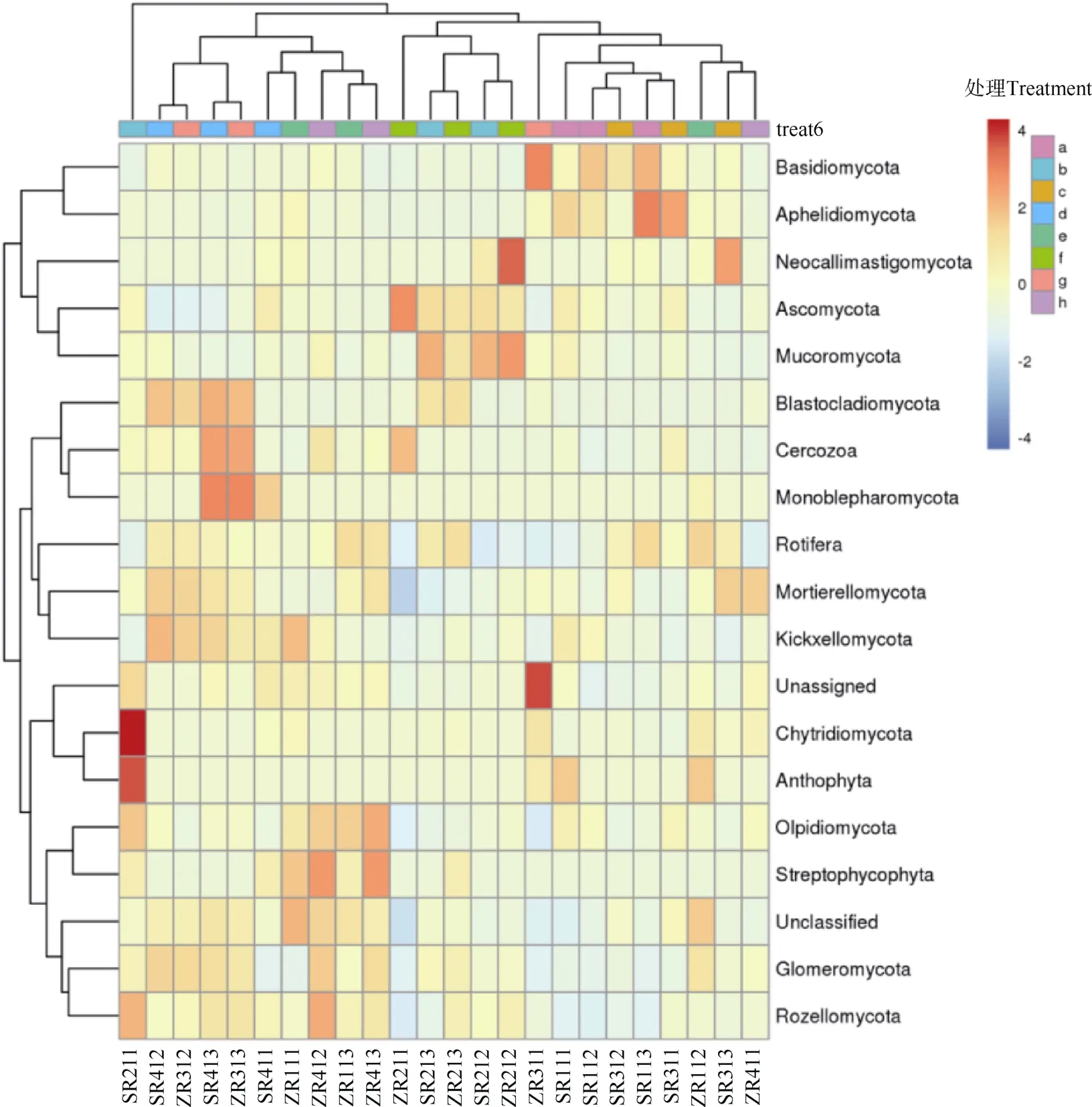
图4 不同试验样品真菌差异物种相对丰度热图Fig.4 Relative abundance heat map of fungi of the tested soil samples
由图5可知,b、e、f 和h 组间距离较近,相似性高,而a 与d,g 与e、f、h,c 与其他组间距离较远,相似性低,差异程度大。可知,两种质地土壤秸秆还田配施农富康腐熟剂处理与其他处理真菌差异较大。
根据8 组样品LEf Se(LDA Effect Size)分析,筛选出LDA 值大于4 的物种,发现a、f、g 组间真菌多样性存在差异,发挥显著性作用的菌种分别具有1、2 和 3 个分类(图6)。这些分类群主要来自Basidiomycota、Pleosporales、Ascomycota、Agaricales、Mortierella fimbricystis和Agaricomycetes。各组差异效果影响较大的物种不同,a 组中Basidiomycota物种,f组中Ascomycota和Pleosporales物种,g 组中Agaricomycetes、Mortierella fimbricystis、Agaricales物种丰度对差异效果影响较大;即各组中它们是起到重要作用的微生物类群。
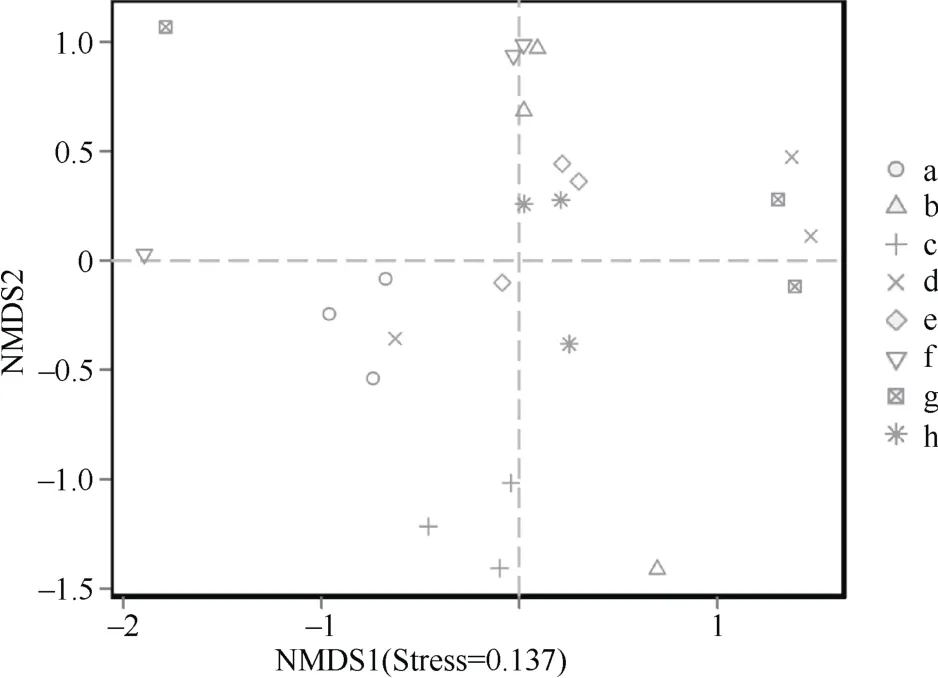
图5 不同组试验样品真菌非度量多维尺度分析Fig.5 Nonmetric multidimensional scale analysis of soil fungi in different groups of the tested soil samples
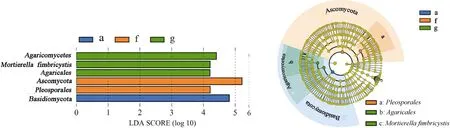
图6 不同组试验样品真菌LDA 值分布和系统发育树(LDA 阈值4.0)Fig.6 LDA value distribution and cladogram of soil fungi in different groups of the tested soil samples (LAD score=4.0)
3 讨论与结论
土壤类型是影响真菌种群的重要因素之一,对AM 真菌孢子密度、物种丰富度、Shannon 多样性指数和侵染率均有显著影响[20]。黑垆土、灌淤土、黄绵土、灰钙土、风沙土等土壤类型中,AM 真菌均以球囊霉属为优势属[21]。干旱区农田不同作物根际土壤中,子囊菌门为最优势菌门,次优势菌门是担子菌门[1]。真菌群落首先受到团聚体大小组分的影响,其多样性与土壤碳氮比的变化有关;东北地区35年施有机肥和施化肥的农田不同粒级(2 000~250 μm,250~53 μm,<53 μm)的真菌群落组成均表现为子囊菌群落较多,接合菌群较少,碳含量较高[22]。秸秆还田后土壤真菌的优势菌群为子囊菌、接合菌和担子菌[8];小麦成熟期的褐土中真菌主要包含子囊菌门、担子菌门、壶菌门和球囊菌门[23];从C13纤维素中吸收C13的真菌类群大部分是未培养的,C13标记的真菌大部分属于子囊菌门、担子菌门和粘菌门(Myxomycophyta)[24]。本研究中各样品优势真菌为被孢霉门、子囊菌门和担子菌门;优势属均为被孢霉属和低温酵母。可见,土壤中真菌以子囊菌门和担子菌门占优势,并存在各异的真菌优势类群。这可能是不同土壤类型下,驱动真菌群落演变的土壤因子不同[25],土壤团聚体大小组分不同,养分含量不同,从而土壤中分解者群落组成不同;不同类型土壤中资源可利用性可能发生了较大变化,提高了微生物演替速度。
秸秆还田配施不同腐熟剂与土壤质地会产生不同响应。砂壤土秸秆还田配施中农绿康秸秆腐熟剂、中壤土秸秆还田配施人元秸秆腐熟剂和中壤土秸秆还田配施农富康腐熟剂等3 个处理的土壤真菌多样性存在差异。通过 LEfSe 分析可知,分别有Basidiomycota,Ascomycota、Pleosporales,Agaricomycetes、Mortierella fimbricystis和Agaricales起到了重要作用;可能原因是砂壤和中壤土的土壤团聚体大小组分不同,秸秆腐熟剂的成分不同,从而促进功能菌种的定植与功效提升程度不同;秸秆和腐熟剂显著地改变了微生物的丰度、组成和共生情况。这种响应差异也体现在同一腐熟剂对中壤土和砂壤土的不同土层真菌的影响。秸秆还田后土壤有利于真菌和细菌细胞壁成分的积累,尤其是在0~5 cm 的土层,并且真菌优先富集,使表层土壤组分中碳积累增加,有利于真菌群落的生长,从而改善土壤聚集性。在排水良好的免耕砂质黏壤土0~5 cm 的土层中大团聚体较多,菌丝体密度比旋耕的相同土层高1.30~1.46 倍,且前者的真菌菌丝体数量较高。秸秆的添加虽然减少了真菌的多样性,但对真菌的优势类群有利,从而增加了真菌的生物量[9]。土壤中真菌生物量的增加有利于土壤团聚体的稳定[26]。本研究中,秸秆还田并配施中农绿康腐熟剂的0~15 cm 土层中的被孢霉属、低温酵母的相对丰度砂壤土中大于中壤土;15~30 cm 土层砂壤土低温酵母相对丰度是中壤土的3.5 倍,而中壤土Tetracladium相对丰度是砂壤土的3 倍,并新增加了Cladosporium和球囊霉属;30~45 cm 中壤土Leptosphaeria的相对丰度是砂壤土的4 倍,并新增加低温酵母和球囊霉属,而锥盖伞属相对丰度比砂壤土的低3 倍。砂壤土和中壤土秸秆还田配施人元腐熟剂的真菌相对丰度存在差异,中壤土0~15 cm 土层低温酵母相对丰度大于砂壤土,15~30 cm、30~45 cm 土层被孢霉属相对丰度大于砂壤土。说明秸秆还田配施腐熟剂后改变了被孢霉属、低温酵母和球囊霉属0~45 cm 土层中的丰度。这可能是不同土层中土壤团聚体大小组分、还田秸秆的腐熟程度不同,导致不同土层中有机添加物质量的差异,从而土壤真菌组成受到了影响[27],改变了土壤优势真菌的分布。被孢霉属真菌对黑麦草(Lolium perenne)的种子萌发与生长表现出明显的促进作用[28]。长期施有机肥条件下,玉米根内被孢霉属真菌的相对丰度由5%上升到45%,成为砂姜黑土真菌群落中的主导性菌群[29]。被孢霉属真菌的变化对土壤真菌群落变化的贡献最大;被孢霉属、镰刀菌属以及毛壳属真菌在植物残基的快速分解过程中发挥重要作用,促进了有机肥中植物残基分解和土壤养分浓度的提升[29]。靳冉[30]从土壤环境中的真 菌中筛选出1 株能够以碱木质素为唯一碳源生长的高效木质纤维素降解微生物—— 枝孢菌属Cladosporium。球囊霉属3 种AM 真菌均显著减少了根系周围尖孢镰刀菌数量,从而减轻香蕉枯萎病的危害[31]。添加含活性炭的有机土壤改良剂促进土壤真菌增殖,以维持或改善土壤结构[32]。以上分析可知,不同质地土壤秸秆还田配施腐熟剂要因地制宜,配施适宜的秸秆腐熟剂可增加土壤有益微生物;这些微生物可改善养分的有效性、土壤结构和抑制土壤传播疾病。秸秆还田配施腐熟剂真菌优势菌属之间的关系如何及土壤真菌和细菌群落的协同降解秸秆的模式等亟需进一步研究。
