饥饿和恢复投喂不同时间对西伯利亚鲟消化酶活性的影响
2020-06-30王常安刘红柏陆绍霞姜海波刘洋韩世成
王常安,刘红柏,陆绍霞,姜海波,刘洋,韩世成
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070;2.贵州大学动物科学学院,贵州 贵阳 550025)
饥饿是动物生长的不利因素之一,但在动物中普遍存在继饥饿或营养不足一段时间后恢复喂食,将出现超过正常生长速度的补偿生长。为了适应饥饿等环境的变化,鱼体消化酶活性会发生适应性变化[1]。这种变化在花鲈Lateolabrax maculatus[2]、虎鲨Herterodontus japonicus[3]、施氏鲟Acipenser schrenckii[4]、黑鲷Sparus macrocephalus[5]、许氏平鲉Sebastes schlegelii[6]、翘嘴鲌Culter alburnus[7]和鲤Cyprinus carpio[8]等已有报道。但是,鱼类饥饿和恢复投喂期间,消化系统的代谢调节过程的研究有限[9]。与肉食性鱼类相比,杂食性鱼类对饥饿的代谢调节策略资料仍然匮乏[9-11]。饥饿和恢复投喂对西伯利亚鲟Acipenser baerii 消化酶活性的影响至今未见报道。本文研究了饥饿期间及恢复投喂后西伯利亚鲟消化系统的蛋白酶、脂肪酶、淀粉酶活性的变化,旨在阐明饥饿和恢复投喂对西伯利亚鲟消化酶活性的影响,以期为鲟补偿生长效应提供依据。
1 材料与方法
1.1 材料
试验饲料用鱼粉和豆粕为蛋白源,鱼油和磷脂为脂肪源。饲料的配方及营养水平见表1。原料均过80 目筛后用鼓型混合机混合,制粒(直径为2.0m),然后置于-20℃冰箱中保存待用。
试验用西伯利亚鲟初始体质量为(64.43±1.06)g。选取体质健康、规格一致的个体放入室内流水系统。用基础饲料驯养14 d 后开始养殖试验。
1.2 方法
本试验采用各组饥饿时间不同而恢复投喂时间相同的试验设计。试验鱼饲养在室内500L 流水水族箱中。对照组(S0)持续投喂35d,试验组S5、S10、S15 分别饥饿5d、10d、15d,然后均恢复投喂20d。每组设3 个重复,每重复50 尾。水源为河水,水温18.2~21.3℃,溶氧>6.0mg/L。日饱食投喂2 次(9:00 和16:00)。养殖试验结束后,鱼体饥饿24h,用苯氧乙醇(0.5mL/L)麻醉,称重,采集样品?
试验开始、饥饿结束以及恢复投喂的5d、10d、15d、20d 时,均测量各组鱼的体质量。在试验开始、饥饿结束及恢复投喂的第5d、10d、15d、20d 时,每组随机取3 尾鱼,在冰盘上,取其肠和肝。剔除内含物和脂肪后,用冰浴生理盐水(0.86%)冲洗干净,然后用滤纸吸干,称重,装在自封袋中,放入超低温冰箱(-80℃)中保存待测。肝和中肠的蛋白酶、淀粉酶和脂肪酶活性分别以福林-酚法、淀粉-碘比色法和聚乙烯醇橄榄油乳化液水解法测定;组织蛋白含量采用考马斯亮蓝法测定[12]。
1.3 统计分析
数据以平均值±标准差(Mean±SD)表示。用软件SPSS for Windows 23.0 进行单因素方差分析和Duncan’s 多重比较,显著性水平P=0.05。
2 结果与分析
2.1 不同饥饿和恢复投喂时间对西伯利亚鲟体质量的影响
由表2 可知,饥饿结束时,S5 组、S10 组、S15 组西伯利亚鲟的体质量均显著低于对照组水平(P<0.05)。恢复投喂20d 后,S5 组、S10 组和S15 组体质量均快速增长。除S5 组与对照组水平差异不显著(P>0.05)外,S10 组、S15 组的体质量仍然显著低于对照组(P<0.05)。
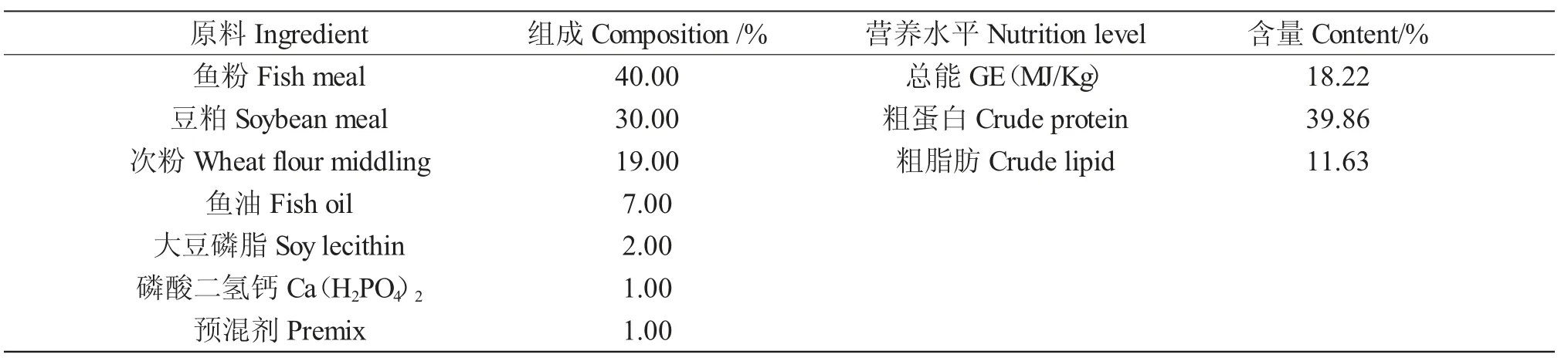
表1 基础饲料配方及营养水平(风干基础)Tab.1 Ingredients and approximate composition of the test diets(air-dry basis)
2.2 不同饥饿和恢复投喂时间对西伯利亚鲟肠道和肝蛋白酶活性的影响
由表3 可知,饥饿结束时,S15 组西伯利亚鲟肠道和肝蛋白酶活性显著低于对照组(P<0.05),而S5组和S10 组与对照组差异不显著(P>0.05)。恢复投喂后,各组鱼肠道和肝蛋白酶呈上升趋势。恢复投喂10d 后,各组肠道蛋白酶活性与对照组差异不显著(P>0.05)。恢复投喂5d 后,S5 组和S10 组肝蛋白酶活性与对照组差异不显著(P>0.05),恢复投喂20d 后,S15 组肝蛋白酶活性仍显著低于对照组(P<0.05)。
2.3 不同饥饿和恢复投喂时间对西伯利亚鲟肠道和肝脂肪酶活性的影响
饥饿结束时,各组西伯利亚鲟肠道和肝脂肪酶活性均显著低于对照组(P<0.05),恢复投喂过程中,S5 组、S10 组、S15 组肠道和肝脂肪酶活性均平稳上升。然而,恢复投喂结束后,S10 组、S15 组肠道和肝脂肪酶活性仍显著低于对照组(P<0.05)(表4)。
表2 试验前后各组西伯利亚鲟体质量的变化Tab.2 The changes in body weight(g)of Siberian sturgeon Acipenser baerii in various groups during the experiment(n=3;±s±SD)
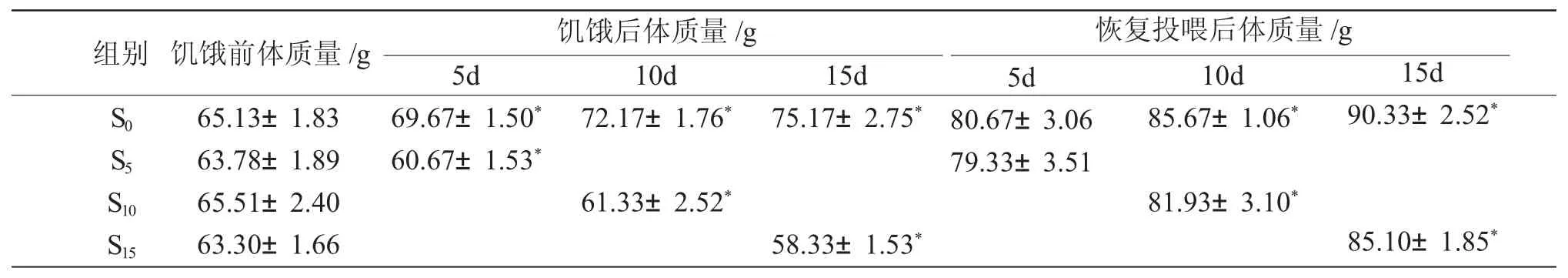
表2 试验前后各组西伯利亚鲟体质量的变化Tab.2 The changes in body weight(g)of Siberian sturgeon Acipenser baerii in various groups during the experiment(n=3;±s±SD)
注:同列中标有*表示组间差异显著(P <0.05)
表3 饥饿和恢复投喂不同时间对各组西伯利亚鲟蛋白酶活性的影响(IU/prot)Tab.3 Effects of starvation and refeeding on protease activities (IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
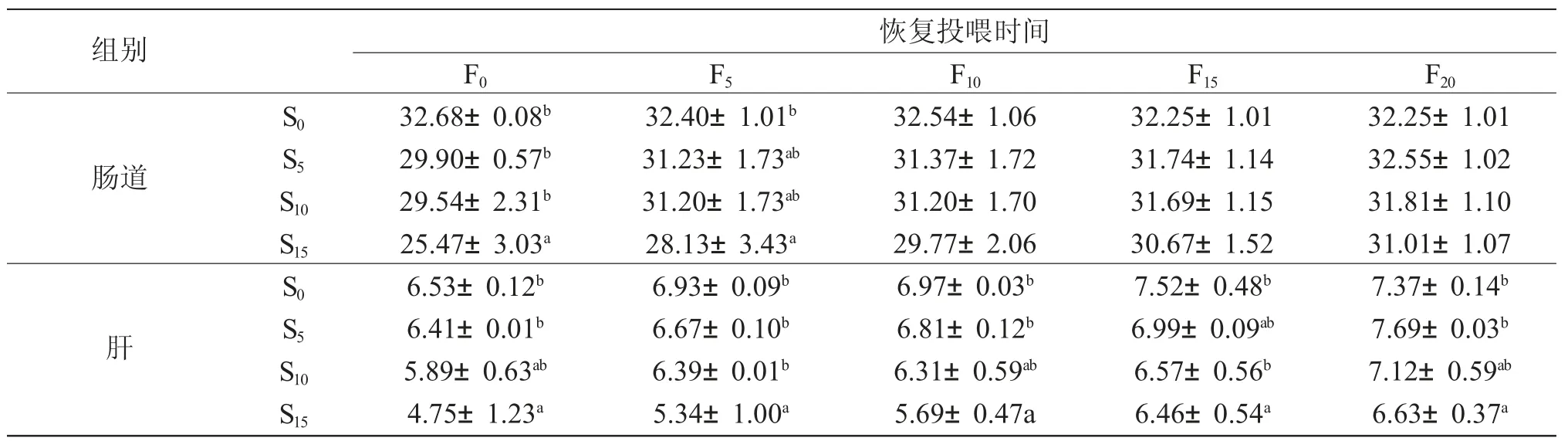
表3 饥饿和恢复投喂不同时间对各组西伯利亚鲟蛋白酶活性的影响(IU/prot)Tab.3 Effects of starvation and refeeding on protease activities (IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
注:同列中标有不同母者表示组间差异显著(P <0.05);标有相同字母者表示组间差异不显著(P >0.05).下表同
表4 饥饿和恢复投喂对各组西伯利亚鲟脂肪酶活性的影响(IU/prot)Tab.4 Effects of starvation and refeeding on lipase activities(IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
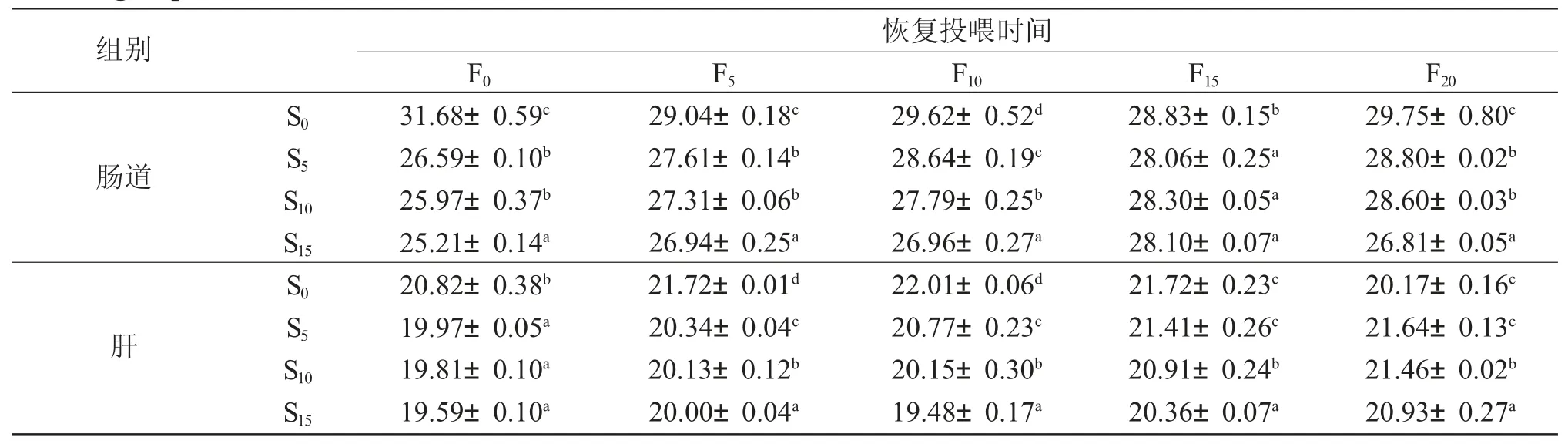
表4 饥饿和恢复投喂对各组西伯利亚鲟脂肪酶活性的影响(IU/prot)Tab.4 Effects of starvation and refeeding on lipase activities(IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
表5 饥饿和恢复投喂对西伯利亚鲟淀粉酶活性的影响(IU/prot)Tab.5 Effects of starvation and refeeding on amylase activities (IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
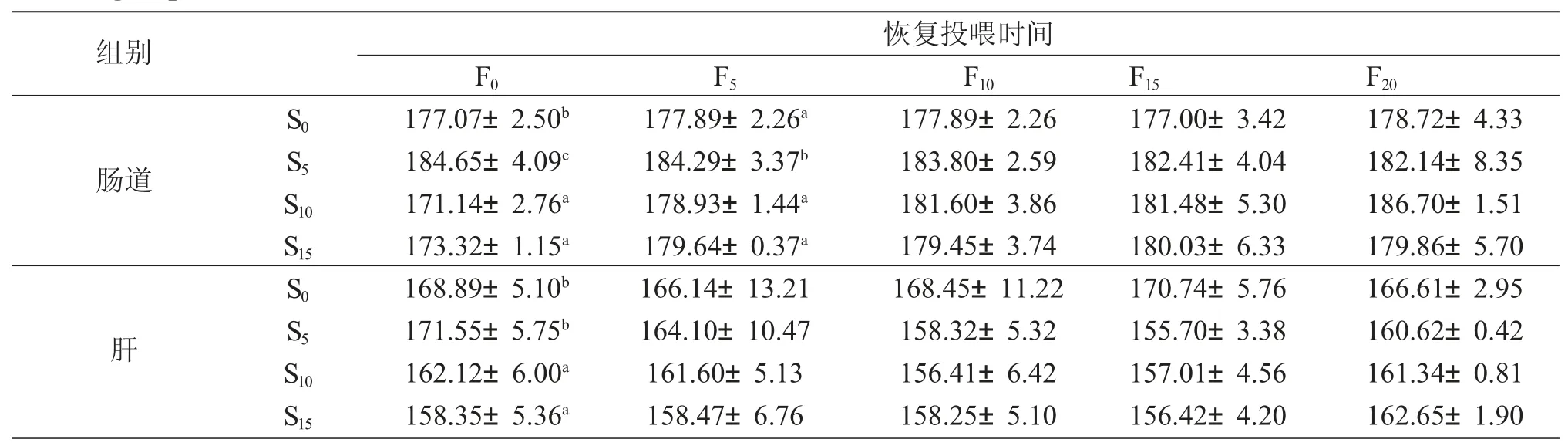
表5 饥饿和恢复投喂对西伯利亚鲟淀粉酶活性的影响(IU/prot)Tab.5 Effects of starvation and refeeding on amylase activities (IU/prot)in Siberian sturgeon Acipenser baerii in various groups(n=3;±s±SD)
2.4 饥饿和恢复投喂对西伯利亚鲟道和肝淀粉酶活性的影响
饥饿结束时,S10 组、S15 组肠和肝淀粉酶活性显著低于对照组(P <0.05),S5 组肠道淀粉酶活性显著高于对照组(P<0.05)。恢复投喂后,饥饿组肠和肝淀粉酶活性恢复至对照组水平,与对照组差异不显著(P>0.05)(表5)。
3 讨论
3.1 饥饿对鱼类消化酶活性的影响
鱼类为适应饥饿状态,需调整自身各种酶的活性来合理利用体内的贮存物质以维持生命。饥饿对鱼体消化酶活性的影响因鱼的种类、酶的种类、饥饿时间等不同呈不同变化。短期饥饿时,麦瑞加拉鲮Cirrhina mrigola 幼鱼淀粉酶活性的损失量均高于蛋白酶和脂肪酶[13]。钱云霞[2]研究了饥饿期间花鲈蛋白酶活性的变化,发现饥饿使鱼体各部分蛋白酶活性均有所下降。在短时饥饿下虎鲨淀粉酶活性下降,持续饥饿则开始上升[3]。饥饿期间,褐菖鲉Sebastiscus marmoratus 的蛋白酶、淀粉酶活性呈先升后降趋势,脂肪酶活性则缓慢降低[14]。饥饿明显影响施氏鲟Acipenser schrenckii 幼鱼消化酶的活性,饥饿7 d 时,所测的蛋白酶、脂肪酶和淀粉酶的活性均有明显下降,但随饥饿时间的延长,不同消化酶活性的变化不同[4]。
本研究中,饥饿5 d 时,西伯利亚鲟肠和肝淀粉酶活性均升高,其变化情况与所报道的结果类似[8];饥饿15 d 时,西伯利亚鲟蛋白酶、脂肪酶和淀粉酶活性均低于对照组。饥饿初期消化酶活性升高是鱼体对饥饿做出的应激反应,通过调节消化酶活性,达到积极利用体内的贮存物质,得以维持生命的目的[15-17]。饥饿15 d 时,西伯利亚鲟肠和肝消化酶活性降低的原因可能是饥饿时间偏长,其消化腺组织结构受损最终导致酶活性的下降[9,18-20]。
3.2 恢复投喂对鱼类消化酶活性的影响
鱼类饥饿后恢复投喂消化酶活性变化因种类的不同而异。西伯利亚鲟继饥饿后恢复摄食,淀粉酶活性有所下降,可能是鱼类在重新获得食物后,环境不再恶劣,淀粉酶活性便随之下降[8]。钱云霞[2]认为,在恢复投喂时,由器官实质性变化引起蛋白酶活性下降的恢复会迟缓,具体饥饿多长时间花鲈会出现这些变化还需要结合组织变化进一步研究。虎鲨饥饿后恢复喂食期间淀粉酶活性增加较快,说明鱼体消化能力和能量转化效率得到增强,以保证其获得补偿生长[3]。
本试验中,恢复投喂后,S5 组西伯利亚鲟肠和肝的淀粉酶活性开始下降,然后逐渐接近对照组水平;其余各组消化酶活性呈上升趋势。这与有关报道的结果一致[2,8,10]。本研究认为,短期饥饿(5d)后恢复投喂,西伯利亚鲟淀粉酶活性下降是由于应激反应过后消化酶活性逐渐恢复到初始水平的结果。饥饿10d 和15d 后恢复投喂,西伯利亚鲟消化酶活性上升,可能是环境改善,食物刺激消化酶的分泌,导致消化酶活性的升高;也可能恢复投喂后,饥饿引起的消化腺损伤得到修复,器官功能恢复正常,使消化酶分泌量增加的结果[9]。
3.3 西伯利亚鲟幼鱼的补偿生长效应
鱼类补偿生长一般分为部分补偿生长、完全补偿生长、超补偿生长[21,22]。补偿生长的有无及补偿程度要由相同时间内持续饱食投喂的对照组与恢复生长期间内的特定生长率和体质量相比较而判定[23]。本研究采用“恢复喂食时间+饥饿处理时间为一定值,对照组持续投喂”的方法研究西伯利亚鲟幼鱼的补偿生长。从体质量来看,饥饿5 d 恢复投喂20 d 后,与对照组不存在显著性差异(P>0.05),表明经饥饿处理5d 的幼鱼具有完全补偿生长效应。然而,饥饿10d 或15d 恢复投喂20d 时,体质量仍显著低于对照组(P<0.05),说明较长时间饥饿的幼鱼仅具有部分补偿生长效应。
补偿生长效应的解释目前主要有2 种:①代谢水平降低。饥饿导致鱼类代谢水平降低,当恢复摄食后,较低的代谢水平可以持续一段时间,这种低代谢支出使鱼类用于生长的能量增多,从而提高了食物转化率。②食欲增强。鱼类饥饿后恢复喂食时,食欲明显增强,通过提高摄食率来实现补偿生长[18]。本试验结果显示,鱼体的消化酶活性变化总体上与其补偿生长相对应,而且消化酶活性的补偿效应随着恢复投喂时间的延长而不断减弱。因此,西伯利亚鲟幼鱼的补偿生长效应更倾向于食欲增强的解释。恢复投喂后鱼体的代谢水平是否仍保持较低的代谢水平,需要进一步研究。
