人工髋关节摩擦界面蛋白质吸附变性分解行为及类石墨碳润滑层形成的分子机制
2020-06-30经佩佩张悦罗潇雨龚艳丽冯庆国冷永祥邓乔元
经佩佩,张悦,罗潇雨,龚艳丽,冯庆国,冷永祥,邓乔元
人工髋关节摩擦界面蛋白质吸附变性分解行为及类石墨碳润滑层形成的分子机制
经佩佩1,张悦1,罗潇雨1,龚艳丽1,冯庆国1,冷永祥1,邓乔元2
(1.西南交通大学 材料科学与工程学院,成都 610031;2.海南大学 材料科学与工程学院,海口 570228)
人工关节置换术被认为是治疗晚期关节炎、关节功能丧失等关节类疾病最有效和最终的治疗方式。首先介绍了人工髋关节体内服役环境特点及关节摩擦界面生物蛋白膜与类石墨碳润滑层的形成,进一步论述了在模拟体内服役环境下,过渡族金属铜催化摩擦界面的蛋白质变性降解,促进生物蛋白膜向类石墨碳润滑层的转变,最后探讨了过渡族金属离子介导产生活性氧自由基(ROS)催化蛋白质吸附、变性、分解及生物蛋白膜、类石墨碳润滑层形成的分子机制,并对未来陶瓷人工关节材料的设计提出展望。
人工关节;摩擦界面;生物蛋白膜;类石墨碳润滑层;过渡族金属;活性氧自由基
人工关节置换术是指采用金属、高分子聚乙烯、陶瓷等材料,根据人体关节的形态、构造及功能制成人工关节假体,通过外科技术植入人体内,代替患病关节功能,达到缓解关节疼痛,恢复关节功能的目的。人工关节置换术被认为是治疗晚期关节炎、关节功能丧失等关节类疾病最有效和最终的治疗方式[1],每年全世界范围内有超过100万次关节置换手术[2],预计到2025年全球人工关节市场将达到253.1亿美元。其中,髋关节置换术是人工关节置换术中很常见的一类手术,其十年的成功率已经超过90%。人工髋关节按关节球头-关节臼(内衬)配副类型主要分为金属-高分子关节(MoP)、陶瓷-高分子关节(CoP)、金属- 金属(MoM)关节及陶瓷-陶瓷(CoC)关节等四 大类[3-4]。
MoP与CoP是较为常用的人工关节配副[5],但高分子聚乙烯在长期摩擦磨损过程中会产生微米级聚乙烯磨屑,诱导患者骨质溶解,导致假体松动等并发症的发生,严重者需进行翻修手术[5-6]。MoM类型的人工关节具有术后关节稳定,患者康复快的优势,但是MoM类型的人工关节仍然存在未解决的问 题——磨损导致的金属离子释放和金属磨屑的产生会给患者带来过敏、疼痛等相关并发症,增加患者痛苦的同时还会导致假体植入失败[7-8]。与MoP、CoP、MoM等人工关节相比,CoC类型的人工关节耐磨损性能优异[9],最新一代的陶瓷关节体内磨损率为~0.16 mm3/106cycles,且抗刮擦与耐腐蚀性能好[10-11],显著降低了骨溶解、假体松动及感染等并发症的发生率[12-14],在临床上得到越来越广泛的应用,具有良好的市场前景。但是CoC人工关节成本较高,相对其余类型人工关节售价较为昂贵,同时存在异响及由于陶瓷韧性不足而带来的断裂风险,这在一定程度上限制了陶瓷关节的应用[15-16]。
人工关节的使用是为了重建关节功能,关节对摩副之间的磨损性能决定了关节的质量及其服役寿命。人工关节主要在人体的关节腔内服役并被体液及关节液所润滑,关节腔内的生理环境会影响关节的摩擦性能。人工关节置换术后,由于大部分关节囊被切除,将不再分泌或较少分泌关节液,人工关节周围被润滑性能较差的体液充满,这些体液虽然润滑性能较关节液差,但其主要成分与关节液接近,含有白蛋白、球蛋白、透明质酸、脂质等成分[17-19]。体液中的蛋白质分子对摩擦过程起着重要的作用,影响植入人工关节的摩擦润滑性能。
1 人工关节摩擦界面生物蛋白膜及类石墨碳润滑层的形成
1.1 摩擦界面生物蛋白膜的形成
摩擦过程中,人工关节材料表面会吸附一层蛋白质,H. Mishina[20]及Y. Yan[21]等研究发现,摩擦过程中金属人工关节材料表面的吸附蛋白层在摩擦力作用下会形成生物蛋白膜,可以降低关节的摩擦及磨损,并且这层生物蛋白膜还可以在对摩副之间形成屏障,减少腐蚀性离子的运输,降低腐蚀[21]。相比于金属关节,陶瓷关节摩擦界面形成的生物蛋白膜虽然可以使摩擦界面在高接触应力下仍保持非常低的摩擦[22],但陶瓷材料表面与白蛋白亲和力不强,蛋白在材料表面吸附强度较低,在卸载阶段蛋白质从表面脱出,生物蛋白膜不能稳定存在[20,23]。
材料表面性质(化学结构[24]、亲疏水性[25]、荷电性[26]、粗糙度[27]等)会影响蛋白质分子在其表面的吸附状态,如吸附量、吸附种类和构象等。一般情况下,蛋白与极性、疏水、带电荷、粗糙度较大的材料表面之间相互作用较强。由于蛋白结构由氨基酸构成,里面既有带正电的区域,也有带负电的区域,因此荷电材料表面蛋白吸附量较多,蛋白质构象容易发生变化[26]。此外,非极性材料表面的蛋白构象也容易发生变化[28]。一般情况下,蛋白更易在疏水表面吸 附[25],而强疏水性的表面容易破坏蛋白的构象[29],但是周浩等[30]发现白蛋白容易在亲水表面吸附。
1.2 摩擦界面类石墨碳润滑层的形成
在生理环境中,生物蛋白膜在金属离子的催化作用下还可以进一步转变成类石墨碳润滑层。R. Pourzal[31]及Y. Liao[32]等人的研究结果证明,金属-金属关节摩擦界面吸附的蛋白在金属元素的催化作用下发生变性、分解,形成生物蛋白膜,随着摩擦的进行,生物蛋白膜可以进一步转变成类石墨碳润滑层。如图1所示,经过长期的体内摩擦过程,关节界面产生的摩擦层中出现了晶粒尺寸为几纳米、短程有序的 石墨结构[32]。研究者认为,该摩擦层是白蛋白(C3076H4833N821O919S42)消除N、S、O元素之后的产物,主要含有C、H两种元素,其组成比例为3076∶448。此外,电子能量损失谱(EELS)结果显示,该摩擦层中石墨碳的原子百分比为82%,内部含有大量的石墨结构,因此该摩擦层是具有良好润滑性能的类石墨碳润滑层。虽然关于类石墨碳润滑层的形成机制还有待研究,但可以肯定的是,一些过渡族金属可以作为催化剂,促进类石墨碳润滑层的形成[32]。

图1 摩擦层的高分辨电子图谱[32]
本团队研究结果证明了Cu金属可以催化白蛋白在摩擦界面吸附、变性、分解并形成类石墨碳润滑 层[33]。比较Cu/Al2O3与CoCrMo/Al2O3两种对摩副在牛血清白蛋白(BSA)溶液中的摩擦行为发现,相比于CoCrMo合金,过渡族金属Cu可以促进磨痕内部对BSA分子的吸附。如图1所示,图中绿色荧光代表被荧光蛋白标记的BSA分子,可以发现,在没有摩擦磨损作用的情况下(图2a),Cu表面吸附的BSA分子呈现随机分布的状态;摩擦磨损作用后(图2b),大量BSA分子被吸附到Cu金属表面的磨痕中。利用电感耦合等离子体发射光谱(ICP-OES)检测到摩擦磨损完毕后,溶液中的Cu离子质量浓度为0.0965 μg/mL,说明摩擦磨损释放的铜离子可以促进磨痕内部对BSA分子的吸附,促进生物蛋白膜的形成。

图2 Cu金属表面荧光标记蛋白图像[33]
Cu表面吸附的蛋白质分子在Al2O3球头的剪切作用下,结构会发生改变,分子量降低。如图3所示,Cu磨痕处蛋白膜的蛋白印迹结果出现了明显的拖尾现象,表明Cu/Al2O3摩擦副在摩擦磨损过程中可以促使摩擦界面的BSA分子转变成分子量更小的物质(发生变性分解)。进一步采用Raman光谱分析磨斑,结果如图4所示,与CoCrMo/Al2O3对摩副相比,Cu/Al2O3对摩副的磨损区域中出现类石墨碳薄膜的拉曼信号——D峰和G峰,表明在Cu-Al2O3摩擦界面形成了类石墨碳润滑层,这层类石墨碳润滑层来源于摩擦界面的蛋白质降解。
综上所述,相比于CoCrMo合金,过渡族金属Cu具有更好的催化摩擦界面产生类石墨碳润滑层的能力,其催化机理如图5所示。首先Cu/Al2O3摩擦副之间的摩擦磨损作用会释放Cu离子,释放的Cu离子会和溶液中的BSA分子结合,促进BSA分子吸附到磨痕界面处,吸附到磨痕处的蛋白分子会逐渐形成一层生物蛋白膜,这层生物蛋白膜在金属离子的催化作用和摩擦副的剪切作用下,逐渐转变为富碳的类石墨碳润滑层[33]。
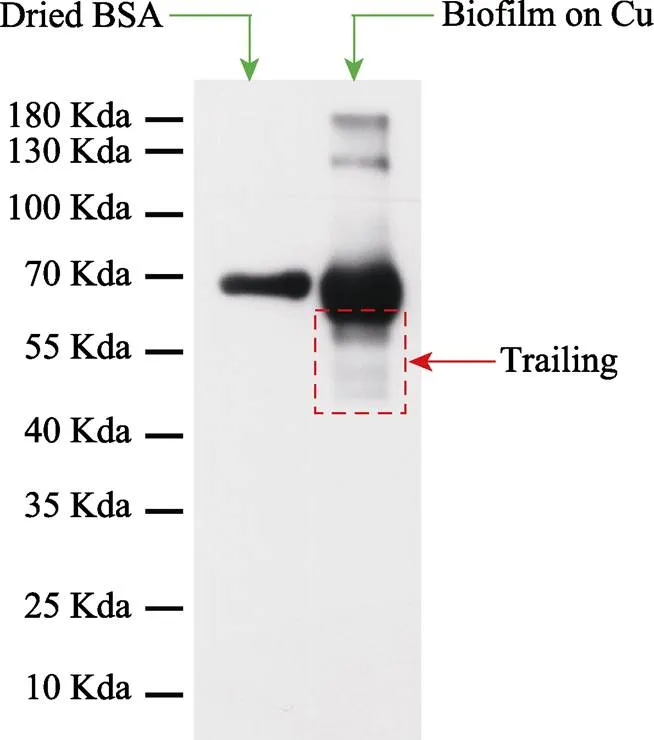
图3 干燥BSA分子和Cu磨痕处蛋白膜的蛋白印迹检测结果[33]
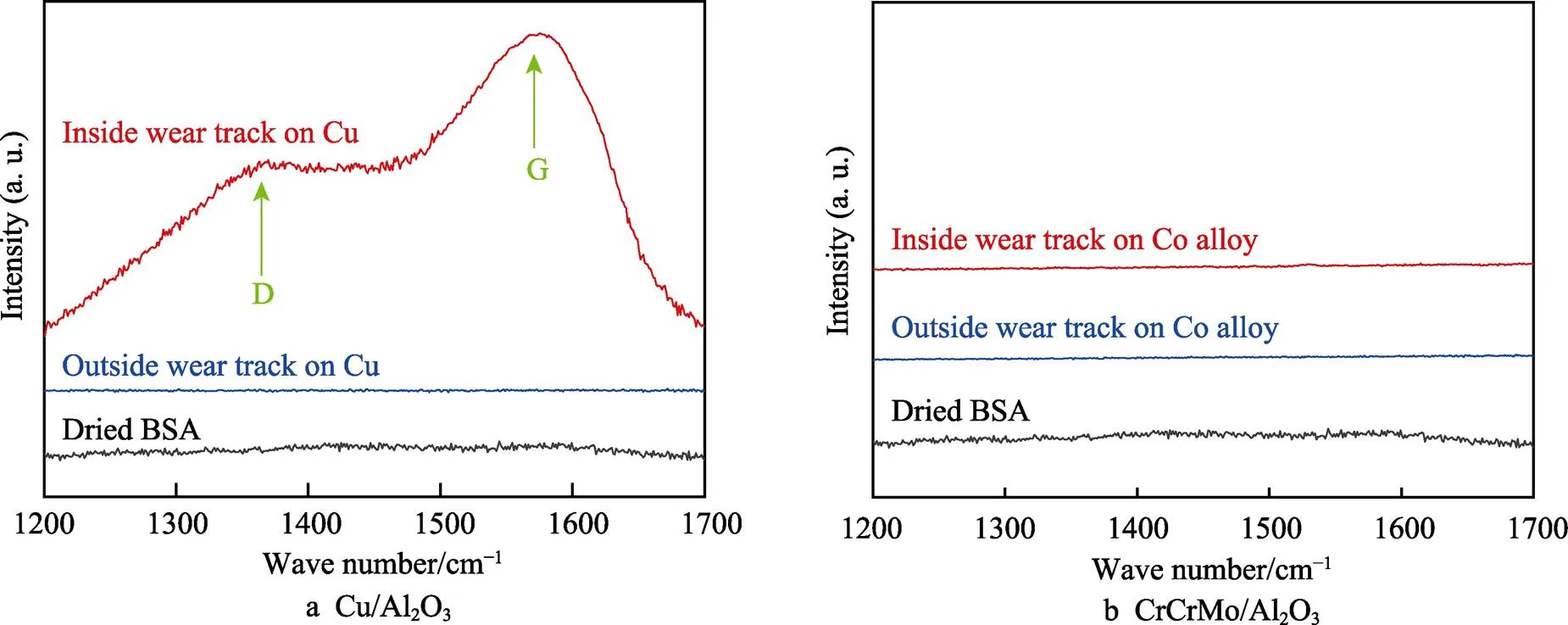
图4 干燥BSA分子与不同金属磨痕内外的拉曼光谱[33]
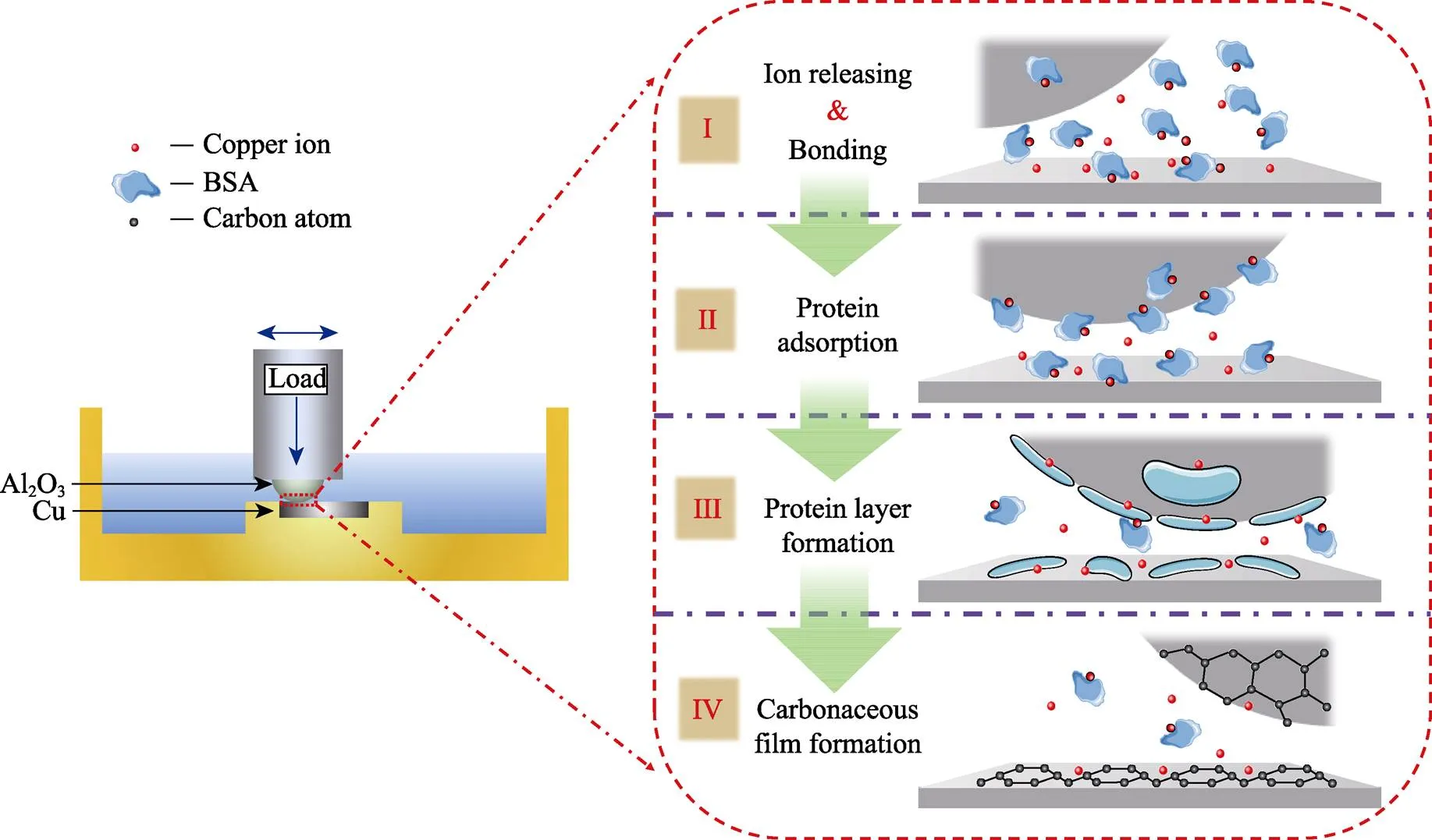
图5 过渡族金属Cu摩擦界面处形成类石墨碳润滑层示意图[33]
1.3 小结
本节介绍了人工髋关节摩擦界面生物蛋白膜与类石墨碳润滑层的形成,并且研究证明过渡族金属离子可以催化摩擦界面生物蛋白膜向类石墨碳润滑层的转变。但是关于过渡族金属离子催化蛋白质变性的分子作用机制及生物蛋白膜、类石墨碳润滑层的形成与转变机制,目前并没有研究者提出详细的解释,仍需要进一步的研究。
2 过渡族金属离子-ROS-蛋白质分子作用机制
2.1 过渡族金属离子与蛋白作用
金属离子对蛋白的正常功能性以及生物蛋白膜的产生有着十分重要的作用。大部分哺乳动物蛋白包含四个金属结合位点[34],即N基位点(NBS)、Cyr34残基、多金属结合位点(MBS)与非定位位点B(Site B)。过渡族金属离子可通过一种或多种结合位点与蛋白质配位结合,蛋白质的侧链或官能团可以折叠围绕金属离子,形成特定的空间构型。如表1所示,Cu(II)与Ni(II)可通过NTS与MBS位点与血清白蛋白结合,形成四方平面空间构型[35-39];Zn(II)可通过MBS位点与血清白蛋白结合,形成五配体空间构型[40];Co(II)可通过NTS、MBS与Site B位点与血清白蛋白结合,形成八面体空间构型[41]。
表1 过渡族金属离子与人血清蛋白质的结合
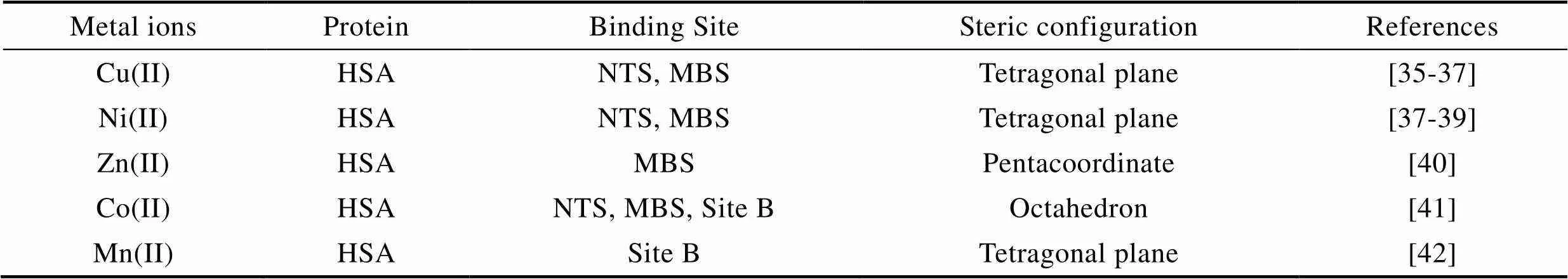
Tab.1 Binding of transition metal ions to human serum proteins (HSA)
过渡族金属离子会诱导生物蛋白膜的形成。一方面,过渡族金属离子,如Cu(II),可以诱导蛋白质主链伸展,使蛋白质中α-螺旋结构减少,β-折叠结构增多[43],变性后的蛋白质分子从原来有序、卷曲紧密结构变为无序、松散伸展状结构,从而使蛋白质内部残基(如Trp残基)的疏水基团裸露出来,疏水性增加,导致聚集沉降;另一方面,金属离子具有桥联作用,可通过金属离子-蛋白结合位点与蛋白质配位结合,诱导蛋白交联网络的形成。在摩擦力的协同作用下,最终形成一层生物蛋白膜。
2.2 过渡族金属离子催化蛋白质变性分解机制
研究结果表明,蛋白质会在过渡族金属的催化作用下发生变性、分解,最终将生物蛋白膜转变为类石墨碳润滑层[32,33]。过渡族金属有空的d轨道或者d轨道电子,在化学反应中可以提供空轨道充当亲电试剂,或者提供孤对电子充当亲核试剂,形成中间产物,降低反应活化能,促进反应进行。因此,过渡族金属可以作为无机催化剂介导催化反应,产生活性氧自由基(Reactive Oxygen Species,ROS)。有研究表明,过渡族金属离子(如Fe2+)可以催化多肽及醇溶蛋 白(C-hordein)产生活性氧自由基(如羟基自由基(HO•))[44]。
自由基是体内各种生化反应的中间代谢产物,对维持机体的正常代谢有特定的促进作用[45-46],可以增强白细胞的吞噬功能,提高杀菌效果,并参与前列腺素、脂肪加氧酶、胶原蛋白、凝血酶原等一系列酶与激素的合成,通常情况下,体内自由基处于不断产生与清除的动态平衡之中[47]。由于活性氧自由基(ROS)含有未配对的电子,因而具有高度的活泼性和极强的氧化反应能力[48],能通过氧化作用使体内的蛋白质生物大分子变性分解。
ROS水解蛋白质的反应过程如图6所示,ROS容易夺取蛋白质主链α-C上的H原子,产生以碳为中心的自由基(产物②),再与O2反应生成烷过氧自由基(产物③)[49]。一方面,烷过氧自由基可通过脱除氢过氧自由基(HO2•)形成亚胺(产物④),亚胺不稳定,容易水解成酰胺(产物⑤)和羰基化合物(产物⑥),使蛋白质主链断裂[50];另一方面,烷过氧自由基可从其余反应物中夺取氢原子,生成氢过氧化物(产物⑦),经由单电子还原过程转变为烷氧自由基(产物⑧),烷氧自由基进一步分解为羰基化合物(产物⑨)和酰基自由基(产物⑩),导致主链断裂[51]。其中反应生成的氢过氧自由基(HO2•)、烷基自由基(R•)以及酰基自由基(产物⑩)会继续和蛋白质的主链作用,产生更多自由基,参与反应,进而发生级联反应,水解蛋白质。蛋白质生物大分子的主链逐级断裂后形成低分子量多肽或氨基酸单体,在摩擦剪切力的作用下,多肽或氨基酸可能会继续裂解,形成小分子基团。

图6 活性氧自由基水解蛋白质的反应过程
本研究团队利用分子动力学模拟计算氨基酸在过渡族金属Cu表面的吸附、断键过程,结果如图7所示,氨基酸分子在过渡族金属Cu表面吸附稳定,并且在摩擦力作用下,Cu可以促进氨基酸裂解成小分子片段,其中裂解的部分小分子片段会和Cu表面形成强化学结合,这些吸附在Cu表面的含碳小分子片段为最终在摩擦界面形成类石墨碳润滑层提供了碳源[52]。
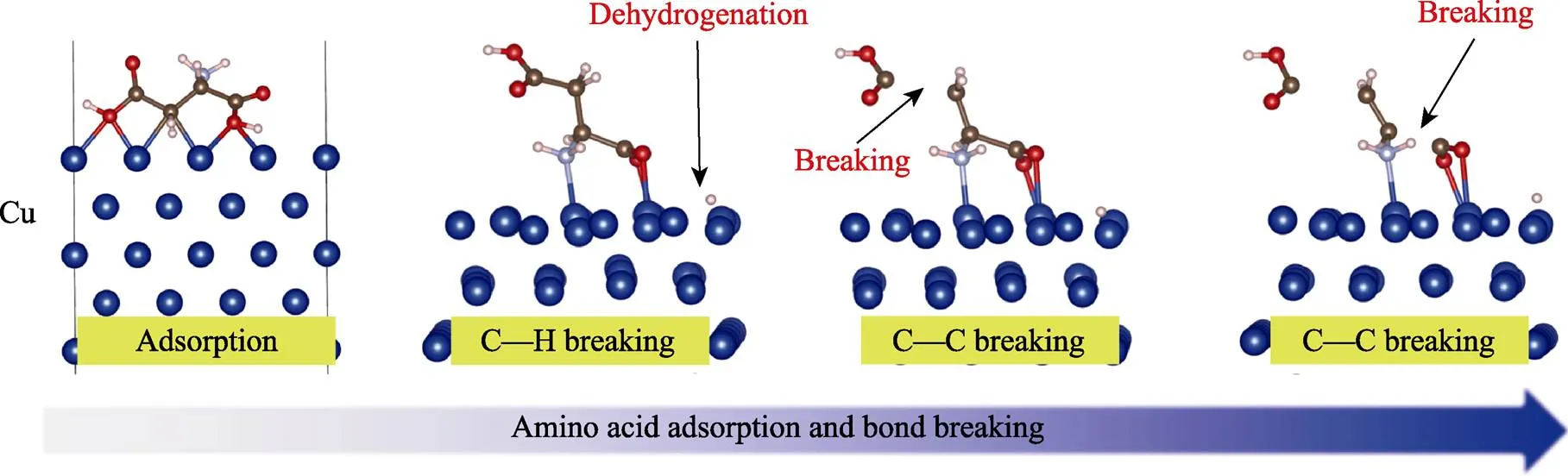
图7 Cu表面天冬氨酸在剪切力作用下分子动力学模拟[52]
2.3 小结
本节所提出的过渡族金属离子催化生物蛋白膜及类石墨碳润滑层形成的分子机制如下:①过渡族金属离子诱导蛋白质主链伸展,促进蛋白聚集沉降;②过渡族金属离子具有桥联作用,与蛋白质配位结合诱导蛋白交联网络的形成。在摩擦力的协同作用下,摩擦界面形成一层生物蛋白膜。在长期的摩擦过程中,过渡族金属离子介导产生的活性氧自由基(ROS)水解蛋白质,通过级联反应使蛋白质主链断裂,蛋白质从高阶结构逐渐裂解成多肽或氨基酸等低阶结构。在摩擦力的共同作用下,氨基酸等低阶结构进一步裂解成小分子片段,并与过渡族金属表面形成强化学结合,在摩擦力持续作用下,最终在材料表面形成一层类石墨碳润滑层,实现材料体内自润滑功能。
3 总结与展望
本文针对体内服役过程中人工关节摩擦界面处会形成生物蛋白膜,并且在金属元素的催化作用下,生物蛋白膜还可进一步转变成类石墨碳润滑层的现象,研究证明金属铜离子可以催化蛋白质变性分解,促进生物蛋白膜向类石墨碳润滑层的转变。在此基础上,本文揭示了过渡族金属离子介导产生活性氧自由基(ROS)催化蛋白质变性分解及生物蛋白膜、类石墨碳润滑层形成的分子机制。
随着年轻患者的增加以及人口老龄化的加剧,患者对人工关节有着高质量和长寿命的要求。陶瓷关节由于其优异的耐磨损、耐腐蚀性能开始逐渐占据关节市场,但陶瓷关节仍存在碎裂、异响等临床并发症,这是制约其发展的关键因素。陶瓷关节摩擦界面润滑状态差(界面润滑不足、润滑层薄)和陶瓷关节材料力学性能不足是导致其临床并发症的主要原因。针对陶瓷关节体内服役的生理环境特点(存在白蛋白、球蛋白等生物分子),通过向陶瓷材料中掺杂过渡族金属元素(Cu、Mn等),利用金属离子介导体内白蛋白、球蛋白等生物分子在材料表面的吸附、变性、分解,在摩擦剪切力及金属离子催化作用下,生物分子在摩擦界面形成生物蛋白膜,随着摩擦的进行,生物蛋白膜转变为类石墨碳润滑层。生物蛋白膜及类石 墨碳润滑层可以润滑摩擦界面,改善陶瓷材料摩擦 界面润滑状态,降低界面摩擦系数及界面接触应力,减轻界面磨损。另外,通过金属掺杂也可以提高摩擦界面润滑层的厚度,降低界面接触应力及界面磨损,抑制磨损裂纹形成及扩展,降低材料的韧性需求和 陶瓷假体破损、异响发生风险,提高陶瓷人工关节的质量。
[1] FERGUSON R J, PALMER A J, TAYLOR A, et al. Hip replacement[J]. Lancet, 2018, 392(10158): 1662-1671.
[2] 裴福兴. 中国髋、膝关节置换的现状及展望[J]. 中国骨与关节杂志, 2012, 1(1): 4-8. PEI Fu-xing. The current status and future perspective of hip and knee arthroplasty in China[J]. Chinese journal of bone and joint, 2012, 1(1): 4-8.
[3] ANSARI J S, MATHARU G S, PANDIT H. Metal-on- metal hips: current status[J]. Orthopaedics & trauma, 2017, 32(1): 54-60.
[4] 邓乔元, 张腾飞, 武冰洁, 等. 类金刚石薄膜在人工关节摩擦配副表面改性的应用[J]. 表面技术, 2016, 45(5): 1-7. DENG Qiao-yuan, ZHANG Teng-fei, WU Bing-jie, et al. Diamond-like carbon film and its application on articular surface of artificial joint for increasing wear resistance[J]. Surface technology, 2016, 45(5): 1-7.
[5] GHOSH S, ABANTERIBA S. Status of surface modification techniques for artificial hip implants[J]. Science & technology of advanced materials, 2016, 17(1): 715-735.
[6] ALIAS E, DHARMAPATNI A S S K, HOLDING A C, et al. Polyethylene particles stimulate expression of ITAM- related molecules in peri-implant tissues and when stimulating osteoclastogenesis in vitro[J]. Acta biomaterialia, 2012, 8(8): 3104-3112.
[7] WILLISOWEN C A, KEENE G C, OAKESHOTT R D. Early metallosis-related failure after total knee replacement: a report of 15 cases[J]. The journal of bone & joint surgery, 2011, 93(2): 205-209.
[8] 邓乔元, 李延涛, 经佩佩, 等. 等离子体表面改性用于提高人工关节、椎间盘耐磨耐蚀性的研究进展[J]. 中国表面工程, 2019, 32(5): 1-12. DENG Qiao-yuan, LI Yan-tao, JING Pei-pei. Research progress of wear and corrosion resistance of artificial joint and disc by plasma surface modification[J]. China surface engineering, 2019, 32(5): 1-12.
[9] GRUPP T M, HOLDERIED M, MULLIEZ M A, et al. Biotribology of a vitamin E-stabilized polyethylene for hip arthroplasty—Influence of artificial ageing and third- body particles on wear[J]. Acta biomaterialia, 2014, 10 (7): 3068-3078.
[10] KOCAGOZ S B, UNDEROOD R J, MACDONALD D W, et al. Ceramic heads decrease metal release caused by head-taper fretting and corrosion[J]. Clinical orthopaedics & related research, 2016, 474(4): 985-994.
[11] PICONI C, PORPORATI A A, STREICHER R M. Ceramics in THR bearings: Behavior under off-normal conditions[J]. Key engineering materials, 2014, 631: 3-7.
[12] KRETZER J P, MUELLER U, STREIT M R, et al. Ion release in ceramic bearings for total hip replacement: Results from an in vitro and an in vivo study[J]. International orthopaedics, 2017, 42(1): 1-6.
[13] BERAUDI A, STEA S, DE PASQUALE D, et al. Metal ion release: also a concern for ceramic-on-ceramic couplings?[J]. Hip international the journal of clinical & experimental research on hip pathology & therapy, 2014, 24(4): 321-326.
[14] SORRENTINO R, COCHIS A, AZZIMONTI B, et al. Reduced bacterial adhesion on ceramics used for arthroplasty applications[J]. Journal of the european ceramic society, 2018, 38(3): 963-970.
[15] 曾建春, 曾意荣, 樊粤光, 等. 第四代陶对陶全髋关节置换术后陶瓷头碎裂翻修[J]. 中华关节外科杂志(电子版), 2013, 7(5): 722-726. ZENG Jian-chun, ZENG Yi-rong, FAN Yue-guang, et al. Fragmentation and revision of ceramic heads after the 4th generation ceramic total hip arthroplasty[J]. Chinese journal of joint surgery (electronic edition), 2013, 7(5): 722- 726.
[16] CHEVILLOTTE C, TROUSDALE R T, CHEN Q, et al. The 2009 frank stinchfield award: “Hip squeaking”: A biomechanical study of ceramic-on-ceramic bearing surfaces[J]. Clinical orthopaedics & related research, 2010, 468(2): 345-350.
[17] TEMPLE WONG M M, REN S, QUACH P, et al. Hyaluronan concentration and size distribution in human knee synovial fluid: variations with age and cartilage degeneration[J]. Arthritis research & therapy, 2016, 18(1): 18-26.
[18] STEVENSON H, JAGGARD M, AKHBARI P, et al. The role of denatured synovial fluid proteins in the lubrication of artificial joints[J]. Biotribology, 2019, 17: 49-63.
[19] GHOSH S, CHOUDHURY D, DAS N S, et al. Tribological role of synovial fluid compositions on artificial joints—A systematic review of the last 10 years[J]. Lubrication science, 2014, 26(6): 387-410.
[20] MISHINA H, KOJIMA M. Changes in human serum albumin on arthroplasty frictional surfaces[J]. Wear, 2008, 265(5): 655-663.
[21] YAN Y, NEVILLE A, DOWSON D. Biotribocorrosion— an appraisal of the time dependence of wear and corrosion interactions: I. The role of corrosion[J]. Journal of physics D: applied physics, 2006, 39(15): 3200-3205.
[22] NEČAS D, VRBKA M, KŘUPKA I, et al. The effect of kinematic conditions and synovial fluid composition on the frictional behaviour of materials for artificial joints[J]. Materials, 2018, 11(5): 767-779.
[23] NEČAS D, VRBKA M, URBAN F, et al. In situ observation of lubricant film formation in THR considering real conformity: the effect of diameter, clearance and material[J]. Journal of the mechanical behavior of biomedical materials, 2016, 69: 66-74.
[24] 王传勇, 李伟, 蒋丽. 生物陶瓷表面蛋白吸附的研究进展[J]. 国际口腔医学杂志, 2012, 39(4): 550-553. WANG Chuan-yong, LI Wei, JIANG Li. Research progress of protein adsorption on surface of bioceramics[J]. International journal of stomatology, 2012, 39(4): 550- 553.
[25] ANDRADE J D, HLADY V. Protein adsorption and materials biocompatibility: A tutorial review and suggested hypotheses[M]. Berlin Heidelberg: Springer, 1986.
[26] 徐晓宙, 高琨. 生物材料学[M]. 北京: 科学出版社, 2016. XU Xiao-zhou, GAO Kun. Biomaterial[M]. Beijing: Science Press, 2016.
[27] RECHENDORFF K, HOVGAARD M B, FOSS M, et al. Enhancement of protein adsorption induced by surface roughness[J]. Langmuir, 2006, 22(26): 10885-10888.
[28] GAURAV A, SUMIT S, DUTTA A K, et al. Conformational transitions of adsorbed proteins on surfaces of varying polarity[J]. Langmuir, 2010, 26(13): 10803-10811.
[29] WILSON C J, CLEGG R E, LEAVESLEY D I, et al. Mediation of biomaterial-cell interactions by adsorbed proteins: A review[J]. Tissue engineering, 2005, 11(2): 1-18.
[30] 周浩. 血浆蛋白质在生物材料表面的吸附和竞争吸附研究[D]. 重庆: 重庆大学, 2007. ZHOU Hao. Study on adsorption and competive adsorption of plasma proteins onto the surfaces of biomaterial[D]. Chongqing: Chongqing University, 2007.
[31] POURZAL R, MARTIN E J, VAJPAYEE S, et al. Investigation of the role of tribofilms in self-mating CoCrMo systems utilizing a quartz crystal microtribometer[J]. Tribology international, 2014, 72(4): 161-171.
[32] LIAO Y, POURZAL R, WIMMER M A, et al. Graphitic tribological layers in metal-on-metal hip replacements[J]. Science, 2011, 334(6063): 1687-1690.
[33] DENG Q Y, GONG Y L, JING P P, et al. Formation of a carbonaceous film on the surface of Cu in a bovine serum albumin solution[J]. Surface & coatings technology, 2019, 358: 611-616.
[34] BAL W, SOKOLOWSKA M, KUROWSKA E, et al. Binding of transition metal ions to albumin: sites, affinities and rates[J]. Biochimica et biophysica acta general subjects, 2013, 1830(12): 5444-5455.
[35] RÓZGA M, SOKOŁOWSKA M, PROTAS A M, et al. Human serum albumin coordinates Cu(II) at its N-terminal binding site with 1 pM affinity[J]. Journal of biological inorganic chemistry, 2007, 12(6): 913-918.
[36] SOKOŁOWSKA M, PAWLAS K, BAL W. Effect of common buffers and heterocyclic ligands on the binding of Cu(II) at the multimetal binding site in human serum albumin[J]. Bioinorganic chemistry and applications, 2010, 2010: 1-7.
[37] KOZLOWSKI H, BAL W, DYBA M. Specific structure-stability relations in metlalopeptides[J]. Coordination chemistry reviews, 1999, 184(1): 319-346.
[38] SOKOŁOWSKA M, KREZEL A, DYBA M, et al. Short peptides are not reliable models of thermodynamic and kinetic properties of the N-terminal metal binding site in serum albumin[J]. Febs journal, 2002, 269(4): 1323-1331.
[39] BAL W, CHRISTODOULOU J, SADLER P J, et al. Multi-metal binding site of serum albumin[J]. Journal of inorganic biochemistry, 1998, 70(1): 33-39.
[40] BLINDAUER C A, HARVEY I, BUNYAN K E, et al. Structure, properties, and engineering of the major zinc binding site on human albumin[J]. Journal of biological chemistry, 2009, 284(34): 23116-23124.
[41] SOKOŁOWSKA M, WSZELAKA-RYLIK M G, POZNAŃSKI J A, et al. Spectroscopic and thermodynamic determination of three distinct binding sites for Co(II) ions in human serum albumin[J]. Journal of inorganic biochemistry, 2009, 103(7): 1005-1013.
[42] FANALI G, CAO Y, ASCENZI P, et al. Mn(II) binding to human serum albumin: A 1H-NMR relaxometric study[J]. Journal of inorganic biochemistry, 2012, 117: 198-203.
[43] PAN J, YE Z, CAI X, et al. Biophysical study on the interaction of ceftriaxone sodium with bovine serum albumin using spectroscopic methods[J]. Journal of biochemical & molecular toxicology, 2012, 26(12): 487-492.
[44] EARL R S. Protein oxidation and aging[J]. Free radical research, 2007, 40(12): 1250-1258.
[45] MOSSBERG N, ANDERSEN O, NILSSON S, et al. Oxygen radical production and severity of the Guillain- Barré syndrome[J]. Journal of neuroimmunology, 2007, 192(1-2): 186-191.
[46] HAMANAKA R B, CHANDEL N S. Mitochondrial reactive oxygen species regulate cellular signaling and dictate biological outcomes[J]. Trends in biochemical sciences, 2010, 35(9): 505-513.
[47] 赵保路. 氧自由基和天然抗氧化剂[M]. 北京: 科学出版社, 1999. ZHAO Bao-lu. Oxygen free radicals and natural antioxidants[M]. Beijing: Science Press, 1999.
[48] BEDARD K, KRAUSE K H. The NOX family of ROS- generating NADPH oxidases: physiology and pathophysiology[J]. Physiological reviews, 2007, 87(1): 245-313.
[49] DAVIES M J. The oxidative environment and protein damage[J]. Biochimica et biophysica acta, 2005, 1703(2): 93-109.
[50] GARRISON W M. Reaction mechanisms in the radiolysis of peptides, polypeptides, and proteins[J]. Cheminform, 1987, 87(2): 381-398.
[51] DAVIES M J. Protein and peptide alkoxyl radicals can give rise to C-terminal decarboxylation and backbone cleavage[J]. Archives of biochemistry & biophysics, 1996, 336(1): 163-172.
[52] 邓乔元. 铜掺杂薄膜在白蛋白溶液中促进摩擦界面形成类石墨碳润滑层的研究[D]. 成都: 西南交通大学, 2019. DENG Qiao-yuan. Formation of graphite-like carbon layer between the friction interface of Cu doped film in bovine serum albumin solution[D]. Chengdu: Southwest Jiaotong University, 2019.
Adsorption, Denaturation and Decomposition of Proteins in Friction Interface for Artificial Hip Joint and Molecular Mechanism of Formation of Graphite-like Carbon Lubrication Layer
1,1,1,1,1,1,2
(1.School of Materials Science and Engineering, Southwest Jiaotong University, Chengdu 610031, China; 2.School of Materials Science and Engineering, Hainan University, Haikou 570228, China)
Artificial joint replacement is considered to be the most effective and ultimate treatment for joint diseases such as advanced arthritis and joint dysfunction. The in vivo service environment characteristics of artificial hip joint, and the formation of biofilm and graphite-like carbon lubrication layer in friction interface were introduced firstly. The denaturation and degradation of proteins at the friction interface catalyzed by transition metal copper under the simulated in vivo service environment were further discussed and the transformation from biofilm to graphite-like carbon lubrication layer was also investigated. The molecular mechanism of transition metal ions producing reactive oxygen species, catalyzing the adsorption, denaturation and decomposition of proteins and forming biofilm, graphite-like carbon lubrication layer was studied, and the design of ceramic artificial joint material was prospected.
artificial joint; frictional interface; biofilm; graphite-like carbon lubrication layer; transition metal; reactive oxygen species
2020-06-12;
2020-06-18
JING Pei-pei (1995—), Female, Doctor, Research focus: surface engineering.
冷永祥(1972—),男,博士,教授,主要研究方向为离子束表面改性。邮箱:yxleng@263.net
Corresponding author:LENG Yong-xiang (1972—), Male, Doctor, Professor, Research focus: ion beam surface modification. E-mail: yxleng@ 263.net
通讯作者:邓乔元(1991—),男,博士,讲师,主要研究方向为表面工程。邮箱:qydeng@hainanu.edu.cn
Corresponding author: DENG Qiao-yuan (1991—), Male, Doctor, Lecturer, Research focus: surface engineering. E-mail: qydeng@hainanu. edu.cn
经佩佩, 张悦, 罗潇雨, 等. 人工髋关节摩擦界面蛋白质吸附变性分解行为及类石墨碳润滑层形成的分子机制[J]. 表面技术, 2020, 49(6): 52-59.
R318.08
A
1001-3660(2020)06-0052-08
10.16490/j.cnki.issn.1001-3660.2020.06.006
2020-06-12;
2020-06-18
国家自然科学基金(31570958)
Fund:Supported by the National Natural Science Foundation of China (31570958)
经佩佩(1995—),女,博士,主要研究方向为表面工程。
JING Pei-pei, ZHANG Yue, LUO Xiao-yu, et al. Adsorption, denaturation and decomposition of proteins in friction interface for artificial hip joint and molecular mechanism of formation of graphite-like carbon lubrication layer[J]. Surface technology, 2020, 49(6): 52-59.
