菠菜非生物胁迫下实时荧光定量PCR分析中内参基因的选择
2020-06-29张海洋付娆李茹霞顾寅钰梁晓艳邢延富李萌宋延静王向誉郭洪恩
张海洋 付娆 李茹霞 顾寅钰 梁晓艳 邢延富 李萌 宋延静 王向誉 郭洪恩


摘要:为筛选适宜菠菜不同胁迫下基因表达水平分析的内参基因,本研究选取ACT11、ACT2/7、G6PD、ELF1B、UBC2、TUB、TUA和CYP2共8个常用内参基因作为候选内参基因,利用实时荧光定量PCR技术,通过geNorm、NormFinder、BestKeeper软件分析和评价其在不同胁迫下菠菜幼苗中的表达稳定性。结果表明,8个候选内参基因在不同胁迫处理下菠菜幼苗中的表达丰度及稳定性存在差异,NaCl和高温胁迫下G6PD表达稳定性最好,PEG胁迫下ELF1B表达稳定性最好。本研究结果可为菠菜非生物胁迫下相关基因的功能分析和基因差异表达研究提供有效的校正工具。
关键词:菠菜;实时荧光定量PCR;非生物胁迫;内参基因
中图分类号:S636.1文献标识号:A文章编号:1001-4942(2020)05-0021-05
Abstract In order to select appropriate reference genes for accurate analysis of expression level of target genes in spinach, eight commonly used internal genes (ACT11, ACT2/7, G6PD, ELF1B, UBC2, TUB, TUA and CYP2) were selected as candidates to analyze and evaluate their expression stability in spinach under different stresses through geNorm, NormFinder, BestKeeper, and real-time fluorescent quantitative PCR technology. The results showed that the expression abundance and stability of the 8 candidate internal reference genes were different under different stress treatments. The expression stability of G6PD was the best under NaCl stress and high temperature stress. The expression stability of ELF1B was the best under PEG stress. The results could provide effective correction tools for the functional analysis of related genes under abiotic stresses and the study of gene differential expression in spinach.
Keywords Spinach; Real-time fluorescent quantitative PCR; Abiotic stresses; Reference gene
菠菜(Spinacia oleracea L.) 屬藜科菠菜属,为常见绿叶蔬菜,是一种经济价值和营养价值较高的一年生草本植物[1,2]。它是维生素和矿物质的重要来源,富含类胡萝卜素、维生素C、维生素K、叶酸、铁和钙等,常用于制作沙拉、熟食等。目前,菠菜研究主要集中在栽培技术、营养价值、加工开发等方面,但随着菠菜基因组测序的成功[2]和生物技术的发展,其功能基因的克隆表达及基因组学等研究也日益广泛,其中利用分子生物学技术阐明菠菜相关基因的表达调控机理将成为研究重点。
基因表达量检测是进行相关基因功能研究的前提,内参基因作为检测基因表达量变化的参照,对其进行筛选研究具有重要意义。内参基因通常为管家基因,在各细胞和组织中的表达水平相对稳定,试验中需要利用内参基因对目标基因表达水平检测进行校正,而其稳定性对RT-qPCR结果的准确性具有决定性影响[3,4]。理想的内参基因应稳定表达于不同组织和细胞中,且表达量不受内源性或外源性因素的影响。一些维持正常生命代谢所必需的持家基因,比如18S rRNA、组蛋白(Histone)基因、3-磷酸甘油醛脱氢酶基因(GAPDH)、肌动蛋白基因(Actin)等常被用作内参[5]。越来越多研究表明,不同的植物组织和试验处理中,这类基因的表达量并不恒定。因此,在RT-qPCR分析中有必要对候选内参基因的表达稳定性进行评价,并选出适合的内参基因[6]。相关研究者基于RT-qPCR分析中基因表达的CT值,开发了一系列专门用于分析内参基因稳定性的程序,目前应用最多的有geNorm、NormFinder和BestKeeper[7-9]。这3款软件的工作原理各不相同,因此常常将三者配合起来用于评估候选基因的稳定性。本试验选取ACT11、ACT2/7、G6PD、ELF1B、UBC2、TUB、TUA、CYP2作为候选内参基因,利用实时荧光定量PCR技术并通过geNorm、NormFinder、BestKeeper软件分析和评价该类基因在不同条件下菠菜中的表达稳定性,以期筛选出相对适宜的内参基因。
1 材料与方法
1.1 试验材料
供试菠菜品种为课题组保存的山东小叶菠菜。播种于山东省蚕业研究所植物光照培养箱中,待幼苗长至四叶一心时,分别置于正常条件及NaCl、高温、PEG条件下进行处理,重复3次。选取处理后0、3、6、12 h苗期嫩株为样品,经液氮速冻后,置-80℃保存备用。
1.2 总RNA提取与cDNA合成
采用Trizol法[10]提取总RNA。具体操作步骤:向处理过的1.5 mL离心管中加入1 mL Trizol,取菠菜组织在液氮中迅速研磨成粉末,加入上述离心管中(植物组织粉末的体积和Trizol的体积是1∶2),漩涡振荡混匀,静置5 min;向离心管中加入氯仿200 μL,漩涡振荡混匀15 s,静置2~3 min后,12 000 r/min、4℃离心15 min;将上清移入去RNase的离心管中,约500 μL;管中加入等体积异丙醇,轻轻混匀,静置10 min后,12 000 r/min、4℃离心10 min;倒掉上清,向沉淀中加入75%乙醇1 mL,将沉淀轻轻打起,7 500 r/min、4℃离心5 min;倒掉上清,将离心管置于干净工作台上晾5~10 min;加入100 μL去RNase的ddH2O,轻轻振荡使沉淀溶解,-80℃保存。采用0.8%琼脂糖凝胶电泳和Nanodrop 2000检测RNA质量以确保总RNA的完整性和浓度。
参照TaKaRa PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)反转录试剂盒说明书进行cDNA第一链合成,置于-20℃保存备用。
1.3 引物设计和RT-qPCR分析
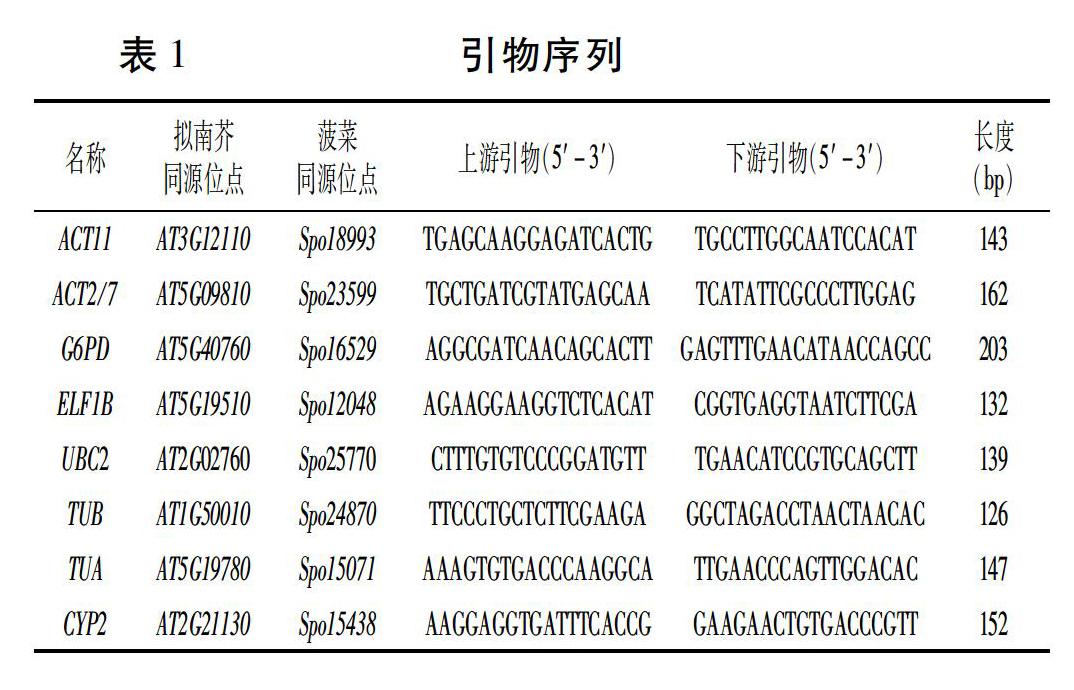
根据荧光定量PCR引物设计原则,利用Primer Premier 6对8个候选内参基因进行引物设计,委托北京六合华大基因科技有限公司合成。引物序列见表1。
RT-qPCR扩增选用荧光定量专用试剂盒TranStart Top Green qPCR SuperMix(+DyeⅡ)(北京全式金生物技术有限公司)。反应体系(20 μL):qPCR SuperMix(2×)10 μL,10 μmol/L上、下游引物各1 μL,cDNA 1μL,ddH2O 7μL。反应程序:95℃预变性30 s;95℃变性5 s,60℃退火30 s,44个循环;扩增完全后温度从65℃缓慢上升至95℃进行熔解曲线绘制,上升速度为每0.05 s上升0.5℃。
1.4 数据分析
采用Microsoft Excel 2013软件进行数据统计,内参稳定性评价软件geNorm、NormFinder和BestKeeper进行数据分析。
2 结果与分析
2.1 候选内参基因特异性扩增分析
以菠菜幼苗总RNA反转录得到的cDNA为模板,利用RT-qPCR扩增各候选内参基因片段,琼脂糖凝胶电泳结果(图1)显示,在100~250 bp之间均存在较亮的特异性条带,与预期片段大小一致。说明扩增反应具有较高的专一性,可用于荧光定量PCR分析。
2.2 内参基因引物熔解曲线分析
以菠菜cDNA 为模板,8个候选内参基因经RT-qPCR扩增后的熔解曲线如图2所示,可知,8个候选内参基因引物特异性良好,均为单峰,样品间扩增曲线重复性强。
2.3 候选内参基因的表达稳定性分析
2.3.1 geNorm软件分析利用geNorm 软件计算8 个候选内参基因在不同胁迫条件下的表达稳定值(M),M值越小基因表达越稳定。分析结果(表2)显示,菠菜NaCl胁迫处理下不同内参基因的M 值排序为G6PD 2.3.2 NormFinder软件分析 利用NormFinder软件计算8 个候选内参基因在不同胁迫条件下的表达稳定值(S),S值越小基因表达越稳定。由表3可以看出,NaCl胁迫条件下8个候选内参基因S值排序为G6PD 2.3.3 BestKeeper软件分析 BestKeeper 软件直接利用CT 值进行数据分析, R值趋近于1, SD值越小,说明该基因稳定性越好。由表4可以看出, NaCl和高温胁迫下G6PD的R值趋近于1,相关性好,且 SD 值最小,说明该类下G6PD适合作为内参基因;NaCl胁迫处理条件下TUB 的SD 值最高,且大于1,稳定性最差,不适合作为内参基因;PEG胁迫下,ELF1B R值最高,SD值较低,说明其相关性和稳定性最好,适合作为内参基因。该分析结果与geNorm 和NormFinder软件的结果一致。 综合上述3个软件的分析结果,NaCl和高温胁迫下G6PD表达稳定性最好,PEG胁迫下ELF1B表达稳定性最好。 3 討论与结论 近年来,随着高通量测序及转录组学分析的快速发展,实时定量PCR已经成为基因表达水平变化研究的重要技术手段。叶新如等[11]认为内参基因稳定性的筛选与分析,是保证重要功能基因表达分析结果准确性的重要前提[11]。因此,选择合适的内参基因就成为基因表达定量分析中需要考虑的首要问题。研究表明,最适候选内参基因在不同物种、组织和处理条件下的表达水平存在差异[12-15]。谭枝群[12]通过分析狗牙根叶片和根系在盐、干旱、低温和高温胁迫下候选内参基因的表达发现,各基因表达量在不同组织中或胁迫条件下均存在差异。Wang等[13]证实盐胁迫下,胡杨中稳定表达的内参基因TUB在相同胁迫条件下的菠菜中表达稳定性较差。吴林军[14]发现盐胁迫下,毛竹不同叶片中eIF-4α是表达最稳定的基因,不同组织中eIF-4α或TIP41则是最适合的内参基因。张佳佳等[15]发现低温条件下,香樟CcACTc基因的表达相对稳定,而在干旱、高盐、ABA条件下,CcEF1α基因的表达较稳定。低温胁迫下,Actin 基因在豆科属植物柠条锦鸡儿[16]中表达较为稳定,但在茄科植物马铃薯[17]中表达稳定性最差。干旱胁迫下,柳枝稷[18]和油菜[19]中Actin 基因的表达稳定性相差较大。ABA胁迫下,水芹[20]和柠条锦鸡儿[16]中EF1α 基因表达稳定性较高,但在短柄草[21]中的表达较不稳定。本试验结果发现,传统的稳定内参基因ACT在菠菜不同胁迫下表达稳定性不高。这与前人在其它物种上的研究结果类似[12-21]。因此,不同物种和胁迫条件下,ACT不是最稳定表达的内参基因。 为了减少内参基因选择的误差,本研究采用RT-qPCR技术结合分子生物学软件geNorm、NormFinder和BestKeeper对候选内参基因在不同胁迫条件下菠菜中的稳定性进行分析,发现不同胁迫条件下的8个候选内参基因在不同时段均有表达,但表达量存在差异,其中G6PD在NaCl和高温胁迫下的表达稳定性最好,而ELF1B在PEG胁迫处理下的表达稳定性最好。本研究结果可为菠菜实时荧光定量PCR内参基因的选择提供参考,并为菠菜功能基因的表达分析奠定理论基础。 参 考 文 献: [1] Dohm J C, Minoche A E, Holtgrwe D, et al. The genome of the recently domesticated crop plant sugar beet (Beta vulgaris)[J]. Nature, 2014, 505: 546-549. [2] Xu C, Jiao C, Sun H, et al. Draft genome of spinach and transcriptome diversity of 120 Spinacia accessions[J]. Nat. Commun., 2017, 8: 15275. [3] Bustin S A. Quantification of mRNA using real-time reverse transcription PCR (RT-qPCR): trends and problems[J]. Molecular Endocrinology, 2002, 29(1): 23-29. [4] Huggett J, Dheda K, Bustin S, et al. Real-time RT-PCR normalisation:strategies and considerations[J]. Genes and Immunity, 2005, 6(4): 279-284. [5] Dheda K, Huggett J F, Bustin S A, et al. Validation of housekeeping genes for normalizing RNA expression in real -time PCR[J]. BioTechniques, 2004, 37(1): 112-119. [6] Thellin O, Zorzi W, Lakaye B, et al. Housekeeping genes as internal standards: use and limits[J]. Journal of Biotechnology, 1999, 75: 291-295. [7] Vandesompele J, De Preter K, Pattyn F, et al. Accurate normalization of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes[J]. Genome Biology, 2002, 3(7): 1-12. [8] Andersen C L, Jensen J L, ntoft T F. Normalization of real-time quantitative reverse transcription-PCR data: a model -based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets[J].Cancer Res., 2004, 64: 5245-5250. [9] Pfaffl M W, Tichopad A, Prgomet C, et al. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: BestKeeper-Excel-based tool using pair-wise correlations[J]. Biotechnology Letters, 2004, 26: 509-515. [10]楊宇虹,梁东春,郭刚,等. 改进TRIZOL法提取基因组DNA[J]. 医学分子生物学杂志,2006,3(2): 105-107. [11]叶新如, 朱海生, 林珲, 等. 冬瓜实时荧光定量PCR内参基因的筛选与评价[J]. 核农学报, 2019, 33(3):59-67. [12]谭枝群. 非生物胁迫下暖季型草坪草内参基因筛选及铁离子调控耐盐性的机制研究[D]. 南京:南京农业大学, 2015. [13]Wang C, Fang J. RLM-RACE, PPM-RACE, and qRT-PCR: an integrated strategy to accurately validate miRNA target genes[J]. Small Non-Coding RNAs, 2015,1296: 175-186. [14]吴林军. 非生物胁迫下毛竹qRT-PCR分析中内参基因的选择[D]. 杭州:浙江农林大学, 2018 . [15]张佳佳, 张力维, 李勇鹏, 等. 不同非生物胁迫下香樟实时定量PCR内参基因的选择[J]. 生物技术通报, 2016, 32(10): 205-211. [16]Yang Q, Yin J, Li G, et al. Reference gene selection for qRT-PCR in Caragana korshinskii Kom. under different stress conditions[J]. Molecular Biology Reports, 2014, 41: 2325-2334. [17]Lopez-Pardo R, De Galarreta J I, Ritter E. Selection of housekeeping genes for qRT-PCR analysis in potato tubers under cold stress[J]. Molecular Breeding, 2013, 31: 39-45. [18]Huang L, Yan H, Jiang X, et al. Evaluation of candidate reference genes for normalization of quantitative RT-PCR in switchgrass under various abiotic stress conditions[J]. BioEnergy Research, 2014, 7:1201-1211. [19]Wang Z, Chen Y, Fang H D, et al. Selection of reference genes for quantitative reverse-transcription polymerase chain reaction normalization in Brassica napus under various stress conditions[J]. Molecular Genetics and Genomics, 2014, 289:1023-1035. [20]Qian J, Feng W, Li M Y, et al. Selection of suitable reference genes for qPCR normalization under abiotic stresses in Oenanthe javanica (BI.) DC[J]. PLoS ONE, 2014, 9(3):e92262. [21]Hong S Y, Seo P J, Yang M S, et al. Exploring valid reference genes for gene expression studies in Brachypodium distachyon by real-time PCR[J]. BMC Plant Biology, 2008, 8:112.
