IRF8基因降表达、PINK1基因过表达对肺泡巨噬细胞NR8383增殖与活性的影响
2020-06-29李东航范涛张霖江文洋汪巍耿庆
李东航,范涛,张霖,江文洋,汪巍,耿庆
武汉大学人民医院,武汉430060
作为体内重要的吞噬和抗原提呈细胞,肺泡巨噬细胞在维持肺部免疫稳态及宿主防御中发挥重要作用,并参与了急性肺损伤(ALI)在内的多种肺部疾病的发病过程[1]。干扰素调节因子8(IRF8)是一种主要表达于免疫细胞的IFN-γ诱导型核转录因子,在调控转录及调节宿主免疫、细胞因子信号转导、细胞生长及分化等生物学过程中发挥重要作用[2]。除了调节淋巴细胞、髓细胞、树突状细胞的增殖分化外,IRF8还可以刺激巨噬细胞分化,抑制粒细胞分化,同时抑制细胞增殖,正向调节凋亡[3,4]。已有研究表明,IRF8是巨噬细胞中的主要自噬调节剂,可以直接激活许多涉及自噬各步骤的基因,从而促进自噬体形成和溶酶体融合,对巨噬细胞的成熟、活性和先天免疫反应至关重要[5]。PTEN诱导激酶1(PINK1)基因可以编码具有丝氨酸-苏氨酸激酶活性的蛋白质,其N末端为线粒体靶向序列,主要在线粒体中发挥作用[6]。作为线粒体自噬经典途径,PINK1/Prakin信号通路介导的线粒体自噬参与多种原因导致的肺损伤过程[7,8]。2019年1~8月,我们观察了shRNA编码干扰IRF8基因、巨细胞病毒介导PINK1基因过表达及二者共同作用后肺泡巨噬细胞NR8383增殖能力及活性变化,探讨IRF8是否通过调控巨噬细胞中PINK1相关线粒体自噬对缺血再灌注肺损伤产生影响。
1 材料与方法
1.1 主要材料与试剂 IRF8基因降表达质粒pG2.2-IRF8-Rat-444、PINK1过表达质粒pCMV3-Rat-PINK1、IRF8干扰空质粒、PINK1过表达空质粒均由实验室构建,并经测序鉴定;小鼠肺泡巨噬细胞NR8383,F12K培养基、血清、0.25% Trypsin、opti-MEM(Gibco公司);LipofectamineTM2000(Invitrogen公司);兔多抗PINK1(Abclonal公司),兔多抗IRF8(Thermop公司),兔多抗GAPDH(杭州贤至生物有限公司);BCA试剂盒和RIPA裂解液(碧云天生物科技公司);PVDF膜(Millipore公司);CCK8细胞增殖及细胞毒性检测试剂盒(Beyotime公司);乳酸脱氢酶(LDH)测试试剂盒(南京建成生物工程研究所);其他试剂均为进口或国产分析纯。
1.2 实验方法
1.2.1 细胞培养与转染 解冻NR8383细胞并培养至细胞融合度达80%,对细胞进行传代培养;将对数生长期的细胞制成单细胞悬液,按5×105/孔接种6孔板,于37 ℃、5% CO2、饱和湿度培养至细胞融合度达60%。取对数生长期的NR8383细胞,随机分为7组。IRF8对照组、PINK1对照组分别转染IRF8干扰空质粒、PINK1过表达空质粒,联合对照组共转染用量减半的上述两种质粒;IRF8干扰组、PINK1过表达组分别转染IRF8干扰质粒pG2.2-IRF8-Rat-444、PINK1过表达质粒pCMV3-Rat-PINK1,联合干扰组共转染上述两种质粒;正常对照组不做任何处理。转染前2 h,换成无血清相应培养基;用100 μL无血清opti-MEM稀释6 μg质粒(两种质粒共转时,每种质粒用量减半),取12 μL混匀的LipofectamineTM2000稀释在100 μL opti-MEM中;每个培养孔加转染复合物混合液200 μL,将细胞于37 ℃ CO2培养箱中培养;4 h后吸出混合液换入正常培养基,于37 ℃、5% CO2、饱和湿度下培养48 h;荧光显微镜观察各孔中绿色荧光蛋白表达情况,可见到NR8383细胞中大量表达,表明转染成功。
1.2.2 细胞增殖能力观察 采用CCK8法。收集各组细胞以胰酶消化,用相应培养基制成5×104/mL的单细胞悬液。以100 μL/孔将细胞接种96孔板,同时设置空白对照孔;周围孔加入100 μL PBS,于37 ℃、5% CO2、饱和湿度下培养过夜。每孔加入10 μL CCK8,37 ℃培养4 h,振荡10 min,用酶标仪测定各孔波长在450 nm时的光密度值(OD450),计算各组细胞增殖率。细胞增殖率=(实验孔OD450-空白孔OD450)/对照孔OD450×100%。
1.2.3 细胞活性观察 采用LDH法。取各组细胞上清,加入LDH测试试剂盒中;根据使用说明书混匀,室温放置5 min;酶标仪测定波长450 nm处各孔OD值,计算LDH活性;以LDH活性表示细胞活性,值越高则细胞活性越弱。LDH活性(U/L)=(测定孔OD值-对照孔OD值)/(标准孔OD值-空白孔OD值)×0.2×1 000×样本稀释倍数。
1.2.4 细胞中IRF8、PINK1蛋白表达检测 采用Western blotting法。取各组对数生长期细胞,提取细胞总蛋白,经BCA试剂盒测得总蛋白浓度;裂解液中加入蛋白上样缓冲溶液,沸水浴 10 min变性;配置蛋白电泳凝胶,进行10% SDS-PAGE。用湿转法将凝胶上的蛋白转移到PVDF膜上,电转结束后用含5%脱脂奶粉的TBST溶液封闭2 h;4 ℃孵育一抗(GAPDH、PINK1、IRF8)过夜,TBST漂洗5 min×5次;室温孵育二抗2 h,TBST漂洗5 min×6次;加入ECL试剂,扫描胶片;用BandScan分析胶片灰度值,以目的蛋白与内参GAPDH灰度值比值表示目的蛋白相对表达量。

2 结果
2.1 各组细胞增殖与细胞活性比较 见表1。
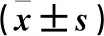
表1 各组细胞增殖与细胞活性比较
注:与联合对照组、PINK1对照组、IRF8对照组、正常对照组比较,*P<0.05;与PINK1过表达组、IRF8干扰组比较,#P<0.05。
2.2 各组IRF8、PINK1蛋白表达比较 见表2。
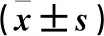
表2 各组PINK1、IRF8蛋白表达比较
注:与联合对照组、PINK1对照组、IRF8对照组、正常对照组比较,*P<0.05;与PINK1过表达组、IRF8干扰组比较,#P<0.05。
3 讨论
PINK1/Parkin相关线粒体自噬是PINK1通过其N-末端线粒体信号序列在功能失调的线粒体外膜募集,发生自磷酸化并磷酸化泛素和Parkin,选择性清除损伤、衰老线粒体的过程,对于维持线粒体的能量供应及细胞内环境稳态发挥着重要作用[9]。在ALI引起的炎症反应中,不同病理阶段的微环境下,肺泡巨噬细胞作为前哨发挥着促炎和抗炎的双重作用,被认为是ALI/急性呼吸窘迫综合征(ARDS)发病机制的关键因素之一[1]。由此,调节肺泡巨噬细胞的功能,可能是治疗包含ALI/ARDS在内的肺损伤最具前景的治疗策略[1,5,10]。缺血再灌注肺损伤是导致线粒体受损的关键因素[11],因此引发肺泡巨噬细胞生存及稳定的PINK1相关线粒体自噬就尤为重要[12~15]。基于IRF8是驱动巨噬细胞分化的重要转录因子,且为巨噬细胞自噬的主要调节剂之一。我们推测,IRF8在发生缺血再灌注肺损伤的肺泡巨噬细胞PINK1/Prakin相关线粒体自噬中发挥着调控作用。
本研究结果显示,PINK1过表达组、IRF8干扰组肺泡巨噬细胞增殖及细胞活性受到显著抑制,且联合干扰组增殖能力及细胞活性的抑制作用更明显;与PINK1过表达组、IRF8干扰组比较,联合干扰组细胞活性抑制效应差异有统计学意义,但对细胞增殖能力抑制作用差异无统计学意义。这表明干扰IRF8基因、诱导PINK1基因过表达,在抑制肺泡巨噬细胞的增殖及活性方面具有协同作用。此外,与联合对照组、PINK1对照组、IRF8对照组、正常对照组比较,IRF8干扰组PINK1蛋白表达增加、PINK1过表达组IRF8蛋白表达下降,且差异均有统计学意义;与PINK1过表达组、IRF8干扰组比较,联合干扰组PINK1蛋白表达增加、IRF8蛋白表达下降程度更明显,差异均有统计学意义。这表明干扰IRF8蛋白可以促进PINK1蛋白的表达,干扰IRF8基因对PINK1基因的转录具有正向调控作用。
IRF8对巨噬细胞的作用体现在调节其发育和免疫功能相关基因来介导巨噬细胞参与的炎症反应,以及自身结合PU.1形成复合物与其他转录因子作用执行其吞噬功能,抑制IRF8基因表达会明显降低巨噬细胞的数量[5]。Gupta等[5]发现,在敲除了巨噬细胞的IRF8基因后,多数自噬基因下调、少数上调,泛素结合蛋白过度积聚,巨噬细胞的自噬活性下降,自噬体难以成熟为溶酶体;在转入野生型小鼠的IRF8基因后,巨噬细胞内部分自噬基因恢复了表达,但转入IRF8K79E突变基因并不能恢复自噬基因的表达。本研究结果发现,干扰IRF8基因表达,肺泡巨噬细胞数量明显下降,增殖能力与细胞活性均降低。
PINK1基因在维持线粒体形态和功能方面有重要作用[16,17],PINK1基因的损伤缺失将导致线粒体形态发生改变,并可影响细胞内线粒体复合体的活性,引起线粒体的多种功能障碍,最终导致细胞凋亡[18]。在PINK1缺陷细胞中,自噬体的形成速率明显高于PINK1未缺陷细胞;而恢复PINK1表达会抑制线粒体自噬,PINK1过表达则抑制毒素诱导的线粒体自噬[19]。本研究结果表明,PINK1基因过表达后,肺泡巨噬细胞活性与细胞增殖均被抑制,细胞内的线粒体自噬可能相应受到抑制;过表达的PINK1基因可能负向反馈调节IRF8基因的转录,表现为IRF8蛋白表达降低。
巨噬细胞的吞噬作用在先天性免疫中发挥着重要作用,参与了从抗原识别到加工、运输呈递以及最终吞噬杀灭等过程,在此过程中伴随着大量能量的消耗,通常都由线粒体负责能量的供应[20]。线粒体被证实参与先天性免疫调控,线粒体抗病毒信号蛋白(MAVS)锚定于线粒体,是RIG-Ⅰ样受体信号传导中的关键接头蛋白[21],线粒体DNA在细胞经历非正常死亡(例如病理学损伤)后释放并激活一系列先天性免疫通路[22]。根据本研究我们推测,干扰IRF8基因表达,可以抑制巨噬细胞增殖与细胞活性,同时上调PINK1基因表达,增加了这种抑制效应;另外,PINK1基因过表达负向调节IRF8蛋白产生,可能与减轻线粒体DNA损伤有关,二者协同抑制肺泡巨噬细胞内线粒体自噬的发生。本研究可为肺缺血再灌注损伤的治疗提供新思路。但是,受IRF8调控的自噬基因分布范围很广,从最初的自噬体激活到捕获靶标的最终溶酶体降解,基本上涵盖了整个自噬途径[5],而PINK1/Parkin相关线粒体自噬也非线粒体自噬的惟一途径[23,24]。因此,IRF8与线粒体自噬基因之间的调控机制仍需分子通路水平的严谨实验设计来研究证实。
