甘蓝原生质体制备体系优化及瞬时转化体系的建立
2020-06-29钟雄辉陈登辉李海龙康俊根颉建明
王 飞,钟雄辉,陈登辉,李海龙,康俊根,颉建明
(1.甘肃农业大学 园艺学院,甘肃 兰州 730070;2.北京市农林科学院 蔬菜研究中心,农业农村部华北地区园艺作物生物学与种质创制重点实验室,北京 100097)
植物原生质体是指植物细胞通过酶解法、机械法等手段去除细胞壁,形成由单层细胞膜包裹的细胞质[1]。去除了细胞壁的植物原生质体,不仅保持着细胞全能性,而且容易接受外源遗传物质,使外源DNA在原生质体中快速表达[2]。因此,原生质体被广泛用于遗传转化、细胞融合及细胞无性系和突变体的选育[3]。
植物原生质体瞬时表达系统是一种快速、高通量、转化简单的分析系统,被广泛应用于基因瞬时表达、蛋白质的亚细胞定位、蛋白质互作和蛋白质活性等研究[4],目前已有多种转化方法,如PEG介导的原生质体转化,基因枪轰击法和农杆菌介导法[5]。但是,目前原生质体的遗传转化主要集中在拟南芥、水稻和烟草等模式植物[6]。原生质体的分离和纯化不仅对植物瞬时表达体系的建立起着决定性的作用,同时也是原生质体融合以及植物体再生研究的基础,原生质体的分离方法主要有机械法、化学法和酶解法等。其中,酶解法是应用最广泛、最快速且高效的原生质体分离方法[7]。分离和纯化大量有活力的植物原生质体易受到多种因素的影响,如酶种类及浓度、酶解时间、渗透压浓度以及外植体类型等[8]。近年来,关于植物原生质体分离与转化的研究越来越多,其中烟草、拟南芥、水稻的原生质体分离纯化体系已相对成熟。刘敏等[9]研究了烟草叶片原生质体制备及其在蛋白互作中的应用;梁芸等[10]分离纯化出大量优质拟南芥原生质体并将CPK10双元TAP载体在拟南芥原生质体中成功表达;钟英健等[11]利用分离出的大量水稻原生质体进行了OsVDAC2基因的瞬时表达和亚细胞定位。同时,原生质体在细胞融合和植株再生上的研究也有大量报道,孙振久等[12]研究了甘蓝和萝卜原生质体融合,梁丹等[13]研究了甘蓝和大白菜原生质体融合,李贵等[14]对结球甘蓝下胚轴原生质体进行培养并获得再生植株。此外,Murovec等[15]利用分离纯化的芜菁原生质体,验证CRISPR-Cas9系统中sgRNA靶向能力。
尽管甘蓝原生质体的分离及其细胞融合和植株再生上的应用研究已经有报道,但是甘蓝原生质体的转化体系等相关研究较少,本研究在前人研究的基础上,从甘蓝原生质体分离过程中酶解时间、甘露醇浓度、离心力大小和不同外植体因素着手,利用正交设计优化原生质体的分离条件,分析其对原生质体产量及活力的影响,并对甘蓝下胚轴、子叶、叶球分离的原生质体进行了瞬时转化试验,比较不同外植体分离获得的原生质体的转化效率,建立了甘蓝高效的原生质体制备和转化体系,同时利用该转化体系对载体CRISPR/Cas9基因编辑载体PBSE401-BoPDS的sgRNA靶向能力进行了检测,为甘蓝细胞融合、遗传转化、亚细胞定位、蛋白互作、基因编辑等研究提供技术平台。
1 材料和方法
1.1 试验材料
1.1.1 品种及载体 由北京市农林科学院蔬菜研究中心甘蓝课题提供甘蓝732品种和载体COX和969,载体pCBC-DT1T2和PBSE401由中国农业大学陈其军教授馈赠,以甘蓝叶球和培养13 d的无菌黄化苗的下胚轴、子叶为材料。
1.1.2 试剂 纤维素酶(Cellulase-R10)和离析酶(Macerozyme-R10)均为日本Yakult进口分装,甘露醇、牛血清蛋白(BSA)、二乙酸荧光素(FDA)、2-(N-吗啡啉)乙磺酸(MES)、B5、蔗糖、植物凝胶均为国产分析纯。
1.2 试验方法
1.2.1 无菌苗培养 先用流水将甘蓝种子冲洗10~20 min,然后将种子置于无菌50 mL离心管中并加入75%酒精消毒30 s,接着将种子放入8%次氯酸钠溶液中浸泡10 min,浸泡过程中不断摇晃,使种子表面得到充分消毒,再用无菌水冲洗4~6次,接种于种子萌发培养基(3.2 g/L B5+20 g/L蔗糖+4 g/L植物凝胶,pH值5.7),每个培养基接种20粒种子,组培室室温黑暗培养13 d。
1.2.2 正交设计 本试验在前人研究的基础上,选取裂解酶组合为1%纤维素酶和0.5%离析酶,将甘露醇浓度、酶解时间、离心速度、不同外植体作为正交试验考察的主要因素,以分离得到的原生质体数量和活力为考察指标,进行4因素3水平L9(34)正交试验(表1)。

表1 正交试验设计Tab.1 Orthogonal design of the test
1.2.3 原生质体制备 将甘蓝叶球和无菌苗的子叶、下胚轴作为外植体,各称取15 g,切成约1~2 mm的小碎块,分别移入15 mL的酶解液中(1%纤维素酶+0.5%离析酶+甘露醇+10 mmol/L MES+1 mmol/L CaCl2+0.1% BSA+5 mmol/L β-巯基乙醇),在黑暗、26 ℃、60 r/min条件下进行振荡酶解,酶解结束后,用50 μm细胞筛过滤除去较大组织碎块,滤液转至10 mL圆底离心管,室温离心5 min收集原生质体,除去上清液。加入3 mL W5(154 mmol/L NaCl+125 mmol/L CaCl2+ 5 mmol/L KCl+5 mmol/L 葡萄糖+2 mmol/L MES)溶液清洗原生质体3次,离心弃上清,加入1 mL W5溶液重悬,即可获得纯化的原生质体。接着对原生质体活力和产量进行测定,原生质体活力测定参照张钟仁等[16]方法,用0.01%二乙酸荧光素(FDA)染色,在荧光显微镜上统计一个视野中发绿色荧光的原生质体数与原生质体总数的比值,计算出原生质体活力。原生质体的产量测定参照张金鹏等[17]方法,取少量原生质体悬浮液滴加在0.1 mm血球计数板上,在显微镜下观察和统计血球计数板大方格内的原生质体个数,然后按照以下公式计算出原生质体产量。原生质体产量(个/g FW)=计数板大方格内(0.1 mm3)的原生质体数×104×原生质体悬浮液总体积/制备原生质体所用材料鲜质量。
1.2.4 原生质体转化 将纯化后的100 μL原生质体冰浴10 min,然后加入1 μg PYBA 1132质粒中,再加入110 μL 20% PEG4000,混匀后室温黑暗放置10 min,后加入440 μL的W5溶液稀释转化混合液,然后轻柔上下颠倒离心管,使之混合均匀以终止转化反应。1 890 r/min离心3 min,去除上清,加入600 μL W5溶液,放置20 ℃恒温培养箱黑暗培养24 h。在激光共聚焦扫描显微镜下观察原生质体中GFP表达情况[18]。选取3个有代表性的视野进行统计,取平均值,按照以下公式计算转化率。原生质体转化效率=(激发光下发出绿色荧光的原生质体数/明场下所有原生质体数)×100%。
1.2.5 靶位点的选择 基于甘蓝八氢番茄红素脱氢酶基因BoPDS(Gene ID:Bo4g127210,Ensembl Genomes数据库)序列,在网站http://skl.scau.edu.cn/targetdesign/上选择甘蓝PDS基因特异靶点并设计引物。靶位点的GC含量不低于40%,为防止发生脱靶效应该尽量减少sgRNA与预测的脱靶位点序列的配对碱基数,同时预测的脱靶位点与设计的sgRNA在靠近PAM区保证至少有2个碱基不配对。最后,连续的或间隔的4个碱基配对不能出现在sgRNA与预测的脱靶位点序列中。
1.2.6 CRISPR/Cas9表达载体PBSE401-BoPDS的构建 以pCBC-DT1T2载体为模板,利用BoPDS-DT1-BsF、BoPDS-DT1-BsR、BoPDS-DT1-F0和BoPDS-DT1-R02对引物(表2)进行PCR扩增,回收PCR产物,将PCR产物与PBSE401载体按以下比例加入酶切连接体系(2 μL PCR产物、2 μL PBSE401载体、1.5 μL 10×NEB T4Buffer、1.5 μL 10×BSA、1 μLBsaⅠ、1 μL T4连接酶、6 μL ddH2O),37 ℃条件下反应5 h,50 ℃条件下反应5 min,80 ℃条件下反应10 min完成酶切连接。将连接产物导入大肠杆菌感受态Trans1-T1,涂布于含有卡那霉素的LB平板,37 ℃培养过夜,挑选阳性克隆,并用载体特异性引物U626-F和U629-R(表2)进行PCR验证,构建成具有双靶点的PBSE401-BoPDS载体。
2 结果与分析
2.1 最优组合的确定
以原生质体分离数量和活力为指标,进行正交分析得出极差,对各因素进行分析,计算结果如表3所示。根据正交试验结果与极差分析可知,各因素对原生质体分离的数量作用主次为:甘露醇浓度(R)>酶解时间(R)>离心速度(R)>不同外植体(R),各因素对原生质体活力作用主次为:甘露醇浓度(R′)>酶解时间(R′)>离心速度(R′)>不同外植体(R′),说明甘露醇浓度和酶解时间对原生质体数量和活力影响较大,离心速度和不同外植体对原生质体数量和活力影响较小。

表2 引物名称与序列Tab.2 The primer names and sequences
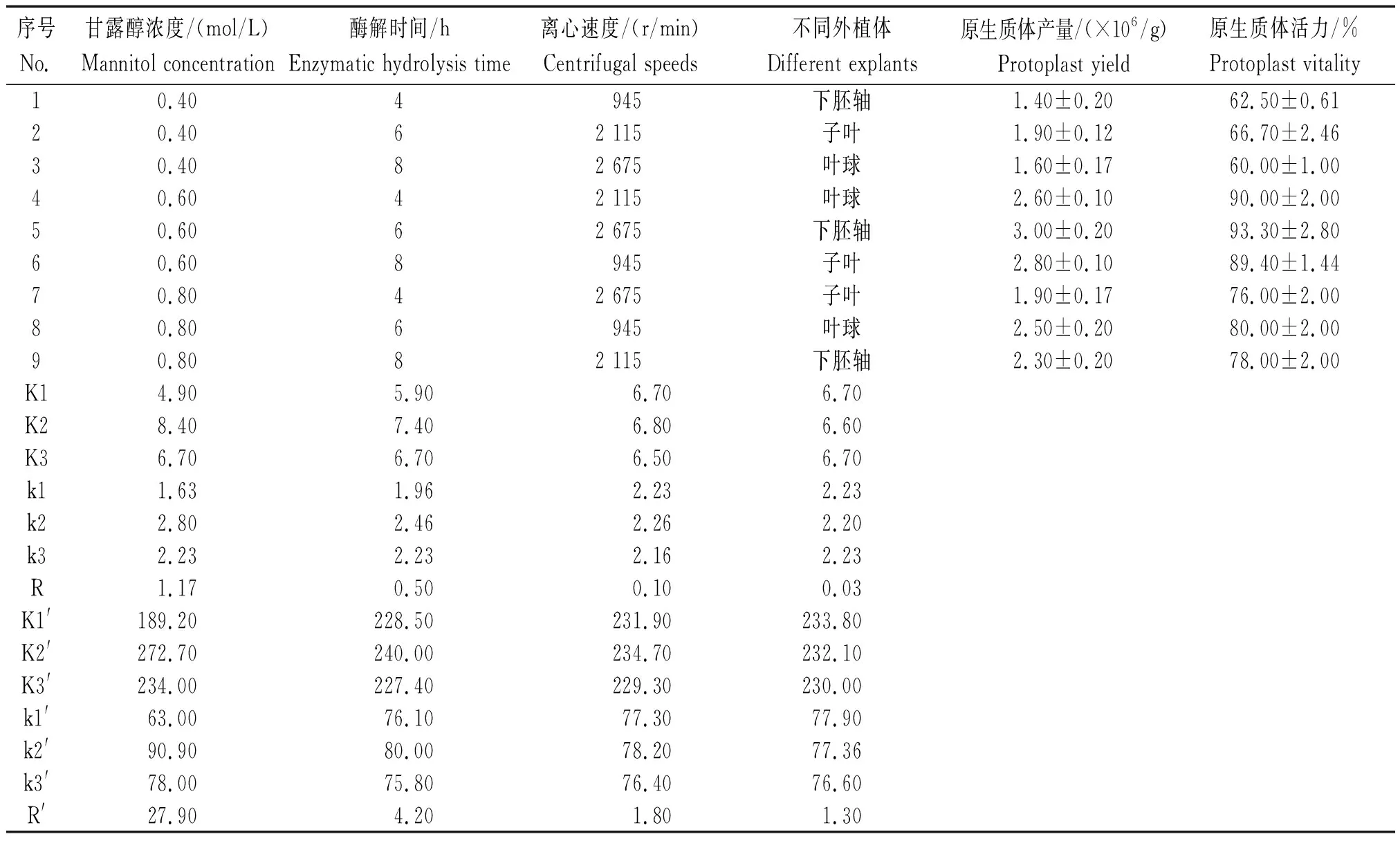
表3 正交试验结果与极差分析Tab.3 Orthogonal experimental results and range analysis
注:Ki为任意列的水平为i时对应的试验结果的和;ki为任意列水平为i时对应的试验结果的平均值;R.极差。
Note:Kiindicates sum of corresponding test results ofilevel; kiindicates average of corresponding test results ofilevel; R. Range.
进一步对各因素各水平间的处理结果进行LSD多重比较分析显示,甘露醇作为渗透压稳定剂,过高或过低均会对原生质体数量和活力产生影响,当甘露醇浓度达到0.6 mol/L时,分离得到的原生质体数量和活力均为最好,显著高于其他2组(图1);由图2所示,随着酶解时间的增加,分离得到的原生质体数量和活力也随之增加,酶解6 h后达到最佳,继续增加酶解时间(8 h),原生质体产量和活力均下降,表明过长的酶解时间对原生质体分离有一定负作用,会造成部分原生质体破裂。因此,在本试验中最佳的酶解时间是6 h(图2);通过对离心速度进行945,2 115,2 675 r/min的梯度设置,研究了离心速度对原生质体产量和活力的影响,结果表明,随着离心速度的增加,原生质体产量和活力均先增加后降低,在2 115 r/min时均达到最大值(图3);分别以甘蓝子叶、下胚轴和叶球为材料,分析了不同外植体对原生质体产量和活力的影响,由图4可知不同外植体分离获得的原生质体数量和活力均无显著差异,这与极差较小的结果一致,说明不同外植体对原生质体数量和活力影响较小,其中下胚轴分离获得的原生质体产量和活力均为最高,表明以下胚轴为材料进行原生质体制备效果最佳。综上所述,原生质体制备的最佳条件为:以甘蓝下胚轴为外植体,酶液组成为1%纤维素酶+0.5%离析酶+0.6 mol/L 甘露醇+10 mmol/L MES+1 mmol/L CaCl2+0.1% BSA+5 mmol/L β-巯基乙醇,26 ℃,60 r/min,黑暗酶解6 h后,用2 115 r/min离心5 min收集细胞。

图1 甘露醇各水平的产量和活力均值LSD比较Fig.1 LSD comparison of average yield and vitality at each mannitol level

图2 酶解时间各水平的产量和活力均值LSD比较Fig.2 LSD comparison of average yield and vitality at each time level
2.2 优化条件下原生质体制备

图3 离心速度各水平的产量和活力均值LSD比较Fig.3 LSD comparison of average yield and vitality at each centrifugal speed level

图4 外植体各水平的产量和活力均值LSD比较Fig.4 LSD comparison of average yield and vitality at each explant level
通过四因素三水平的正交试验设计,获得了影响原生质体制备的4个因素的最佳组合,因试验设计中没有最佳组合,故对试验结果进行验证,以甘蓝下胚轴为外植体,在含有0.6 mol/L甘露醇的酶解液中黑暗酶解6 h,以2 115 r/min的离心速度收集细胞,对分离获得的原生质体数量和活力进行统计(图5),结果显示在最优组合条件下获得的原生质体数量可达3.0×106个/g,活力约为90.9%。

图5 最佳条件下分离获得的原生质体形态和活力Fig.5 Protoplasts morphology and vitality under optimal conditions
2.3 甘蓝原生质体瞬时转化体系建立
研究分别以甘蓝下胚轴、子叶、叶球分离纯化的原生质体作为受体,以植物瞬时表达载体PYBA 1132质粒作为目标DNA,利用PEG介导法进行转化试验,研究了不同外植体对原生质体转化效率的影响。本试验结果显示下胚轴、子叶、叶球分离获得的部分原生质体,用PEG介导法转化后,在488 nm激发光下观察到GFP绿色荧光信号,且在细胞膜和细胞核上均有分布,甘蓝下胚轴分离获得的原生质体转化效率最高(43%,图6-A、B),甘蓝子叶分离获得的原生质体转化效率为35%(图6-C、D),甘蓝叶球分离获得的原生质体转化效率最低,仅为19%(图6-E、F)。同时以下胚轴分离获得的原生质体为受体,对细胞器特异定位载体进行了表达分析;分别转化线粒体特异表达载体COX和质体特异表达载体969,在激光共聚焦显微镜下都观察到GFP绿色荧光信号(图7),表明利用原生质体瞬时转化体系成功对载体COX和载体969进行了亚细胞定位。以上结果表明,成功建立了甘蓝原生质体瞬时转化体系。
2.4 靶位点的选择及载体构建

A,B.下胚轴原生质体GFP荧光和明场;C,D.子叶原生质体GFP荧光和明场;E,F.叶球原生质体GFP荧光和明场。A,B.GFP filter and bright field of protoplasts from hypocotyls; C,D.GFP filter and bright field of protoplasts from cotyledons; E, F.GFP filter and bright field of protoplasts from heads leaves.

A,C.GFP荧光;B,D.明场。A,C.GFP filter; B,D.Bright field.
根据甘蓝BoPDS基因序列,设计位于BoPDS第1个外显子和第2个外显子上具有PAM序列的2个靶位点(Target1:TAAGACAAGAACAAGGCGA和Target2:AGTGTGTGTGGACATACCA)(图8-A),GC含量分别为40%和45%。根据靶点序列合成接头引物BoPDS-DT1-BsF、BoPDS-DT1-F0、BoPDS-DT1-R0和BoPDS-DT1-BsR(表2),进行PCR扩增,回收产物构建到CRISPR/Cas9载体PBSE401上,使用引物U626-F和U629-R进行检测,连接成功的载体PCR扩增产物约728 bp,构建成双靶点载体PBSE401-BoPDS(图8-B)。
2.5 甘蓝原生质体瞬时转化检测BoPDS的突变
通过PEG介导的甘蓝原生质体转染进行CRISPR/Cas9基因编辑载体的瞬时表达验证。将构建好的包含打靶位点BoPDS的CRISPR/Cas9载体瞬时转化甘蓝原生质体,对载体PBSE401-BoPDS的靶向编辑能力进行检测,以提取出转染24 h后的原生质体基因组DNA为模板,以跨越靶位点的特异性引物如表2所示(BoPDSdetection primer-F/BoPDSdetection primer-R)进行PCR扩增,获得目的片段,连接T克隆载体,挑选24个阳性克隆进行测序,结果表明:被转化的原生质体基因组DNA存在基因编辑,编辑类型有碱基替换和碱基插入,靶点1的PAM序列后第7个碱基处发生替换,由T碱基变为G碱基(图9);靶点2附近有2种碱基插入类型,第1种是PAM序列前面有一个T碱基插入,第2种是PAM序列前面第3位和第6位出现了2个碱基插入(图9)。24个阳性克隆中3个发生编辑,编辑效率为12.5%,表明利用甘蓝原生质体瞬时转化体系,对甘蓝CRISPR/Cas9基因编辑进行了初步研究,为后期甘蓝基因编辑及新种质创制提供技术平台。

图8 靶位点选择(A)和pBSE401-BoPDST-DNA区域(B)示意图Fig.8 Schematic representation of BoPDS with target site (A) and the T-DNA region of the pBSE401-BoPDS vector (B)

加下划线的碱基代表插入的碱基或发生替换的碱基。The underline letters represent the inserted or substituted bases.
2.6 氨基酸序列分析
在获得的3个基因突变的样品序列中,进一步使用DNAMAN对这3个样品BoPDS编码的氨基酸序列进行预测分析,1号样品发生了1个碱基T的插入,使其在第36氨基酸突变为终止信号,翻译提前终止;2号样品发生了2个碱基G和A的插入,使其在第40位氨基酸突变为终止信号,翻译也提前终止;3号样品有一个碱基T突变为碱基G,使得其在第25位氨基酸由半胱氨酸变为甘氨酸(图10)。这些结果表明,本研究获得的原生质体基因组编辑样品中,BoPDS基因编码的氨基酸存在不同程度的变异,为在甘蓝上创制基因敲除植株奠定基础。

图10 野生型和基因组编辑的BoPDS序列的氨基酸序列预测Fig.10 Predicted amino acids of wild type and genome-edited BoPDS sequences
3 结论与讨论
原生质体的瞬时表达体系在现代分子生物学和细胞生物学发挥着重要的功能,被广泛地应用于亚细胞定位、蛋白互作、转录因子活性检测和基因编辑等分子生物学试验[19]。由于原生质体失去了细胞壁这一屏障,因而使其具有特殊的优点,当使用原生质体作为受体时,外源基因更易于转化,经培养、选择和分化后,便可以获得基因工程植株[20]。因此,对甘蓝原生质体制备与转化体系的研究,为甘蓝基因功能分析和新种质创制提供技术平台。
在原生质体制备过程中,多种因素可以影响原生质体产量和活力,例如酶解液的渗透压、酶解时间、纯化时的离心速度、不同外植体等。本研究利用正交试验对影响原生质体产量和活力的4个因素进行不同组合,对甘蓝原生质体制备体系进行了优化。酶解液的渗透压是影响原生质体分离的重要因素,渗透剂维持一定的渗透压,使细胞处于质壁分离状态,不致膨胀破裂。大多数研究使用0.3~0.8 mol/L的甘露醇来调节渗透压,如柳枝稷叶肉细胞和葡萄叶片原生质体分离时,使用的甘露醇浓度都为0.6 mol/L[21-22]。本研究使用0.6 mol/L甘露醇时效果最佳,0.8 mol/L时原生质体产量和活力下降。酶解时间是另一个获得高质量原生质体的重要条件,在其他条件相同的情况下,酶解时间越长,质膜越易受到损伤,虽然原生质体的产量变高,但破碎的细胞也随之增多,影响后续的试验,所以应控制酶解时间,以求在较短的时间内获得较多的原生质体。周波等[23]在研究芜菁原生质体分离及瞬时表达时酶解时间为18 h,本研究中分离原生质体的最佳酶解时间为6 h。由于原生质体没有细胞壁的保护,很容易发生破裂,因此离心速度将直接影响原生质的产量,适宜的离心速度不仅能保证原生质体不被外力所破坏,同时还能最大程度地得到高质量的原生质体。本研究中最适宜的收集原生质体的离心速度为2 115 r/min。不同外植体分离获得的原生质体产量和活力不同,在本研究使用的3种外植体中,下胚轴分离获得的原生质体产量和活力最高,这可能与不同组织部位的状态有关系;此外,下胚轴游离的原生质体生长速度快、褐化程度低、分裂频率高且无叶绿体等细胞器干扰,易于进行转化和亚细胞定位等试验[24-25]。本研究在获得的最佳组合条件下进行原生质体制备,分离获得的原生质体产量可达约为3.0×106个/g,活力约为90.9%,完全能够满足后续试验要求。
甘蓝原生质体的制备有较多的研究报道,但是对原生质体转化体系的研究相对较少。目前,原生质体的转化方法有农杆菌转化法、显微注射法及PEG介导转化法等。PEG介导转化法具有成本低、操作简便以及省时高效等优点而得到广泛应用[26]。本研究在20%的PEG介导下,将PYBA 1132载体分别与甘蓝下胚轴、子叶、叶球分离获得的原生质体孵育10 min,进行瞬时转化,均可检测到高活性绿色荧光,转化效率分别为43%,35%,19%,其中下胚轴分离获得的原生质体转化效率最高,同时也成功转化了线粒体与质体特异定位载体,进一步证明了该体系制备的原生质体应用于瞬时表达分析的可行性。本试验只对原生质体瞬时转化进行了初步摸索,还有很多因素影响原生质体的转化效率,比如载体大小、DNA浓度、PEG种类等[27],因此,该转化体系仍有很大的优化空间。
植物原生质体瞬时表达系统是一种快速的、高通量、转化简单的分析系统,也被广泛应用于CRISPR/Cas9基因编辑的研究中。已有研究报道,在一些遗传转化效率低的植物中,利用原生质体瞬时转化体系,对CRISPR/Cas9基因编辑系统的可行性进行快速评估。例如郭晔等[28]利用葡萄原生质体瞬时转化体系,对构建的CRISPR/Cas9表达载体的sgRNA靶向能力进行了检测,后对葡萄胚性愈伤组织进行遗传转化,成功获得葡萄VviPDS1基因敲除植株。张文静等[29]利用蒙古冰草原生质体瞬时转化体系,靶向敲除蒙古冰草落粒相关基因Sh1,为蒙古冰草CRISPR/Cas9基因编辑系统提供了试验依据。李继洋等[30]利用海岛棉原生质体转化体系,比较分析CRISPR/Cas9表达载体的编辑效率和脱靶效应的差异,为优化CRISPR/Cas9介导的海岛棉基因组编辑体系奠定了重要的理论依据。史奇奇等[31]构建CRISPR/Cas9表达载体pCas9-miR394,在红麻叶片原生质体中进行瞬时表达,发现设计的2个靶点在原生质体中都具有靶向切割活性。此外,Tian等[32]利用PEG介导的原生质体转化方法测试靶点特异性与效率,随后利用农杆菌介导法转化西瓜子叶建立西瓜稳定CRISPR/Cas9基因编辑体系。在芸薹属作物中,Lin等[33]利用原生质体转化体系,对菜花和油菜的GA4.a基因进行编辑,获得了稳定的基因编辑植株。然而,利用甘蓝原生质体检测CRISPR/Cas9系统中的sgRNA的靶向能力的研究还鲜有报道,同时甘蓝遗传转化周期长,遗传转化过程复杂且效率较低,因此,在甘蓝原生质体中评估CRISPR/Cas9载体靶向编辑效率,对于在稳定转化的甘蓝中实现成功的基因组编辑至关重要。本研究中通过PEG介导CRISPR/Cas9质粒瞬时转染甘蓝原生质体细胞后,通过测序的方法检测到了CRISPR/Cas9系统可在甘蓝原生质体细胞中进行基因编辑,获得碱基替换和碱基插入这2种基因编辑类型,受到编辑的BoPDS基因序列编码的氨基酸存在不同程度的变异,为创制甘蓝基因突变体奠定了基础。该方法则相对简单、快捷和成本低,且分离原生质体的材料丰富,可用于大量靶点切割能力的验证。利用原生质体瞬时转化系统,对甘蓝基因编辑进行了一个初步研究,对靶点切割能力的检测,评估靶点的特异性及效率,有利于后期应用于甘蓝稳定的CRISPR/Cas9基因编辑体系的建立,也为今后甘蓝基因编辑技术的应用奠定了基础。
综上所述,本研究利用正交试验对甘蓝原生质体制备体系进行了优化,建立了PEG介导的甘蓝原生质体瞬时转化体系,并利用该体系对CRISPR/Cas9表达载体PBSE401-BoPDS的sgRNA靶向能力进行了检测,获得了基因编辑的原生质体细胞,以上结果为甘蓝基因的亚细胞定位、功能分析以及稳定的基因编辑技术的利用等奠定了基础。
