超表达StCYS1对马铃薯生长发育及酶促褐变的影响
2020-06-29刘敏敏李广存刘士扬董田田王庆国
刘敏敏,李广存,刘士扬,董田田,王庆国,刘 佩
(1山东农业大学食品科学与工程学院/山东省高校食品加工技术与质量控制重点实验室,山东泰安 271018;2中国农业科学院蔬菜花卉研究所,北京 100081)
0 引言
蛋白酶抑制子(proteinase inhibitors,PIs)是生物体内发挥重要作用的多肽和蛋白质,广泛存在于动植物和微生物中。半胱氨酸蛋白酶抑制子(cystatin,CYS)是PIs 家族的一个重要分支,通过抑制半胱氨酸蛋白酶(cysteine proteinase,CP)的活性参与多种生理生化过程[1]。相关研究表明,CYS 能够调控植物的生长发育,如贮藏蛋白的沉积和动员、衰老器官中蛋白质的分解代谢、维管组织的分化、叶片衰老、种子萌发和病原菌诱导的细胞程序性死亡等,也参与植物对环境胁迫的应答[2-4]。
CYS 在作物生长发育中具有重要作用。过表达海棠MpCYS4基因的转基因苹果减缓了干旱胁迫下叶片净光合速率的下降,并阻止了CP对叶片中蛋白质的降解,从而减缓了苹果叶片的衰老[5]。异源表达水稻CYS 基因oryzacystatin-I或用人工合成的CYS E64 处理增加了拟南芥的侧根密度[6]。CYS通常局限于植物发育的特定阶段如果实成熟期表达,影响果实产量[7]。马铃薯中CYS的研究主要集中于对环境胁迫的应答和调控方面,目前关于CYS是否能直接对马铃薯的生长发育起调控作用,CYS对马铃薯植株的光合作用过程及根系发育影响的研究未见报道。
酶促褐变是鲜切马铃薯贮藏、加工过程中的难题。前人研究结果表明较高水平PIs的表达具有抑制马铃薯褐变的作用,外施PIs 类似物处理马铃薯浆液后褐变显著减轻[8]。刘博文[9]研究表明,预切伤处理马铃薯导致Kunitz型PIs基因表达量上调,总蛋白酶活性下降,游离酪氨酸含量下降,褐变显著减轻。但是,目前关于PIs抑制马铃薯褐变的调控途径尚不清楚。
本文通过测定超表达CYS 基因StCYS1和野生型二倍体马铃薯植株的光合作用、根系发育情况及结薯量;以超表达株系和野生型株系的块茎为材料,对马铃薯块茎的褐变表型进行观察,对PPO 活性、总抗氧化能力及游离氨基酸含量进行测定,旨在探究StCYS1基因对马铃薯生长发育的作用,揭示StCYS1对马铃薯褐变调控的生理机制,旨在为StCYS1调控马铃薯生长发育及酶促褐变方面提供分子基础和理论依据。
1 材料与方法
1.1 材料
试验所用的马铃薯(Solanum tuberosum)材料为二倍体‘MDS’,由中国农业科学院蔬菜花卉研究所李广存提供。超表达StCYS1基因(NCBI 登录号:No.MG793453.1)二倍体马铃薯株系OE1、OE2、OE3 是将StCYS1基因连接pBI121 超表达载体后,通过农杆菌AGL1+VirG介导转化MDS所得,由本实验室保存。
1.2 试验设计
试验于2018年8—12月在山东农业大学食品科学与工程学院的植物组织培养室内进行。组培室内昼/夜温度为21~23℃/21~23℃,16 h光照/8 h黑暗,相对湿度为45%~55%。马铃薯野生型株系‘MDS’(WT)和超表达StCYS1株系OE1~OE3 试管苗在MS 培养基中生长1个月后,分别选取长势相近的各株系试管苗30株栽植于盆(规格为A350;直径31.2 cm;高19.0 cm)中,营养土:蛭石=2:1,每盆一株。待植株生长60 天后,观察其生长状态,取样测定光合指标及根系发育情况。待植株生长120天后,采收各株系马铃薯,用于统计产量并测定马铃薯块茎褐变情况、PPO活性、总抗氧化能力(FRAP抑制率,ABTS、DPPH自由基清除率)和游离氨基酸含量。
1.3 主要仪器
GXZ 光照培养箱,宁波江南仪器厂;荧光定量PCR 仪,美国Bio-Rad 公司;CIRAS-3 便携式光合仪,英国PP System公司;Win RHIZO植物根系分析仪,石家庄泛胜科技有限公司;紫外分光光度计T6 新世纪,北京普析通用仪器有限责任公司;TGL16高速冷冻离心机,长沙英泰有限公司;DW-86L 388A超低温冰箱,海尔集团;超声波振荡器,上海生析超声仪器有限公司;液氮研磨仪,德国IKA 公司;高效液相色谱仪,日本岛津LC-20AT;C18液相色谱柱,Thermo Fisher公司。
1.4 试验方法
1.4.1StCYS1基因表达量的测定 取WT 和OE1~OE3株系叶片及块茎测定StCYS1表达量。采用OminiPlant RNA Kit(DNase I)全能型植物RNA提取试剂盒(康为世纪)提取样品RNA,cDNA 利用反转录试剂盒(HiFiScript cDNA Synthesis Kit,康为世纪)获得。qRT-PCR采用UItraSYBR Mixture试剂盒(康为世纪),操作参照说明书进行,所用引物为:正向引物F:5′-TCGTAAGTCGGAGTCGGATTATGGT-3′,反向引物R:5′-TGGAACTTCCTGGTGTCACCAAGTC-3′。Actin基因参考Hemavathi 等[10]。反应程序为:95℃预变性10 min,然后执行40 个循环反应(95℃变性15 s,60℃退火和延伸1 min),最后65~95℃进行溶解曲线分析。所有实时荧光定量PCR反应均设置3次生物学重复和3次技术重复,所得数据采用2-ΔΔCt进行计算。
1.4.2 净光合速率测定 盆栽苗生长60天后,选取在顶叶下完全展开的第3 片复叶,于上午9:00—11:00 用CIRAS-3便携式光合仪测定系统(PPSystems,英国)测定净光合速率(Pn)、胞间二氧化碳浓度(Ci)、蒸腾速率(Tr)和气孔导度(Gs),各株系分别选取长势一致的12株苗子测定,取其平均值。
1.4.3 根系形态指标的测定 使用专业版Win RHIZO根系分析仪,对生长60 天马铃薯苗根系长度、根系体积和根面积等主要根系参数进行分析。
1.4.4 马铃薯产量统计WT 和OE1~OE3 株系采收后的马铃薯清洗、擦干后称重,统计产量。
1.4.5 马铃薯褐变感官评价 将WT 和OE1-OE3 株系马铃薯的块茎用液氮研磨仪打粉后,分别称取2 g 于50 mL离心管中,迅速加入10 mL去离子水,置于常温下,分别在0、1、2、3 h观察褐变情况并拍照。
1.4.6 PPO 活性测定 粗酶液提取及PPO 活性的测定参考等Zhou 等[11]的方法并有所改动。取1 mL 10 mmol/L 的邻苯二酚溶液和1.5 mL 磷酸缓冲溶液,混匀后迅速加入0.75 mL 粗酶液,于420 nm 测定吸光值(每30 s测定一次,测定3 min)。每分钟内每克样品吸光值变化0.01为一个酶活力单位[U/(g·min)]。
1.4.7 总抗氧化能力测定ABTS自由基清除率的测定参考Re 等[12]的方法;DPPH 自由基清除率的测定参考Seijo-Rodríguez等[13]的方法;铁还原能力FRAP抑制率的测定参考罗冬兰等[14]的方法。
1.4.8 游离氨基酸含量测定 马铃薯游离氨基酸的提取参考Kumar 等[15]的方法,采用高效液相色谱法测定16种游离氨基酸(天冬氨酸、酪氨酸、脯氨酸、亮氨酸、甘氨酸、组氨酸、苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、苯丙氨酸、谷氨酸、丝氨酸、精氨酸、丙氨酸和赖氨酸),方法参考徐鑫等[16]的研究。
1.5 数据分析
采用SPSS 17.0 软件对数据进行数据统计分析及差异显著性的检验。采用Excel 2010统计分析软件进行基础数据整理分析与作图。所有试验均重复3次。
2 结果与分析
2.1 超表达和野生型株系StCYS1基因表达量
马铃薯植株栽植前,取WT和OE1~OE3叶片进行qRT-PCR 鉴定,超表达株系OE1、OE2 和OE3 叶片StCYS1基因表达量分别是野生型WT 的4.91、6.20 和3.92 倍(图1A),差异显著。马铃薯结薯后,取WT 和OE1~OE3马铃薯块茎进行qRT-PCR鉴定,超表达株系OE1、OE2 和OE3 块茎StCYS1基因表达量分别是野生型WT的5.21、5.67和4.17倍(图1B),差异显著。测定结果表明,超表达株系StCYS1在马铃薯叶片和块茎中均有过量表达。
2.2 超表达StCYS1对马铃薯光合特性的影响
光合作用是影响植物生长的关键因素,不仅影响马铃薯植株的生长发育,而且直接影响块茎产量和品质。对野生型和转基因株系马铃薯植株光合参数进行测定,结果表明超表达株系OE1、OE2和OE3的净光合速率为12.51、13.36、12.03 μmol CO2/(m2·s),比WT 提高了16.31%、24.24%、11.90%,各株系间差异达显著水平。超表达株系OE1、OE2 和OE3 的胞间CO2浓度比WT 提高了8.00%、11.74%、8.63%,各株系与WT 相比差异显著。与WT相比,OE1、OE2和OE3各株系的蒸腾速率、气孔导度测定结果趋势一致(图2),分别是WT 的1.29、1.32、1.33 倍和1.23、1.25、1.25 倍,超表达各株系均显著高于野生型(P<0.05)。研究结果表明超表达StCYS1显著提高了马铃薯植株的光合能力。
2.3 超表达StCYS1对马铃薯根系发育的影响
马铃薯根系从土壤中吸收水分和营养物质,一方面支撑地上部分的生长,另一方面,根围绕匍匐茎生长,对马铃薯地下块茎的发育也起着重要作用[17]。组培苗移栽前,WT株系根分生数较OE1-OE3株系少(图3)。移栽入定植盆60天后测定根系相关参数发现,超表达株系OE1~OE3须根系比野生型WT的根系发达,具体表现为总根长、总表面积和总体积显著高于野生型(P<0.05)。尤以OE2株系根发育最好,总根长、总表面积、平均直径和总体积分别为1221.05 cm、292.25 cm2、0.87 mm 和6.87 cm3,是WT 的2.42、1.87、1.34 和3.15倍(表1),差异显著。由此可知,超表达StCYS1显著促进了马铃薯植株根系的发育。
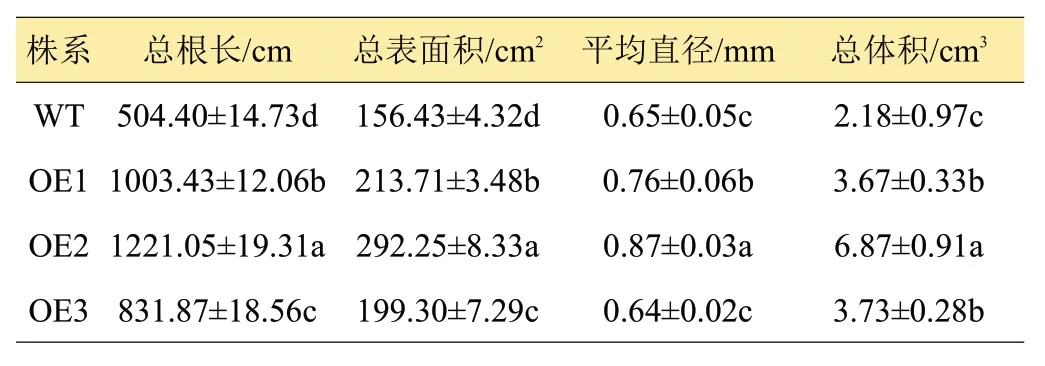
表1 不同马铃薯株系根系相关参数
2.4 超表达StCYS1对马铃薯产量的影响
马铃薯植株的结薯量的统计结果(表2)表明,不同株系马铃薯块茎的产量差异较大,超表达株系OE1~OE3 马铃薯单株薯重和单株结薯数量为14.25、19.63、10.93 g 和23.33、17.86、10.33 个,均显著高于WT(P<0.05);而且OE1~OE3 株系最大单薯重量大于WT,尤以OE2株系的单薯重量最大,达11.48 g。由此可知,超表达StCYS1显著提高了马铃薯块茎产量。
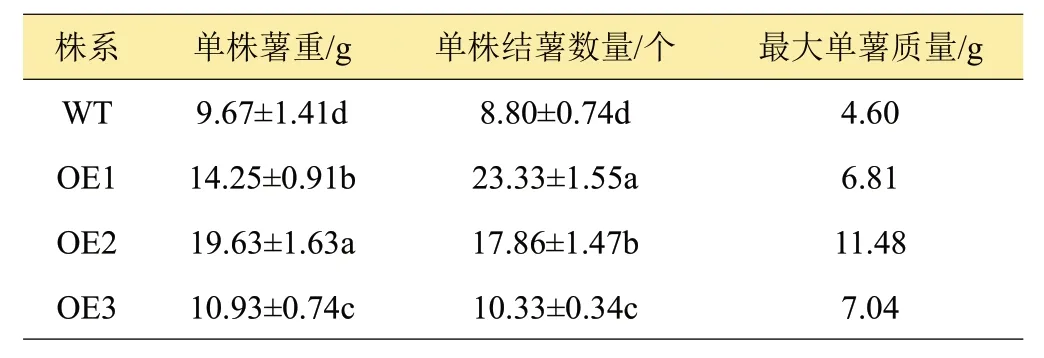
表2 不同株系马铃薯产量
2.5 超表达StCYS1对马铃薯酶促褐变的影响
OE1~OE3 和WT 株系结薯后,挑选大小相当、无破损的马铃薯块茎去皮、液氮研磨成浆,观察其浆液褐变情况。如图4 所示,随时间变化,WT 浆液褐变程度逐渐加重,OE1~OE3 浆液褐变程度均显著低于WT,且3 个株系中,StCYS1表达量较高的2 个株系OE1、OE2褐变程度一直低于OE3。结果表明超表达StCYS1可显著抑制马铃薯浆液的褐变。在此基础上,通过测定WT 和超表达株系块茎PPO 活性、抗氧化能力及游离氨基酸含量,探讨超表达StCYS1对马铃薯块茎褐变的影响机制。
2.6 超表达StCYS1对马铃薯PPO活性的影响
多酚氧化酶(PPO)是酶促褐变过程中黑色素合成途径中的关键酶。研究表明通过基因沉默或者敲除手段来抑制马铃薯PPO 基因表达,以及通过物理、化学方法抑制PPO 活性,均能抑制块茎鲜切褐变[18]。由图5可知,超表达株系OE1~OE3的PPO活性均高于野生型WT。其中,OE1 和OE2 酶活性分别是WT 的1.41和1.36 倍,显著高于WT(P<0.05),OE3 酶活性是WT的1.08 倍,但无显著性差异(图5)。超表达StCYS1的马铃薯块茎浆液褐变程度降低,但PPO 活性却增高了,结果表明PPO可能并不是影响超表达StCYS1马铃薯块茎褐变的关键因素。
2.7 超表达StCYS1对马铃薯总抗氧化能力的影响
研究表明,PIs 的积累能够提高抗氧化能力[19],而在马铃薯鲜切褐变控制的研究中发现,块茎抗氧化能力,如DPPH自由基清除率、FRAP和ABTS自由基清除率等的提高,往往会抑制鲜切褐变[20],因此测定了WT和超表达株系的抗氧化能力。如图6所示,超表达株系的FRAP抑制率(铁还原能力)、DPPH自由基清除率和ABTS自由基清除率均显著高于野生型WT,不同指标的测定结果具有一致性,三者互为印证,即StCYS1基因的超表达显著提高了马铃薯的抗氧化能力。
2.8 超表达StCYS1对马铃薯游离氨基酸含量的影响
前人[21]研究发现,果蔬褐变过程中,PPO催化酚类底物氧化而生成邻醌,游离氨基酸可与醌类物质反应,促进褐变过程或作为螯合剂抑制褐变。而在马铃薯鲜切褐变中,游离酪氨酸是褐变不可或缺的底物[22]。经过测定,发现OE1~OE3株系与WT株系存在11种差异氨基酸,其中OE1~OE3株系中游离天冬氨酸、苏氨酸、脯氨酸、亮氨酸共4 种游离氨基酸含量显著高于WT,游离酪氨酸、甘氨酸、组氨酸、缬氨酸、甲硫氨酸、异亮氨酸和苯丙氨酸共7 种氨基酸含量显著低于WT。褐变底物酪氨酸含量的降低,与StCYS1基因超表达降低马铃薯鲜切褐变密切相关。而脯氨酸含量的升高,可使得马铃薯块茎抗氧化能力增加,从而抑制鲜切马铃薯褐变。

表3 不同株系马铃薯差异游离氨基酸含量 g/kg
3 讨论
3.1 超表达StCYS1 提高了植株光合能力,促进了根系发育进而提高了马铃薯的产量
前人研究发现薯类产量与光合作用的强弱密切相关。Song 等[23]研究合理调整甘薯的种植距离和种植密度能够提高甘薯的净光合速率,达到增产的目的。光合作用是决定马铃薯产量的最重要的初级代谢过程,干旱胁迫下光合能力较强的马铃薯减产较少[24]。本研究发现,StCYS1超表达株系的光合能力提高,产量较野生型显著增加,这与前人的研究结论一致。植物根系的发育构型与其利用土壤养分、水等资源的能力密切相关,影响植株地上部的生长和果实产量[25]。适度干旱胁迫能诱导马铃薯根长和根表面积增加,块茎产量提高[26]。本研究发现,StCYS1超表达株系的总根长和总表面积与野生型相比显著增加;光合作用的提高使植株的有机物积累增多,这可能是马铃薯产量提高的重要原因。然而,超表达StCYS1是否进一步影响了马铃薯块茎的品质,如淀粉、VC和酚酸含量等,还需要进一步深入研究。
3.2 超表达StCYS1 通过提高马铃薯块茎抗氧化能力、降低游离酪氨酸含量来抑制褐变
植物组织的抗氧化能力对保护细胞膜的完整性起重要作用。马铃薯受到鲜切伤害时,细胞膜的完整性被破坏,打破了酚-酚酶的区域分布,PPO 和酚类底物接触并发生反应,引起鲜切马铃薯的褐变[27]。脯氨酸既能够清除活性氧,减轻细胞的氧化损伤,也能作为重要的渗透调节物质,在细胞膜受损后维持细胞的渗透压,对保护细胞膜完整性起重要作用。超表达StCYS1马铃薯块茎的脯氨酸含量升高,起到了减轻细胞膜氧化损伤、维护细胞膜稳定性的作用,进而减轻了马铃薯的褐变。范昊安等[20]研究发现,苹果梨酵素通过发酵提高了自身抗氧化活性,有效抑制了酶促褐变。抗氧化能力的强弱也是评价马铃薯抗褐变能力的重要指标。本研究结果证明了超表达StCYS1显著提高了二倍体马铃薯的总抗氧化能力,推测StCYS1超表达抑制褐变与增强马铃薯的抗氧化酶系统有关。试验后续需研究SOD、CAT等抗氧化酶的活性及其基因表达的变化,深入探究抗氧化系统与酶促褐变的关系。
在以往的研究中,氨基酸主要作为非酶褐变如美拉德反应的底物、抗坏血酸褐变系统的诱导因子等影响着农产品加工过程中的褐变[28,29]。虽然已有研究证明游离氨基酸尤其是酪氨酸是马铃薯酶促褐变的主要底物,但是关于氨基酸参与酶促褐变的机理研究较少。蛋白酶的大量表达会导致蛋白质的水解[15],进而产生大量的游离酪氨酸[30]。超表达StCYS1可能是通过抑制蛋白酶的活性使蛋白质水解减少,游离酪氨酸含量降低,进而抑制了褐变。因此,超表达StCYS1能否影响总蛋白酶活性及其作用的靶蛋白酶是StCYS1抑制马铃薯酶促褐变机制的研究方向。
3.3 超表达StCYS1提高了PPO活性,间接促进了马铃薯的生长发育
前人研究表明PPO除了在生物体酶促褐变、体内色素合成等过程中起关键的作用外,PPO 催化酚类底物需要的氧气和NADH由光合系统提供,在植物光合作用、生物合成、抵御外界胁迫等生理过程中具有重要作用[31]。姜翠翠等[32]研究发现,㮈树的生长发育过程中,PPO 基因在幼嫩组织中有较高的表达量。推测PPO 活性可能与超表达StCYS1马铃薯植株的光合作用有关,进而影响了马铃薯的生长发育。超表达StCYS1提高了马铃薯株系块茎的抗氧化能力,抑制蛋白酶的水解,减少了褐变底物游离酪氨酸,PPO活性的提高没有加重马铃薯的褐变。因此,还需进一步探究超表达StCYS1马铃薯的生长发育与酶促褐变过程中主要作用因子间的相互关系,测定PPO 基因的表达,以更好地揭示StCYS1对马铃薯生长发育和酶促褐变的作用机理。
4 结论
本研究结果表明,超表达StCYS1马铃薯植株的净光合速率、根系发育程度和块茎产量都显著高于野生型植株,说明StCYS1的超表达促进了马铃薯植株的生长发育。此外,与野生型相比,超表达StCYS1马铃薯块茎褐变程度轻,游离脯氨酸含量高,总抗氧化能力强;酪氨酸含量低,PPO活性高,说明StCYS1超表达主要通过增强马铃薯块茎抗氧化能力和降低酪氨酸含量来减轻褐变,PPO不是主要影响因素。
