不同榆树无性系对低温胁迫的生理响应及抗寒性评价
2020-06-28王力源麻芸娇李文杰刘兴菊梁海永
王力源,麻芸娇,李文杰,刘兴菊,梁海永
(1河北农业大学 林学院,河北 保定 071000;2河北省林木种质资源创新与保护实验室,河北 保定 071000)
对于高等植物来说,环境温度是影响植物存活和生长发育的重要因素之一,低温胁迫通常明显大于其他环境因素胁迫[1-3]。1930 年,Dexter 首次将电导法用来研究植物的抗寒性,此后该方法不断改进发展,电导法已经成为研究抗寒性强弱的主要方法[4],此外前人还对各种植物抗寒性研究提出许多方法。相关研究表明,可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量、抗逆酶含量和电导率等与植物的抗寒性有密切相关。马晓蕊等研究表明,植物组织中可溶性糖含量越高,植物组织细胞液的渗透压越高,植物抗寒性越强[5]。田介云等研究表明,仁用杏在低温过程中的抗寒性强弱与植物组织中可溶性蛋白含量密切相关[6]。韩立群等认为植物在受到低温胁迫的时候,游离脯氨酸含量发生明显变化,因此表明低温胁迫会对植物组织中游离脯氨酸含量产生影响[7]。悦冲认为植物的抗寒性与游离脯氨酸含量密切相关[8]。欧欢对不同扁桃品种的枝条进行低温胁迫,发现抗逆酶活性的升高与降低,可以反映扁桃的抗寒性强弱[9]。
榆树(UlmuspumilaL.)为榆属植物的总称,约有 40 余种,主要分布于欧洲、亚洲和美洲,我国有24 种,南北均可生长。榆树为阳生树种,喜光,抗寒,耐旱,耐瘠薄,对气候、土壤等适应性较强,榆树曾是我国北方五大阔叶造林树种之一,也是河北主要的乡土树种之一,由于其根系发达,枝叶繁茂,且具有良好的抗寒抗旱、耐盐碱、抗病和抗风性,寿命长,在水分匮乏的沙地和沙丘上能生长,使得榆树成为我国北方广大平原、干旱草原、滨海盐碱地、沙荒地营造用材林和防护林的重要树种[10-11]。我国北方气候冬季寒冷干燥,早春易出现大风天气,多数林木不易成活,因此收集并选育抗寒性强、生长迅速的榆树新品种,是解决北方树木冻害的关键。近些年来,作为北方寒冷地区造林的理想树种,关于榆树的研究越来越受到广泛的重视。
为此,以来自 3 个榆树种的 9 个无性系为研究材料,通过对比不同低温处理下,各榆树枝条的生理响应,运用隶属函数法进行抗寒性综合评定,比较不同榆树无性系的抗寒性强弱,探讨榆树在寒冷环境下,产生的生理变化,旨在为榆树育种杂交亲本选择提供依据,对选育有较强抗寒性的榆树无性系提供指导。
1 材料与方法
1.1 试验材料与处理
于2018年12月-2019年2月,在张家口涿鹿的苗圃基地选取砧木相同的白榆(D1520、D1507、D1526);黑榆(D2、H1506、D28);春榆(Y1、B19、Y3)等3个树种共9个无性系,每个无性系选取3株长势相同的3 a生嫁接苗资源进行试验,对其不同榆树无性系的1 a生枝条进行研究,尽量保证枝条的各方面一致性,以保证试验数据的准确性。
1.2 试验方法
1.2.1 试验材料采集 采集树冠南侧,直径 0.8 cm~1.0 cm的枝条,每株枝条数量相同。材料采集回来以后,把枝条剪成 20 cm左右,同一无性系枝条混合均匀,并将材料进行清洗,去除表面尘土等污染物,再用干净纱布轻轻吸干枝条上的水分,然后在枝条两端涂抹凡士林,防止水分流失,每个无性系平均分成5份,每份分得3个枝条,用湿纱将分好的枝条布包起来,分别置于 4 ℃、 -10 ℃、 -20 ℃、 -30 ℃、 -40 ℃的冰箱中,进行的低温胁迫处理。处理 24 h 后,取出在 4 ℃ 放置 24 h 进行解冻。
1.2.2 抗寒性生理指标方法 采用李合生的试验方法测定榆树枝条的各种生理指标[12]。
细胞膜透性试验处理,细胞膜透性采用电导法测定:将不同温度梯度下 3 个枝条剪切成2~3 cm小段,称取质量(3次重复),按照0.1 g枝段加水20 g加入蒸馏水,真空处理40 min,静止20 min,用电导率仪测量初始电导及空白水电导测定,之后放入水浴锅100 ℃煮沸20 min,取出静止12 h,进行终止电导及处理后空白水测定,计算枝条相对电导率[13]。
酶液制备:将不同温度梯度下 3 个枝条的韧皮部剪碎混合均匀,准确称取 0.3 g (3次重复),置于预冷的研钵中,先加 2 mL 50 mmol/L pH =7.8磷酸缓冲液,少许石英砂,快速而充分的研磨成匀浆状态,再用 6 mL磷酸缓冲液清洗干净,摇匀。在 10 000 rpm冷冻( 4 ℃ )离心 20 min,离心结束后,上清液为可溶性蛋白、POD、 SOD 、CAT和 MDA粗提酶液,倒出来放入提前标记好的离心管中读取上清液体积并记录,于4℃冰箱保存备用。
自然越冬指标:硫代巴比妥酸(TBA)法测定丙二醛含量;可溶性蛋白的测定使用考马斯亮蓝 G-250 染色法;对游离脯氨酸进行磺基水杨酸提取,茚三酮显色法测定;蒽酮显色法测定可溶性糖含量。
低温胁迫指标:细胞膜透性采用电导法测定[13];抗逆酶活性测定:氮蓝四唑法(SOD)、紫外吸收法(CAT),愈创木酚法(POD)。
1.2.3 半致死温度计算及生理指标分析 采用孙宜等的方法将相对电导率拟合 Logistic 曲线方程[14]:
y=k/ (1+ae-bt)
(1)
式(1)中y为相对电导率;t为温度梯度;k为极限相对电导率,为100%;a和b为待定系数。对式(1)求二阶导数,并令其为零,得式(2):
t=lna/b
(2)
式(2)为相对电导率随温度下降而增加最快时的温度,即LT50(或组织崩溃点)依据式(1)和(2)计算低温半致死温度LT50。
利用Excel 2003软件进行数据处理和相关性分析;运用 SPSS 20 软件进行差异显著性检验(P=0.05)以及主成分分析。运用隶属函数法,对各指标求得的隶属值进行累加、取平均数。按照从大到小的顺序对各个树种的反隶属函数平均值进行排序,可对各榆树无性系进行抗寒性综合评价。
3 结果与分析
3.1 低温胁迫下各榆树无性系生理指标
3.1.1 不同榆树枝条相对电导率的变化情况 在低温胁迫下,9个无性系枝条的相对电导如图1。


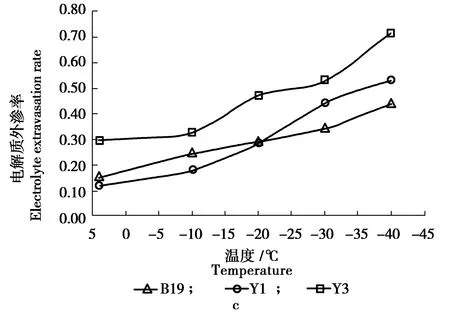
图1 低温胁迫下各榆树无性系相对电导率变化趋势Figure 1 The changes in relative conductivity of Ulmus clonesunder low temperature stress
图1可知,随着胁迫温度的降低,9 个无性系枝条的相对电导率逐渐增大(图1), 但各无性系相对电导率的变幅不同。总体上看,9 个无性系的相对电导率均呈“缓慢升高—迅速升高—平稳升高”的“ S ” 型曲线,其中从常温到 -30 ℃ 相对电导率变化幅度不大,-30~-40 ℃ 相对电导率快速增加,变幅较大 。枝条细胞膜受害越严重是相对电导率变化幅度越大的主要原因,表明该榆树无性系对低温更敏感,可以初步推测:D1520的抗寒性最强,D1507 、 D1526 、 D2 、 H1506 、Y1、B19 的抗寒性次之, Y3、 D28的抗寒性较弱。榆树各无性系的拐点在 -30~-40 ℃ 之间。
通过人工低温处理下的相对电导率变化曲线结合Logistic方程,可以拟合出D1520、D1507、D1526、D2、H1506、Y1、B19、Y3、D28的拐点温度来表示半致死温度见表 1。

表1 榆树各无性系的半致死温度Table 1 The semi-lethal temperature of each Ulmus clone
依据表 1中数据可见: 9 个无性系 Logistic 方程的相关系数为 0.958~0.996,均达到显著(P<0.05) 或极显著(P<0.01) 水平。同时可得出D1520的半致死温度为 -40.83 ℃,D28的半致死温度为 -33.67 ℃;因半致死温度越高,抗寒性越弱,半致死温度越低,说明其忍耐低温的能力越强,因此我们根据表1中数据可以得到榆树不同无性系抗寒性强弱依次为:D1520 、 D1507 、 D1526 、 D2 、 H1506 、 Y1 、 B19、 Y3、 D28。由此可知无性系D1520、D1507的抗寒性较强,Y3、D28 抗寒性较差,进而初步确定抗寒性白榆>黑榆>春榆。
3.1.2 低温胁迫对不同榆树抗逆酶酶活性的影响 在低温胁迫下,参试的 9 种榆树POD 活性测定结果见图2。

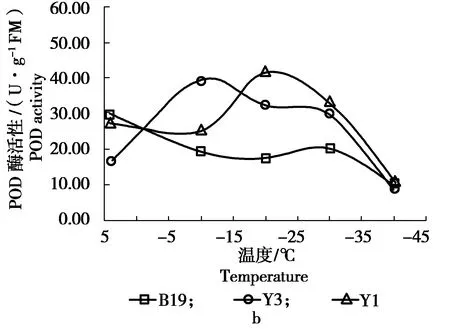

图2 低温胁迫下各榆树无性系POD活性的变化Figure 2 The changes in POD activity of various Ulmusclones under low temperature stress
图2可知,在整个低温处理过程中,D1520 、D1507系列的POD活性处于较高水平,而Y3的POD活性较低。 D1520 、D1507 、D2、 H1506 、 D28等榆树无性系从常温到 -10 ℃ 时,POD活性开始升高,从 -10~-40 ℃ 时出现下降趋势;Y1系列从常温到 -10 ℃ 时,POD活性变化比较平缓,在从 -10~-20 ℃ 时出现开始升高,之后出现下降趋势;B19 和 Y3 系列从低温胁迫开始POD 活性就一直明显的下降;D1526 系列从低温胁迫则从开始POD 活性就一直在上升。
在低温胁迫下,参试的9种榆树SOD活性测定结果见图3。



图3 低温胁迫下各榆树无性系SOD活性的变化Figure 3 The changes in SOD activity of various Ulmusclones under low temperature stress
由图3可知,在整个胁迫处理过程中,D1520的SOD活性在-20℃达到高值,是所有无性系中最高的;而Y1的SOD活性的高值出现在-10 ℃,比所有无性系均低;Y3在 -30~-40 ℃ 时,酶活性基本没变。D1507、 D1526 、 D2 、H1506 、Y1 、 Y3、D28系列从常温到 -10 ℃ 时,SOD活性开始升高,从-10~-40 ℃ 时,SOD活性一直在明显下降。D1520 和B19系列从常温到 -20 ℃ 时,SOD 活性呈现上升趋势,从-20~-40 ℃ 时,SOD 活性则开始下降。
在低温胁迫下,参试的9种榆树CAT活性测定结果见图4。

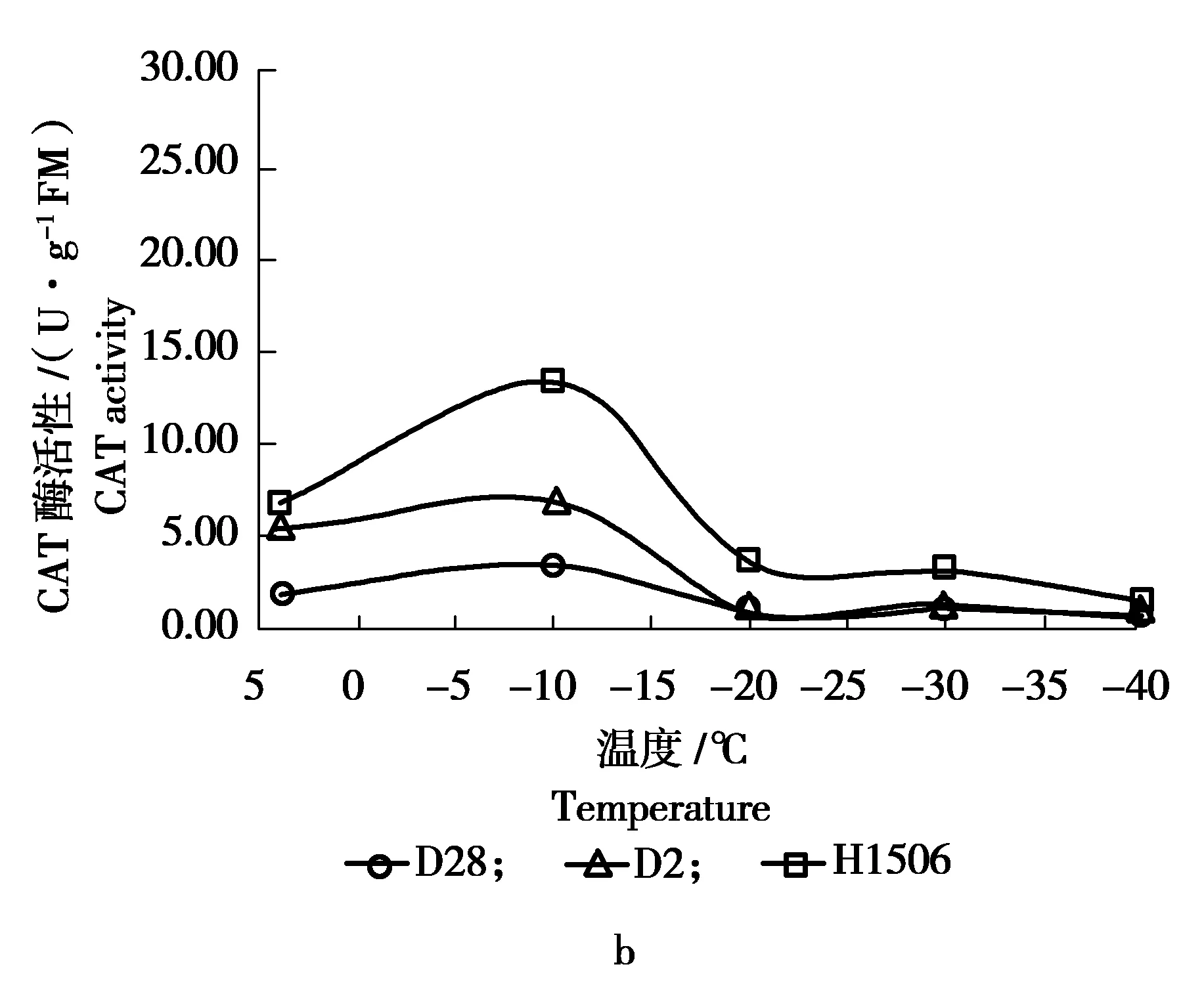

图4 低温胁迫下各榆树无性系CAT活性的变化Figure 4 The changes in CAT activity of various Ulmusclones under low temperature stress
由图4可知,在整个低温处理过程中,D1526、D1507以及D1520的CAT活性处于较高水平,而D28、Y1的CAT活性较低,榆树各无性系从常温到-10℃时,CAT活性开始小幅度上升;从-10~-20℃时,除D1507出现上升情况外,其余各无性系均呈现小幅度降低;除H1506外,从-20~-30℃大多无性系均缓慢下降,温度继续降至-40℃时,CAT活性明显下降。
3.2 越冬期间各榆树无性系部分生理指标
3.2.1 越冬期间各榆树无性系可溶性糖和可溶性蛋白含量变化 不同月份中,参试的9种榆树无性系可溶性糖含量测定结果见图5,可溶性蛋白含量测定结果见图6。

图5 不同月份各榆树无性系的可溶性糖含量Figure 5 The soluble sugar content of each Ulmusclone in different months

图6 不同月份各榆树无性系的可溶性蛋白含量Figure 6 The soluble protein content of each Ulmusclone in different months
由图5可知,可以看出各榆树无性系的可溶性糖含量在冬季均在升高,其中D1520、D1526上涨较快,二月份涨幅分别为71.37%、74。20%;Y1、D28均上涨较慢,涨幅分别为15.91%、17.41%;而Y3甚至出现下降现象,下降了19.45%。
由图6可知,可以看出,除D1526和D28出现下降外,各榆树无性系的可溶性蛋白含量在冬季均在升高,其中D1507上涨较快,上涨了39.67%;Y1均上涨较慢为6.53%,而D28甚至出现下降现象,降幅为11.24%。
3.2.2 越冬期间各榆树无性系游离脯氨酸与MDA含量变化 在越冬期间的不同月份中,参试的9种榆树游离脯氨酸含量测定结果见图7。

图7 不同月份各榆树无性系的游离脯氨酸含量Figure 7 The free proline content of Ulmus clonesin different months
由图7可知,可以看出各榆树无性系的游离脯氨酸含量在冬季均在升高,其中Y3、Y1上涨较快,在2月份涨幅分别为85.44%、64.61% ;D1520与D1507均上涨较慢,在2月份涨幅分别为38.95%、36.03%。
MDA活性测定结果见图 8。

图8 不同月份各榆树无性系的丙二醛含量Figure 8 The MDA content of each Ulmus clonein different months
由图8可知,由图8可知,在各种榆树无性系,除D2、Y1、先上升后下降,其余无性系均呈现上升趋势,但是D1520、D1507和D1526趋势不明显;而Y3及D28上涨趋势较大。在整个冬月中,Y3的MDA活性均处于较高水平,而D1526、D1507的MDA活性较低。
4 利用隶属函数法进行抗寒性综合评定
植物抗寒性是一个复杂的生理生化过程,受多种因素的影响,单一指标很难反应抗寒本质,采用模糊数学中的隶属函数的方法,以9个榆树无性系枝条1月份的低温胁迫下对照组相对电导率、SOD、POD、CAT以及可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量、MDA的平均隶属函数值,得隶属函数加权平均值作为植物种抗寒性的综合评定标准,消除了个别指标带来的片面性,目前这一方法已广泛应用[15]。不同榆树各指标隶属函数值和综合评定结果见表2。
综合评定值越大,说明其抗寒性越强,在表2中可以发现D1520 这个无性系抗寒性最强,D28抗寒性最弱,9种榆树无性系抗寒性由强到弱依次为:D1520、 D1507、 D1526、D2、H1506、 Y1、 B19、 Y3、 D28。

表2 不同榆树各指标隶属函数值和综合评定结果Table 2 The membership function values and comprehensive evaluation results of different indicators of different Ulmus
5 结论与讨论
可溶性糖和可溶性蛋白是植物体内重要的渗透调节物,有研究表明,在低温条件下,植物可通过渗透调节作用减轻伤害,同时与生物膜系统有关的相对电导率、MDA 含量会呈现增加趋势[16-17]。本试验研究可知,对于越冬阶段,参试的榆树无性系韧皮部中可溶性糖含量,抗寒性强的无性系可溶性糖含量明显高于抗寒性差的无性系,这与韩俊威[18]研究结果相一致;榆树无性系的可溶性蛋白含量呈增加趋势,抗寒性强的品种增加幅度大,抗寒性差的品种增加幅度小,与在核桃[19]和山杨[20]上的研究结果相一致,存在略微差异可能是在试验过程中的不严谨导致的。结果表明在越冬期间,可溶性糖和可溶性蛋白发挥着渗透调节作用。在相同月份下,参试的不同榆树无性系枝条韧皮部可溶性糖和可溶性蛋白含量与相对电导率均呈显著正相关(R2=0.967,R2=0.952 ),游离脯氨酸含量及 MDA 含量与榆树无性系的相对电导率呈负相关(R2=0.984,R2=0.632),这与前人在紫薇上的研究结果一致[21]。
不同低温胁迫下的电导率和抗逆酶活性受温度影响较大,SOD 能够清除活性氧,使其生成氧气与过氧化氢,再通过 CAT 与 POD 分解过氧化氢,从而保护细胞免受活性氧的伤害[22-24]。大量研究发现,植物体在受到胁迫后,其体内抗逆酶活性有升有降,且呈现出抗性强无性系活性高于抗性弱无性系的现象[25]。本试验中,榆树无性系的SOD 、POD 和 CAT 活性的相关性较好,说明三者存在密切的互作关系;并且,抗寒性强的品种其 SOD、POD、CAT 活性较高,抗寒性弱的品种其 SOD、POD、CAT 活性较低,这与前人在仁用杏[27]和苹果[28]上的研究结果一致。抗逆酶活性在一定可承受温度范围内,其活性呈现出小幅度上升趋势,但是达到一定低温时,其活性也会降低。
植物的可溶性糖含量、可溶性蛋白含量、游离脯氨酸含量、SOD 酶活性、POD 酶活性、CAT 酶活性、丙二醛质量摩尔浓度等指标均与植物的抗寒性强弱息息相关,但单独依据一个指标不能直接判断不同无性系的抗寒性强弱。因此,在评定植物抗寒性时应考虑多方面指标,并不能靠单一指标来判断[28-30],隶属函数法就是普遍采用的抗性综合评价方法[29]。在越冬期间不同榆树无性系间生理变化存在显著性差异,说明不同无性系抗寒性不同,根据越冬抗寒指标相关性并采用模糊数学隶属函数的方法,综合评价 9个无性系的冬季越冬抗寒性的大小,得出综合抗寒性由强到弱依次为:D1520、 D1507、 D1526、 D2、 H1506、 Y1、 B19、 Y3、 D28,这与榆树无性系枝段的半致死温度排名相一致。本试验是在离体条件下测定某一月份枝段的相对电导率,获得的 LT50值与采样时天气及是否经过低温锻炼有关,虽然 LT50值不一定能确切反映榆树各无性系的抗寒性,但是可以快速评价取样时各无性系的抗寒性差异。
综上所述,依据9个榆树无性系的抗寒性的排序结果可以在不同严寒气候区域优先选择种植抗性较强的无性系。其中,无性系D1520具有较强的抗寒性,可以尝试在北方比较寒冷的高山和荒漠地区推广种植。另外,还可以将抗性较强的无性系作为杂交育种的亲本,有利于杂交后代增加抗性的积累,并极有可能培育出抗性更高的新无性系。
