莱州湾游泳动物群落结构研究
2020-06-28张焕君刘淑德刘元进周全利
张焕君, 刘淑德, 刘元进, 涂 忠, 周全利, 陈 玮, 孙 伟, 李 凡
莱州湾游泳动物群落结构研究
张焕君1, 刘淑德2, 刘元进1, 涂 忠2, 周全利1, 陈 玮1, 孙 伟1, 李 凡1
(1. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室, 山东 烟台 264006; 2. 山东省水生生物资源养护管理中心, 山东 烟台 264003)
本文根据2010和2011年春季(5月)、夏季(8月)、秋季(10月)和冬季(12月)进行的8航次调查数据, 研究了莱州湾游泳动物群落格局及其与环境因子关系。结果显示, 调查共捕获游泳动物85种, 2011年生物量略高于2010年; 生物量季节间差别较大, 各季节生物量排序为夏季、秋季、冬季和春季; 不同年间相同季节生物量差异多不显著(秋季除外); 除2010年春季外, 其余季节均为鱼类生物量最高, 甲壳类次之, 头足类最低; 从全年调查平均值来看, 莱州湾西侧游泳动物生物量(60.2 kg/h)明显高于东侧(33.4 kg/h)。根据8航次31个主要种类生物量聚类分析, 莱州湾20调查站位可划分为4组: 组I由位于调查海域东南的3个站位组成, 组II由位于调查海域东部及中部的8个站位组成, 组III由调查海域西北部(黄河口南侧)的3个站位组成, 组IV由西部6个站位组成。组I浮游植物丰度、浮游动物生物量、游泳动物生物量和游泳动物多样性指数在各组中均最低, 而底栖动物生物量最高; 组III和组IV的浮游植物丰度、浮游动物生物量以及游泳动物生物量高于组I和组II。ANOSIM分析表明, 各聚类组间群落结构虽有不同, 但差异并不显著。DCCA分析表明, 温度、盐度、底栖动物生物量以及浮游植物丰度是影响游泳动物群落的重要因子。研究表明, 目前莱州湾游泳动物群落总生物量处于较低水平, 特别是春季生物量下降尤为严重; 生物量的季节分布发生了较大的改变, 春季生物量极低, 夏季生物量相对较高; 底层鱼类比例下降的趋势有所逆转, 头足类比例明显增加。莱州湾游泳动物群落格局异质性较低, 可能与莱州湾生境异质性低以及人类剧烈干扰密切相关。
生物量; 聚类; 非度量多维标度排序; 去趋势典范对应分析
莱州湾位于山东半岛西北、渤海南部, 有黄河、潍河、小清河等多条河流注入。黄河是影响本区域的主要河流, 每年为莱州湾带来了大量的淡水, 入海口附近海域具有盐度低, 温度适中, 营养盐丰富的特点, 使莱州湾附近海域成为众多主要经济生物的产卵场、索饵场和育幼场, 是我国沿海渔业资源生产力最高的海域之一, 俗有“北方渔仓”之美誉。受长期的过度捕捞和环境污染影响, 莱州湾乃至整个黄、渤海的渔业资源已严重衰退, 面临几近枯竭的严峻形势, 渔业资源群落结构也发生了巨大的变化[1-3]。
莱州湾游泳动物主要包括鱼类、头足类和一些大型甲壳类, 它们中的许多种类既是海洋生态系统中的高级消费者, 也是渔业开发的对象。研究游泳动物群落格局及其变化对于了解莱州湾生态系统特征以及游泳动物资源保护具有重要现实意义。有关莱州湾及渤海游泳动物群落组成、优势种变化等的研究开展较多[2, 4-10], 这些研究未涉及游泳动物群落格局的研究。
本研究于2010年和2011年对莱州湾渔业资源进行了8个航次的调查, 探究了莱州湾游泳动物生物量及其时空变化, 揭示了莱州湾游泳动物群落结构及其与环境因子的关系, 以期为近海渔业资源保护、渔业经济可持续发展以及生态修复等提供基础资料。
1 材料与方法
1.1 调查站位和调查时间
本研究于2010年和2011年对莱州湾附近海域进行了8航次调查, 调查时间分别为5月(春季)、8月(夏季)、10月(秋季)、12月(冬季), 在119°05′—120°00′E、37°12′—37°40′N区域内设置了20个站位(图1), 采用单船底拖网, 船只功率260 kW, 网口周长30.6 m, 囊网网目20 mm, 拖曳时网口宽度8 m。每站位拖网时间为1 h, 拖网船速为3 kn。
1.2 样品分析方法
样品分析按照《海洋调查规范(GB/T 12763.6—2007)》的要求实施, 调查均在白天进行, 调查人员记录每个站位的渔获量, 渔获量少于20 kg的站位, 全部样品均留样分析; 渔获物20~40 kg的站位, 选取大型个体和稀有物种后, 剩余部分随机抽取1/2样品留样; 渔获量超过40 kg的站位, 选取大型个体和稀有物种后, 剩余部分随机抽取20 kg样品留样。样品冷冻保存后, 带回实验室进行分类鉴定和生物学测定。2010年冬季航次中SL16站未取得有效数据, 计算中未使用该航次此站数据。将119°30′E以西、以东海域分别定义为莱州湾西侧海域、东侧海域。
环境因子测定均按照《海洋调查规范》(GB/T 12763—2007)、《海洋监测规范》(GB 17378—2007)规定的方法进行。水温、盐度、氨、硝酸盐、亚硝酸盐、磷酸盐的分析, 分别采用水温表法、盐度计法、锌-镉还原法、萘乙二胺分光光度法、次溴酸盐氧化法、磷钼蓝分光光度法, 均为表、底层海水平均值; 叶绿素为表层海水数据。浮游植物使用浅水III型浮游生物网采集, 浮游动物使用浅水I型浮游生物网采集, 底栖动物使用抓斗采泥器(取样面积0.05 m2, 每站取样5次)采集。
1.3 数据处理
(1) 数据标准化
根据实际拖网时间和物种的可捕系数, 对调查数据进行标准化。中上层鱼类可捕系数为0.3, 中底层鱼类取0.5, 底层鱼类取0.8[11]。
(2) 群落结构的相似性
通过Bray–Curtis相似性指数计算各航次物种组成的差异, 分析莱州湾游泳动物随时间的变化规律。计算公式[12]为:
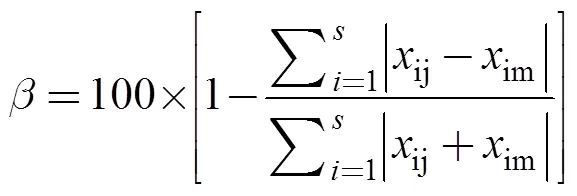
式中ij,im分别为第个种类在第个月份和第个月份的单位时间的生物量。
(3) 聚类与非度量多维标度分析
根据全年调查数据计算各种类生态优势度(IRI), 仅保留IRI≥10的种类用于数据分析。2010年有29种(占生物量的99.7%), 2011年有24种(占生物量的99.3%), 合计共31种。为平衡群落中不同物种的作用, 生物量的数值进行平方根处理, 建立种类×站位矩阵, 利用PRIMER 6软件非加权组平均法进行等级聚类和非度量多维标度(NMDS), NMDS的优劣使用协强系数判定, 协强系数在(0, 0.01)之间, 结果完全可信; 在(0.01, 0.05)之间, 结果可信; (0.05, 0.10)之间, 基本可信; (0.10, 0.20)之间, 结果有一定参考价值, 可用二维图表示; >0.20, 结果几乎是任意的, 不能在二维图上展示[13]。
采用相似性百分比分析(SIMPER)探究不同物种对群落相异性和相似性的贡献率。采用相似性分析检验(ANOSIM)进行显著性检验,=0, 表示完全相同; 在(0, 0.5)之间, 表示差异不显著; 在(0.5, 0.75)之间, 表示虽有重叠, 但可以清楚分开; 在(0.75, 1)之间, 表示差异显著;=1, 表示完全不同。显著性水平为<0.05[14]。
(4) DCCA
使用DCCA 排序来解释物种与环境间的内在联系, 揭示游泳动物对不同环境因子(生物的和非生物的)的适应性特征[15]。
(5) 数据处理
不同站点间生物量的比较采用单因素方差分析(one-way ANOVA), 并作双尾t检验, 以<0.05为显著相关。
2 结果与分析
2.1 种类组成
本研究8航次调查共捕获游泳动物85种, 鱼类55种, 属于8目29科49属; 甲壳类25种, 属于2目22科25属; 头足类5种, 属于3目3科3属, 见表1。
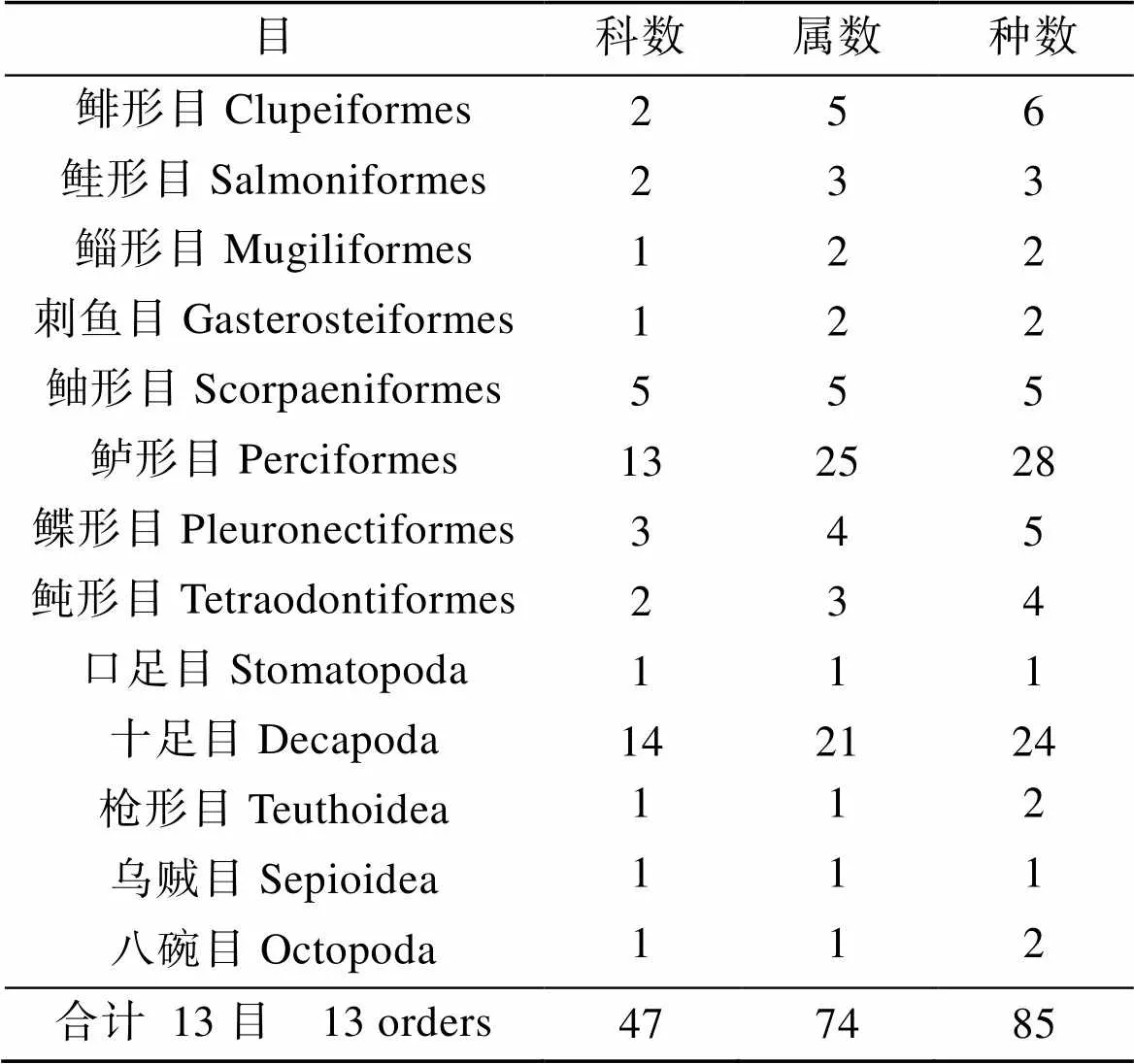
表1 2010—2011年莱州湾调查游泳动物组成
2.2 生物量及组成的季节变化
2011年调查海域相对生物量(52.3 kg/h)高于2010年(41.3 kg/h), 但年间差异不显著(= –1.186,>0.05)。生物量季节间差别较大, 根据相同季节2年平均值计算, 各季节生物量排序为夏季>秋季>冬季>春季, 生物量均值季节差异显著(ANOVA,<0.001)。夏季生物量与相同年份其他3季生物量差异均显著, 春季与冬季生物量差异不显著, 2010年秋季与春、冬季差异不显著, 而2011年秋季与春、冬季差异则为显著。相同季节生物量虽有差别, 春、夏、秋季生物量的年间差异均不显著, 仅秋季存在显著差异(图2a)。
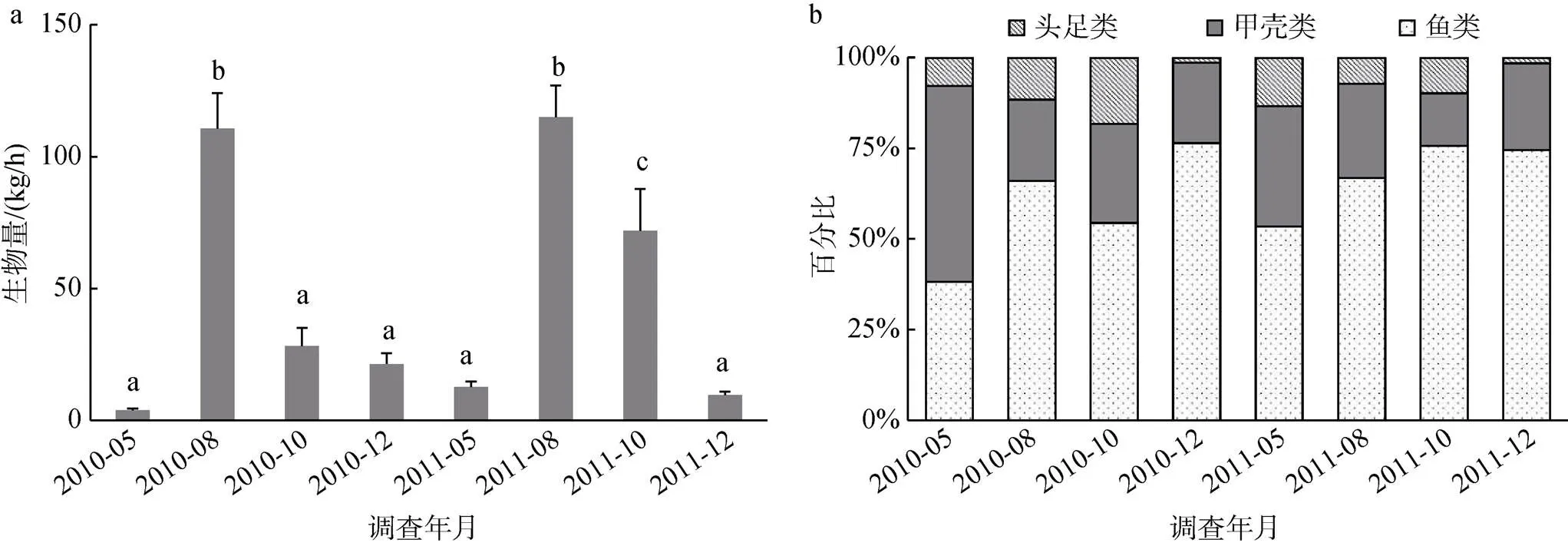
图2 莱州湾游泳动物相对生物量(kg/h)的均值(+标准误差)。
注: a: 相对生物量(kg/h); b: 生物量百分比(%); 相同小写字母代表处理间差异不显著(>0.05)
除2010年春季甲壳类生物量高于鱼类, 其他季节均为鱼类生物量最高(生物量百分比均超过50%), 甲壳类次之, 头足类最低。生物量季节间的变化主要是由于鱼类生物量的季节变化导致的, 冬季鱼类生物量比例达到全年最高, 而春季最低, 甲壳类和头足类生物量的季节变化幅度较小(图2b)。
2.3 生物量空间分布
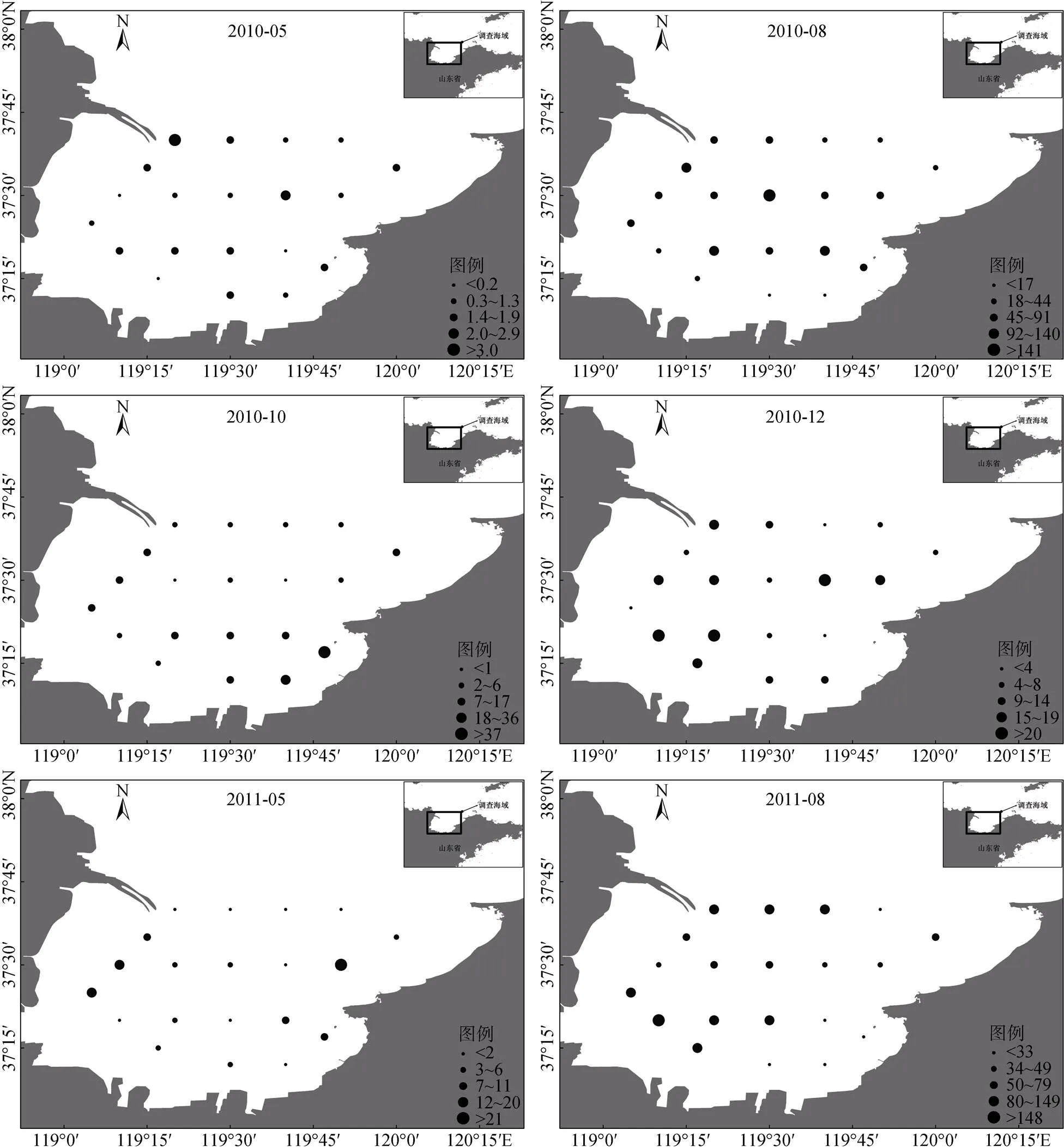
从游泳动物生物量空间分布可以看出(图3), 在多数季节湾底水域生物量偏低, 而黄河口南侧海域生物量较高, 存在一定的异质性。从全年调查平均值来看, 莱州湾西侧游泳动物生物量(60.2 kg/h)明显高于东侧(33.4 kg/h;=4.597,<0.001)。
2.4 群落划分
根据8航次31个主要种类生物量聚类, 莱州湾20调查站位可划分为4组, 协强系数(2D stress=0.14), 表明所有NMDS排序结果在二维空间上是可信的。组I由位于调查海域东南的3个站位组成, 组II位于调查海域东部及中部的8个站位组成, 组III由调查海域西北部(黄河口南侧)的3个站位组成, 组IV由西部6个站位组成(图4)。组I浮游植物丰度、浮游动物生物量、游泳动物生物量、游泳动物多样性指数在各组中均最低, 而底栖动物生物量最高; 组III和组IV的浮游植物丰度、浮游动物生物量、游泳动物生物量高于组I和组II(表2)。鮻()、石鲽()在组I中比例明显高于其他3组; 短蛸()、日本褐虾()、黄鳍刺虾虎鱼()在组II中比例明显高于其他3组; 短吻红舌鳎()、方氏锦鳚()、葛氏长臂虾()、脊尾白虾()、青鳞小沙丁鱼()、日本鼓虾()在组III的比例明显高于其他3组; 斑鰶(、赤鼻棱鳀()、黄鲫()、脊尾白虾、口虾蛄()、皮氏叫姑鱼()、中国明对虾()在组IV中比例明显高于其他三组。斑尾刺虾虎鱼()、枪乌贼(sp.)、鲬()、日本蟳()、疣背深额虾()在各组中比例较为接近。
ANOSIM分析表明, 所有组间值均小于0.5, 显著水平也多在可接受范围(<0.5%, 除组III&组IV外), 表明组间群落结构虽有不同, 但差异并不显著(表3)。SIMPER分析表明, 斑尾刺虾虎鱼、枪乌贼和日本蟳对4个组的组内相似性贡献均较高; 矛尾虾虎鱼()、口虾蛄和短吻红舌鳎对组II、组III和组IV组内相似性贡献较高; 斑鰶对组I、组III和组IV的组间相似性贡献较高。日本褐虾对组I相似性较高, 而葛氏长臂虾、脊尾白虾和青鳞小沙丁鱼对组IV相似性贡献较高(表4)。
2.5 调查站位和环境因子DCCA排序
图5为各调查站位游泳动物生物量(圆圈)与环境因子DCCA排序图。温度、盐度、底栖动物生物量以及浮游植物丰度是影响群落的重要因子, 无机磷对群落影响较小。由表5可以看出, 与环境第一排序轴相关系数较高的是温度(–0.939 8)和盐度(–0.321 5), 与环境第二排序轴密切相关的是浮游植物丰度(0.477 8)和底栖动物生物量(–0.406 4)。
3 讨论
3.1 生物量及组成的变化
群落总生物量(Total biomass)的变化是反映群落功能变化的一个最简单、最直接的指标[16]。与历史调查结果相比, 目前莱州湾游泳动物生物量发生了明显变化。
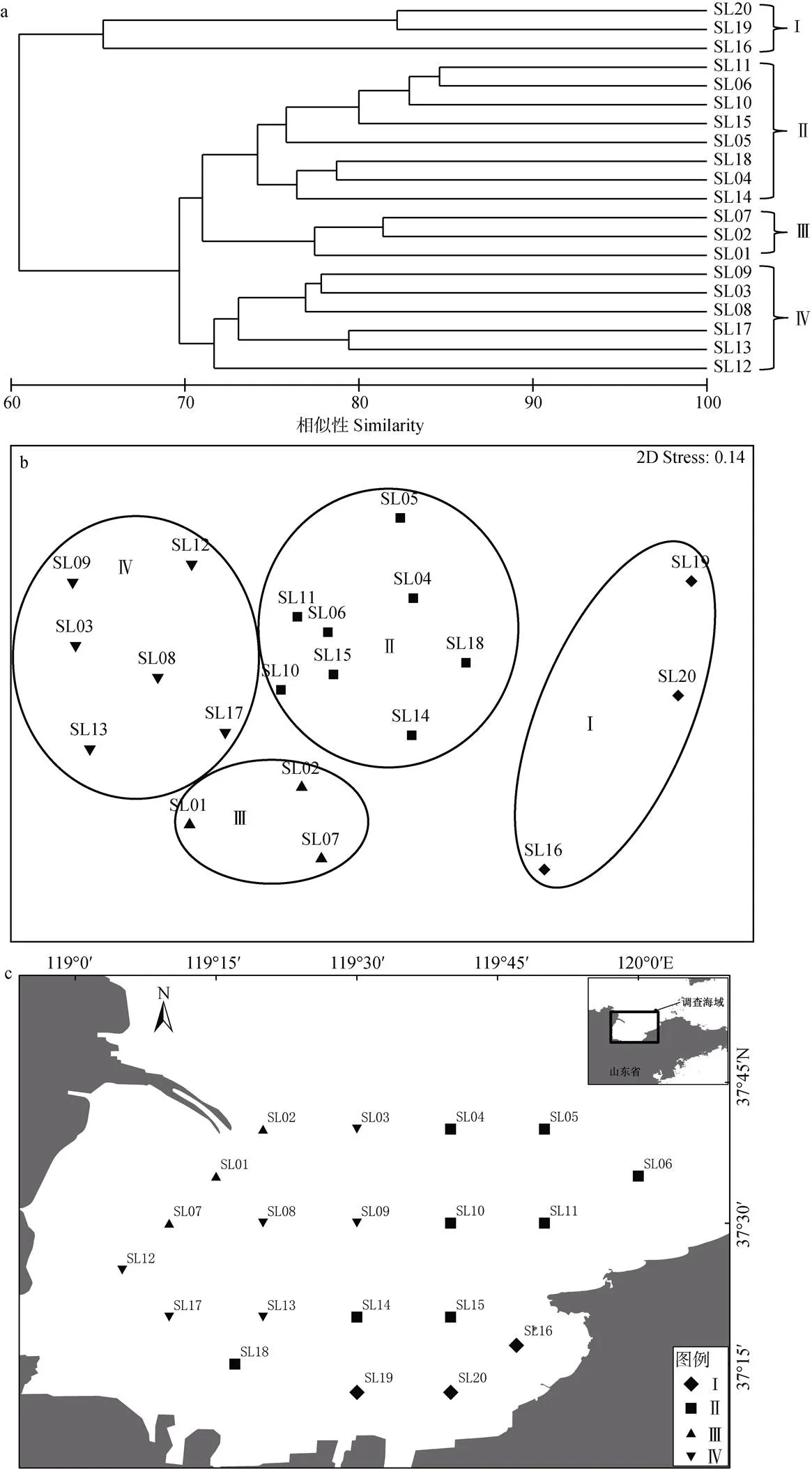
图4 莱州湾游泳动物调查站位聚类图(a)、NMDS排序图(b)和空间分布图(c)
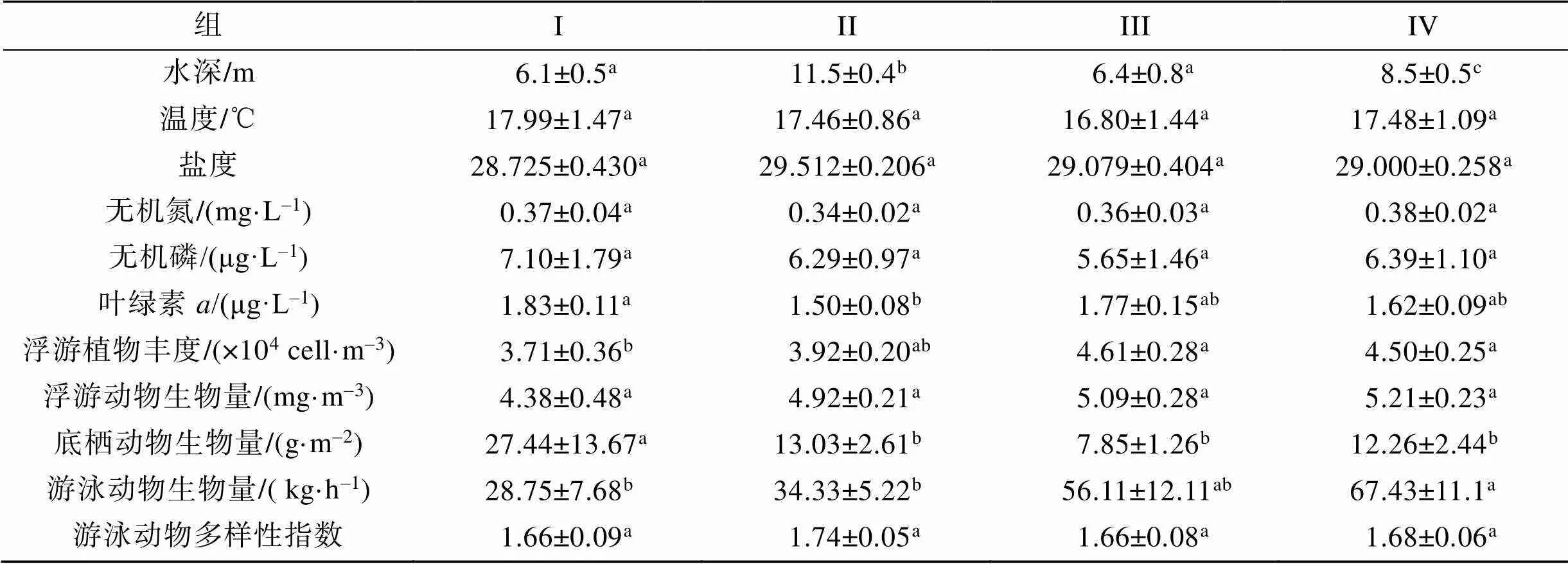
表2 莱州湾调查站位组间差别
注: 同一行比较, 相同字母为差异不显著, 有不同字母为差异显著(<0.05)
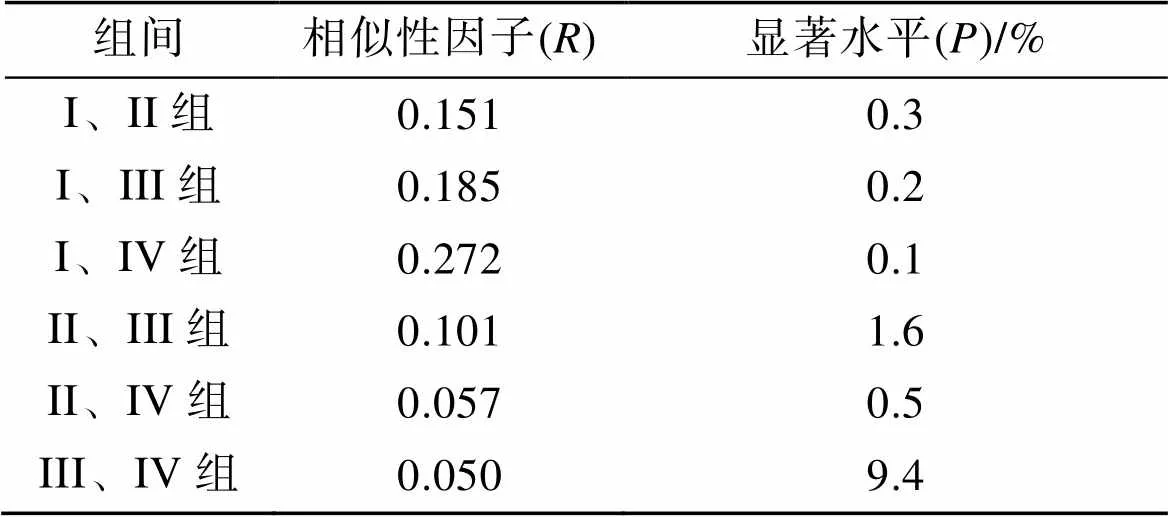
表3 莱州湾游泳动物群落单因子相似性分析
总生物量整体上处于较低水平, 其中只有夏季能达到2 t/km2, 其余季节均小于1 t/km2; 春季生物量下降尤为严重, 仅0.2 t/km2左右。相关研究表明, 渤海春季鱼类生物量由1959年的186 kg/h降到了2010年的不足1 kg/h[8]。春季资源状况不佳, 也导致春季几乎没有渔船在莱州湾生产。莱州湾游泳动物生物量自1959至1998年间的4次调查呈逐次下降趋势, 特别是春季生物量下降幅度大[2]。生物量的急剧下降与主要经济物种资源衰退有直接关系, 渤海海域主要渔业资源表现出小型化和低龄化的发展趋势[9]。张波等[17]研究发现, 饵料生物优势种的演替也是导致渔业资源生物量和种类变动的重要原因, 还导致其生态位发生变化。另外, 海域环境恶化引起鱼类繁殖能力、幼体存活率和种群增长率的急剧下降, 严重影响了渔业资源的补充量, 进而导致生物量的降低。
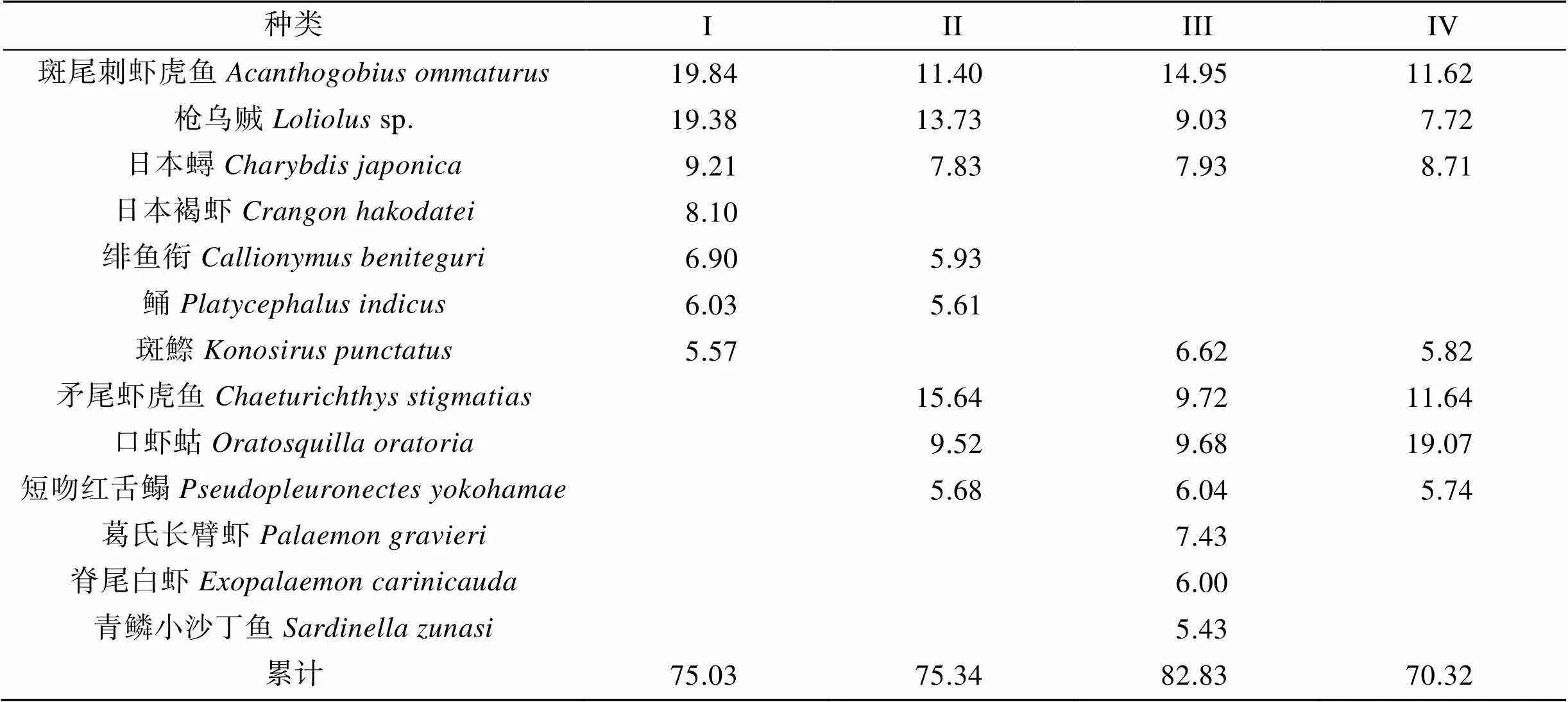
表4 根据SIMPER分析得到的群落类型中对平均相似性的贡献率>5%的主要特征种类
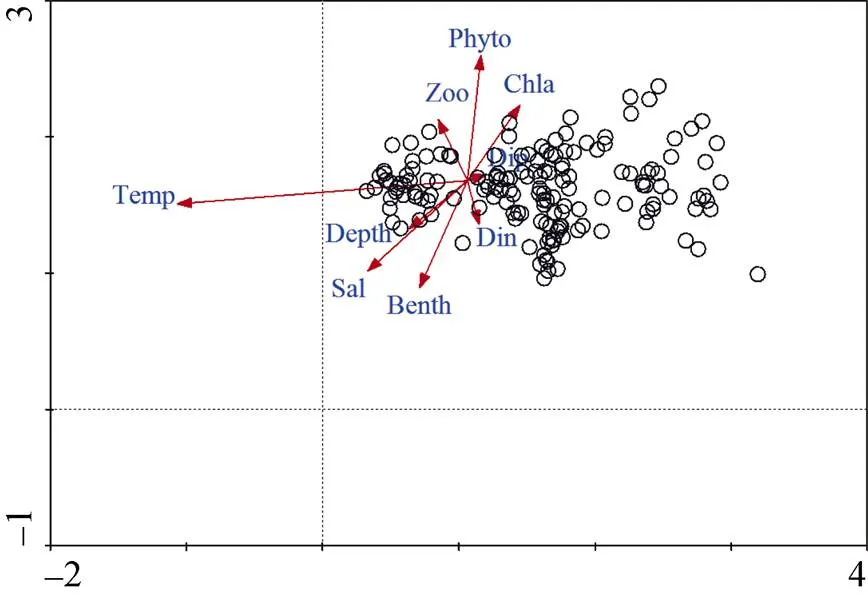
图5 莱州湾环境因子与游泳动物生物量的DCCA排序
注: Depth: 水深; Temp: 温度; Sal: 盐度; Din: 无机氮浓度; Dip: 无机磷浓度; Chl: 叶绿素浓度; Phyto: 浮游植物丰度; Zoo: 浮游动物生物量; Benth: 底栖动物生物量; ○为调查站位游泳动物生物量
与1959—1998年调查结果[2, 5]对比后发现, 目前莱州湾游泳动物生物量低于1992年之前的历次调查, 但高于1998年调查值。相关研究表明, 2003年、2006年、2008年莱州湾春季渔业资源均高于1998年春季[9], 21世纪后, 莱州湾游泳动物资源较20世纪90年代末期有所恢复。这可能与自上世纪80年代末陆续实施的多项渔业资源管理措施有一定关系, 如1988年拖网渔业退出渤海, 1995年开始的伏季休渔, 以及蓝点马鲛、中国明对虾、海蜇()等单种渔业资源专项管理措施等, 同时自2005年山东省开始实施渔业资源修复行动计划以来, 对资源修复起到了一定作用。但目前生物量主要依靠幼鱼和低营养级种类(相同的初级生产力可以支撑更高的生物量)支撑, 资源仍远未达到完全修复的程度。相关研究[8]也表明增殖放流种类资源量远低于历史最高资源量, 资源恢复尚有很大空间。
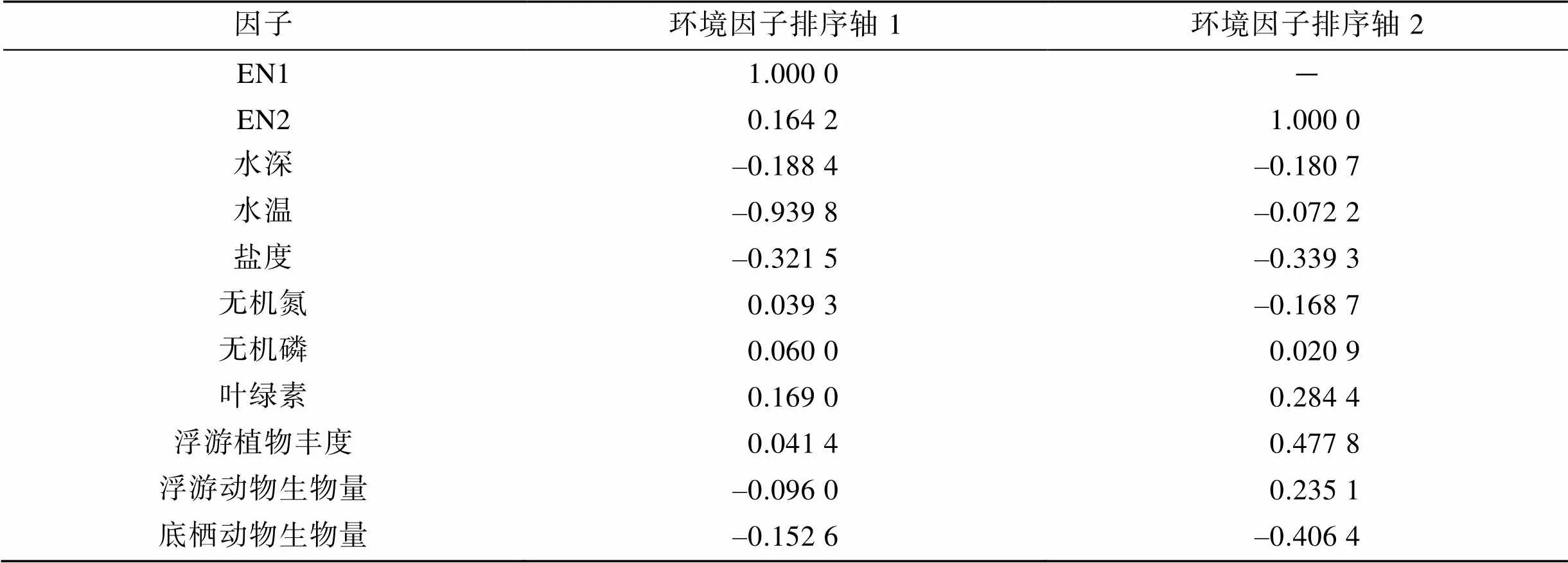
表5 环境因子与前两个排序轴的相关系数
本次调查结果显示, 莱州湾游泳动物生物量的季节分布发生了较大程度的改变, 夏季最高, 春季最低。1959年春季生物量明显高于夏、秋季, 春季生物量主要由带鱼()、小黄鱼()的产卵群体贡献[2], 而目前春季带鱼、小黄鱼生物量比例几乎可以忽略(调查未捕获带鱼, 小黄鱼在2011年春季航次中出现, 占生物量比例的0.42%), 而这一时期莱州湾主要游泳动物如斑鰶和青鳞小沙丁鱼等尚未大量进入莱州湾, 同期多数斑尾刺虾虎鱼个体在繁殖后已经死亡, 造成春季生物量较低。夏季是目前一年中生物量最高的季节, 这要由当年生幼鱼贡献(得益于伏季休渔对当年生幼鱼的保护)。目前秋季生物量明显低于夏季, 可能与休渔结束后大量个体被捕捞, 以及部分种类洄游离开有关。莱州湾渔业赖以成名的春汛、秋汛早已消失, 目前莱州湾渔业生产主要集中在夏季、秋季, 目标种类主要为增殖放流资源种类——中国明对虾、三疣梭子蟹()和海蜇, 其它种类基本不能形成专捕渔业(未发表数据)。
底层鱼类生物量比例下降趋势有所逆转, 小型无脊椎动物比例升高。自1959年至1998年, 莱州湾中上层鱼类比例呈不断上升趋势, 底层鱼类比例则不断下降[2]。而目前中上层鱼类比例较1998年有所下降, 底层鱼类比例有所上升, 各类别生物量比例与1992年较为接近。与历史调查值相比, 目前头足类比例处于较高水平, 枪乌贼(火枪乌贼和日本枪乌贼)在某些季节甚至成为优势种。2011和2011年各类别生物量比例有所差异, 但主要是青鳞小沙丁鱼在2年间生物量的巨大差异所导致的。
3.2 莱州湾游泳动物群落异质性
游泳动物群落时空分布的异质性与海水环境、饵料生物、洄游、海底地貌等因素均密切相关[10, 18-19]。本文DCCA分析表明, 温度是影响莱州湾游泳动物时空分布的最主要因素, 这主要是由于莱州湾游泳动物种类主要以暖温种为主, 随着季节变化, 种类和生物量因洄游鱼类进出而发生较大改变; 底栖动物生物量也是影响游泳动物群落的重要因子之一, 张波等的研究也证实底栖动物在目前莱州湾生态系统的食物关系中起关键作用[17]; 而水深并不是影响莱州湾游泳动物群落的主要环境因子, 这与莱州湾水深较浅、水深梯度变化较小(最深水深仅18 m, 大部分水深在10 m以内)有关。
根据主要种类生物量聚类, 莱州湾游泳动物群落可划分为4个组。组I位于莱州湾东南部, 底质以粉砂质砂为主, 处于扇贝筏式养殖区和单环刺螠渔业作业区边缘, 与其他组相比, 组I种类数、生物量以及Shannon-Wiener多样性明显偏低, 李少文等的研究表明该区域底栖生物种类数和多样性也明显偏低, 而次级生产力明显偏高, 表明游泳动物、底栖生物群落受到了明显干扰[20]。组II的8个站位主要位于湾东北部(龙口周边海域), 该组站位底质以矿质粉砂为主且复杂多变, 水深较深, 海水环境质量较好(2010年、2011年山东省海洋环境公报), 组II是游泳动物多样性最高的组, 黑棘鲷()、许氏平鲉()和大泷六线鱼()等恋礁鱼类以及喜穴居的蛸类(长蛸、短蛸)等对生境要求高的种类在主要出现于该组。组III的3个站位位于离黄河口最近的区域, 脊尾白虾、青鳞小沙丁鱼偏好在此聚集, 底栖动物生物量较低, 底栖动物食性的石鲽、绯鱼衔()生物量明显低于其他组; 组IV由靠近小清河口的2个站位和莱州湾中央的4个站位组成, 底质以粉砂质黏土为主, 海水富营养化最严重(2010年、2011年山东省海洋环境公报), 在各组中游泳动物生物量最高, 但多样性偏低, 该组浮游动物生物量较高, 斑鰶、赤鼻棱鳀等浮游动物食性鱼类生物量高。
ANOSIM分析表明聚类各组之间虽有差异, 但差异不显著(表4), 总体而言, 莱州湾游泳动物群落的时空分布异质性处于较低水平。这与黄海山东海域(鱼类群落可明显区分为近岸浅水区和远岸深水区2个不同的组[6])和北部湾(鱼类群落各季节均可划分为5个较为稳定的组[10])明显不同。莱州湾游泳动物群落异质性较低, 可能与莱州湾自然环境、气候变化和人为影响密切相关。
1) 与黄海山东海域和北部湾等海域相比, 莱州湾面积较小(仅6 215.4 km2), 水深变化梯度小; 作为半封闭海湾-渤海的一部分, 莱州湾水交换周期长, 约为0.5年[21]。
2) 作为影响莱州湾最大的河流—黄河, 受上游大型水利工程建设以及沿岸工农业用水的影响, 入海径流量不断减少, 并发生数次断流, 虽然自2002年实施调水调沙以来, 黄河断流已不复存在, 但径流量仍较小, 这也造成莱州湾淡水水体面积较小[22], 整个湾内盐度较高且盐度梯度较小。浑浊度高、营养丰富的低盐水体生境, 不仅可为渔业资源早期生活史阶段提供足够的食物, 同时也是肉食性鱼类的天然屏障, 为幼鱼良好的育幼场和庇护场。低盐水体的减少和大型水利工程对洄游通道的破坏, 加剧了生境的单一程度, 导致河口种和河道洄游种基本绝迹, 降低了游泳动物群落格局异质性。
3) 莱州湾是传统捕捞作业区, 捕捞压力大, 过度捕捞导致群落特有种灭绝,-选择型种类成为优势种, 这些种类在单一生境下广为分布。同时, 对底栖环境破坏严重的网具底拖网、弓子网等被大量使用, 加剧了底质荒漠化和生境同质化程度。近岸滩涂、浅海养殖以及围填海、旅游开发、海岸工程对海岸带的侵占, 导致岩礁、海草场等特有生境消失。而海水富营养加剧, 氮磷比不断升高, 改变了浮游植物群落结构, 食物链朝向不利于渔业资源种类、有利于大型水母的方向发展[23], 大型水母暴发会大量摄食鱼卵仔鱼, 选择压力, 加剧了-选择种的生存压力, 进一步降低游泳动物群落异质性。
4 结论
综上, 自然环境特点、气候变化和人为影响导致莱州湾生境异质性程度较低, 对生境要求较高的种类(如河道洄游种、河口种、软骨鱼类、岩礁鱼类等)不利, 从而造就了目前莱州湾较低的游泳动物群落异质性。根据生态学基本原理, 丰富的小生境将增加群落格局异质性和生物多样性, 合理发展海洋牧场, 包括集鱼型鱼礁、海草场和海藻场, 可提高生境异质性程度, 对生物多样性保护和资源修复具有积极意义。
[1] Jin X S, Tang Q S. Changes in fish species diversity and dominant species composition in the Yellow Sea[J]. Fisheries Research, 1996, 26(3-4): 337-352.
[2] 金显仕, 邓景耀. 莱州湾渔业资源群落结构和生物多样性变化[J]. 生物多样性, 2000, 8(1): 65-72. Jin Xianshi, Deng Jingyao. Variations in community structure of fishery resources and biodiversity in the Laizhou Bay, Shandong[J]. Biodiversity Science, 2000, 8(1): 65-72.
[3] 山东省海洋与渔业厅. 山东省海洋环境公报[R]. 济南: 山东省海洋与渔业厅, 2010. Shandong Provincial Department of Oceans and Fisheries. Marine Conditions of Shandong[R]. Jinan: Shandong Provincial Department of Oceans and Fisheries, 2010.
[4] 金显仕, 邓景耀. 莱州湾春季渔业资源及生物多样性的年间变化[J]. 海洋水产研究, 1999, 20(1): 6-12. Jin Xianshi, Deng Jingyao. Yearly variations of fishery resources and biodiversity in the Laizhou Bay[J]. Progress in Fishery Sciences, 1999, 20(1): 6-12.
[5] 邓景耀, 金显仕. 莱州湾及黄河口水域渔业生物多样性及其保护研究[J]. 动物性研究, 2000, 21(1): 76-82. Deng Jingyao, Jin Xianshi. Study on fishery biodiversity and its conservation in Laizhou Bay and Yellow River estuary[J]. Zoological Research, 2000, 21(1): 76-82.
[6] 王平, 焦燕, 任一平, 等. 莱州湾、黄河口水域春季近岸渔获生物多样性特征的调查研究[J]. 海洋湖沼通报, 1999, (1): 40-44. Wang Ping, Jiao Yan, Ren Yiping, et al. Investigation of biodiversity from spring catch in coastal waters of Laizhou Bay and Huanghe estuary[J]. Transactions of Oceanology and Limnology, 1999, (1): 40-44.
[7] 陈大刚, 沈谓铨, 刘群, 等. 莱州湾及黄河口水域地理学特征与鱼类多样性[J]. 中国水产科学, 2000, 7(3): 46-52. Chen Dagang, Shen Weiquan, Liu Qun, et al. The geographical characteristics and fish species diversity in the Laizhou Bay and Yellow River estuary[J]. Journal of fishery sciences of China, 2000, 7(3): 46-52.
[8] 单秀娟, 金显仕, 李忠义, 等. 渤海鱼类群落结构及其主要增殖放流鱼类的资源量变化[J]. 渔业科学进展, 2012, 33(6): 1-9. Shan Xiujuan, Jin Xianshi, Li Zhongyi, et al. Fish community structure and stockdynamics of main releasing fish species in the Bohai Sea[J]. Progress in Fishery Sciences, 2012, 33(6): 1-9.
[9] Jin X S, Shan X J, Li X S, et al. Long-term changes in the fishery ecosystem structure of Laizhou Bay, China[J]. Science China Earth Sciences, 2013, 56: 366-374.
[10] Li F, Zhang H J, Lü Z B, et al. Species composition and community diversity of nekton in Laizhou Bay, China[J]. Biodiversity Science, 2013, 21: 537-546.
[11] 詹秉义. 渔业资源评估[M]. 北京: 中国农业出版社, 2000. Zhan Bingyi. Fisheries Resources Assessment[M]. Beijing: Agriculture Press of China, 2000.
[12] Bray T R, Curtis J T. An ordination of the upland forest communities of southern Wisconsin[J]. Ecological Monographs, 1957, 27(4): 325-349.
[13] 张涛, 庄平, 章龙珍, 等. 长江口中华鲟自然保护区底层鱼类的群落结构特征[J]. 生态学报, 2011, 31(6): 1687-1694. Zhang Tao, Zhuang Ping, Zhang Longzhen, et al. Community structure of demersal fish in Nature Reserve of Acipenser sinensis in Yangtze River estuary[J]. Acta Ecologica Sinica, 2011, 31(6): 1687-1694.
[14] Clarke K R, Warwick R M. A further biodiversity index applicable to species lists: variation in taxonomic distinctness[J]. Marine Ecology Progress Series, 2001, 216: 265-278.
[15] 张金屯. 数量生态学(第二版)[M]. 北京: 科学出版社, 2011. Zhang Jintun. Quantitative Ecology (Second Edition)[M]. Beijing: Science Press, 2011.
[16] 程家骅, 姜亚洲. 捕捞对海洋鱼类群落影响的研究进展[J]. 中国水产科学, 15(2): 359-366. Cheng Jiahua, Jiang Yazhou. Methods for evaluating fishing effects on fish community[J]. Journal of Fishery Sciences of China, 15(2): 359-366.
[17] 张波, 吴强, 金显仕. 莱州湾鱼类群落的营养结构及其变化[J]. 渔业科学进展, 2013, 34(2): 1-9. Zhang Bo, Wu Qiang, Jin Xianshi. Feeding ecology of fish assemblages and its variations in the Laizhou Bay[J]. Progress in Fishery Sciences, 2013, 34(2): 1-9.
[18] 李圣法, 程家骅, 严利平. 东海大陆架鱼类群落的空间结构[J]. 生态学报, 2007, 27(11): 4377-4386. Li Shengfa, Cheng Jiahua, Yan Liping. Spatial structures of fish communities on the continental shelf of the East China Sea[J]. Acta Ecologica Sinica, 2007, 27(11): 4377-4386.
[19] 任一平, 徐宾铎, 叶振江, 等. 青岛近海春、秋季渔业资源群落结构特征的初步研究[J]. 中国海洋大学学报(自然科学版), 2005, 35(6): 792-798. Ren Yiping, Xu Binduo, Ye Zhenjiang, et al. Preliminary study on community structure of fishery resources during spring and autumn in the coastal waters of Qingdao[J]. Periodical of Ocean University of China, 2005, 35(6): 792-798.
[20] 李少文, 刘元进, 李凡, 等. 莱州湾大型底栖动物功能群现状[J]. 生态学杂志, 2013, 32(2): 380-388. Li Shaowen, Liu Yuanjin, Li Fan, et al. Macrobenthic functional groups in Laizhou Bay, East China[J]. Chinese Journal of Ecology, 2013, 32(2): 380-388.
[21] 魏皓, 田恬, 周锋, 等. 渤海水交换的数值研究–水质模型对半交换时间的模拟[J]. 青岛海洋大学学报 (自然科学版), 2002, 32(4): 519-525. Wei Hao, Tian Tian, Zhou Feng, et al. Numerical study on the water exchange of the Bohai Sea: simulation of the half -life time by dispersion model[J]. Periodical of Ocean University of Qingdao, 2002, 32(4): 519-525.
[22] 肖纯超, 张龙军, 杨建强. 2004—2009年黄河口近岸海域低盐区面积的变化趋势研究[J]. 中国海洋大学学报 (自然科学版), 2012, 42(6): 40-41. Xiao Chunchao, Zhang Longjun, Yang Jianqiang. Study on the change of low-salinity area in the Yellow River Estuary and its coastal zone from 2004 to 2009[J]. Periodical of Ocean University of China, 2012, 42 (6): 40-41.
[23] 许思思, 宋金明, 李学刚, 等. 渔业捕捞对渤海渔业资源及生态系统影响的模型研究[J]. 资源科学, 2011, 33(6): 1153-1162. Xu Sisi, Song Jinming, Li Xuegang, et al. Modeling of fishing effects on fishery resources and ecosystems of the Bohai Sea[J]. Resources Science, 2011, 33(6): 1153-1162.
Community structure of nektons in Laizhou Bay, China
ZHANG Huan-jun1, LIU Shu-de2, LIU Yuan-jin1, TU Zhong2, ZHOU Quan-li1, CHEN Wei1, SUN Wei1, LI Fan1
(1. Shandong Marine Resources and Ecology Research Institute, Shandong Provincial Key Laboratory of Restoration for Marine Ecology, Yantai 264006, China; 2. Shandong Hydrobios Resources Conservation and Management Center, Yantai 264003, China)
Based on the data of 8 cruises in spring (May), summer (August), Autumn(October) and winter (December) in 2010 and 2011, the community pattern of nekton and its relationship with environmental factors in Laizhou Bay were studied. Overall, a total of 85 species of nekton were caught, the values of nekton biomass were higher in 2011 than in 2010. The biomass had a great difference between seasons, and the order of the biomass was summer, autumn, winter and spring. The biomass of the same season had no significant difference in different years except autumn. In all surveys except in the spring of 2010, the biomass of fishes was highest, followed by that of crustaceans and cephalopods. Nekton biomass was significantly higher in the western half of the bay (60.2 kg/h) than in the eastern half (33.4 kg/h). We grouped the biomass values of 31 main species of nekton captured at the 20 stations by cluster analysis: group I comprised the southeastern areas (three stations); group II comprised the eastern and middle areas (eight stations); group III comprised the northwestern areas (three stations); and group IV comprised the western areas (six stations). Group I had the lowest phytoplankton abundance, zooplankton biomass, and nekton biomass and diversity, but had the highest macrobenthos biomass. Phytoplankton abundance, zooplankton biomass, and nekton biomass were higher in groups III and IV than in groups I and II. The analysis of similarities revealed different community structures among the four groups; however, there were no significant differences. Detrended canonical correspondence analysis showed that temperature, salinity, benthic biomass, and phytoplankton abundance are the significant factors affecting nekton communities. The nekton community of Laizhou Bay has changed remarkably as compared with its previous survey values: total nekton biomass was at relatively low levels, especially in spring; seasonal distributions of biomass had become even lower in spring and higher in summer; and a downward trend in the proportion of demersal fishes had somewhat reversed. The nekton community now appears more homogeneous, possibly because of an increasingly homogeneous environment and the severe effects of human activities.
biomass; cluster analysis; NMDS; DCCA
Dec. 6, 2019
S931
A
1000-3096(2020)06-0110-12
10.11759/hykx20191206001
2019-12-06;
2020-03-05
山东省渔业资源增殖效果评价项目(SD-XGPJ-2012-2); 山东省重点研发计划(2018GHY115014)
[Evaluation on the effect for fishery enhancement and releasing of Shandong Province, No. SD-XGPJ-2012-2; Key Research and Development Program of Shandong Province, No. 2018GH115014]
张焕君(1979-), 男, 汉族, 山东威海人, 硕士研究生, 副研究员, 主要从事渔业资源与生态研究, 电话: 18153518135, E-mail: hjzhang815@163.com;李凡,通信作者, 电话: 18153518186, E-mail: lifan811230@126.com
(本文编辑: 杨 悦)
