淫羊藿苷对藻酸盐3D体外培养下小鼠软骨细胞周期蛋白、β-catenin表达的影响
2020-06-28王鹏珍熊喜峰秦胜男张金丽李爱国
王鹏珍,熊喜峰,秦胜男,张金丽,李爱国
广州市红十字会医院 广州市创伤外科研究所,广州510000
损伤关节软骨的重塑和修复,需要足量、有活性的关节软骨细胞[1,2]。关节软骨是无血管和高度特异化的组织,内衬在活动关节表面。软骨层可以降低关节面之间的摩擦,并可以起到缓冲减震、承载压力的作用[3]。值得注意的是,关节软骨一旦发生损伤,其固有的无血管、低细胞密度和低细胞迁移能力的特点都会限制软骨组织的再生。如何获得大量活性高、增殖能力强的软骨细胞,在细胞治疗关节软骨损伤的过程中起关键作用[4,5]。文献报道,适宜浓度的淫羊藿苷(ICA)可以显著促进关节软骨细胞增殖并提高细胞活性[2,6];我们的前期研究中也发现,ICA在10-6μmol/L 时可以显著促进原代小鼠关节软骨细胞增殖[7]。但是,其具体作用机制尚不清楚。2019年3~12月,我们拟在软骨细胞-藻酸盐3D培养条件下,研究ICA对体外小鼠关节软骨细胞增殖相关蛋白Cyclin D1、Cyclin E、β-catenin表达的影响,旨在为ICA用于细胞工程治疗骨关节炎提供理论基础。
1 材料与方法
1.1 主要材料 ICA购于北京北奥创新科技有限公司,批号为20090503,经HPLC测定ICA 含量不低于98%;出生2 d的C57BL/6雄性小鼠均购自广东省医学实验动物中心,许可证号SCXK-2013-0002,本实验设计及过程均符合本院动物伦理委员会规定。DMEM完全培养基,含10% 小牛血清、100 U/mL青/链霉素、20 mmol/L L-谷氨酰胺;Ⅰ型胶原酶(9001-12-1,Sigma),D型胶原酶(11088866001,Roche)。抗兔HRP/DAB 免疫试剂盒批号(b64261,Abcama),兔抗鼠β-catenin(sc-7963,Santa Cruz),兔抗鼠Cyclin D1 (sc-2978,Santa Cruz),兔抗鼠Cyclin E(sc-2925, Santa Cruz);荧光定量PCR试剂盒TB Green Premix ExTaq Ⅱ (RR066A, Takara),荧光定量PCR仪(qTOWER 2.2,Analytik Jena AG)。
1.2 实验方法
1.2.1 软骨细胞的分离和培养 参考本课题组前期文献的操作方法[7],取新生2 d的小鼠关节软骨组织;用0.7 mg/mL的Ⅰ型胶原酶消化30 min,移入含0.7 mg/mL Ⅰ型胶原酶和3 mg/mL D型胶原酶的PBS混合液中,37 ℃消化6 h。用直径180 mm的滤膜过滤消化下来的软骨细胞,离心后用PBS洗3次,将细胞重悬在DMEM完全培养基中;在5% CO2、37 ℃条件下培养,每3 d换液1次[8,9]。
1.2.2 藻酸盐3D复合体构建及冰冻切片制作 原代软骨细胞用胰酶消化后,用 2%(w/v)灭菌的藻酸盐溶液重悬细胞,制成1×106/mL 的细胞悬液,吹打均匀;吸取20 μL滴入装有102 mmol/L 无菌CaCl2溶液的6孔板中,藻酸盐与软骨细胞很快凝结成三维复合物;待复合物形状稳定后,小心吸走无菌CaCl2溶液;将复合物分为两组,ICA组和对照组分别加入含10 μmol/L ICA 、不含ICA的DMEM完全培养基,每组设3个复孔;在37 ℃、5% CO2的培养箱中培养14 d,培养基每3 d更换1次。软骨细胞-藻酸盐3D复合物用PBS洗涤3次后,分为3份样品。其中2份放入 4%多聚甲醛中固定,制作冰冻切片,切片厚度为 4 μmol/L,-80 ℃冰箱保存,用于阿利新蓝组织学染色、免疫组化实验;另外1份样品中加TRIzol裂解,进行RNA提取,用于荧光定量PCR实验。
1.2.3 软骨细胞活性和酸性黏多糖合成情况观察 采用阿利新蓝组织学染色[10]。将冰冻切片从冰箱中取出,复温5 min;用PBS洗涤3次,每次5 min。将切片放入1%阿利新蓝染液中,染色10 min;用PBS洗涤3次,每次5 min。最后进行封片及镜检,依次进行梯度乙醇脱水,二甲苯透明,中性树胶封片,于倒置显微镜下观察拍照。成簇状排列的软骨细胞增多表示软骨细胞活性增加,阿利新蓝染色强度加深表示软骨细胞酸性黏多糖合成增加。
1.2.4 软骨细胞中Cyclin D1、Cyclin E、β-catenin蛋白检测 采用免疫组化法。将冰冻切片从冰箱中拿取出,复温5 min;PBS洗3次,每次5 min;3% H2O2孵育10 min,PBS洗3次,每次5 min。常温下,血清封闭45 min。用滤纸吸去封闭液,直接滴加兔多克隆抗Cyclin D1(1∶3 000)、Cyclin E(1∶3 000)、β-catenin(1∶3 000)一抗工作液,4 ℃过夜,IgG作为阴性对照。次日,PBS洗3次,每次3 min。HRP标记二抗室温下孵育 30 min。PBS 洗3次,每次3 min。DAB显色5 min,自来水终止反应。PBS洗3次,每次3 min。苏木素复染核30 s,自来水冲洗,封片及镜检。梯度乙醇脱水,二甲苯透明,中性树胶封片,用倒置显微镜下观察拍照。在显微镜下,随机选择组织切片的3个视野计数阳性细胞和总细胞,细胞内有目标蛋白表达且呈棕色为阳性细胞[9]。蛋白阳性表达率=阳性细胞/总细胞×100%。
1.2.5 软骨细胞中Cyclin D1、Cyclin E、β-catenin mRNA检测 采用荧光定量PCR法。用TRIzol试剂盒对样品进行RNA抽提,用Nanodrop 2000分光光度计测定RNA浓度;将PrimeScriptTMMaster Mix试剂盒RNA进行逆转录,合成cDNA。用TB GreenTMPremix Ex TaqTM进行荧光定量分析,反应程序采用两步法。反应条件:95 ℃预变性30 s,95 ℃变性5 s;60 ℃退火及延伸 34 s。以β-actin作为内参[10],用2-△△Ct对mRNA表达进行相对定量分析。目的基因引物序列见表1。

2 结果
2.1 两组软骨细胞活性和酸性黏多糖合成情况 ICA组成簇状排列的软骨细胞明显多于对照组,阿利新蓝染色强度明显深于对照组,并可见大量酸性黏多糖集聚与软骨陷窝及周边,表明ICA增加小鼠关节软骨细胞活性和酸性黏多糖合成。见图1。
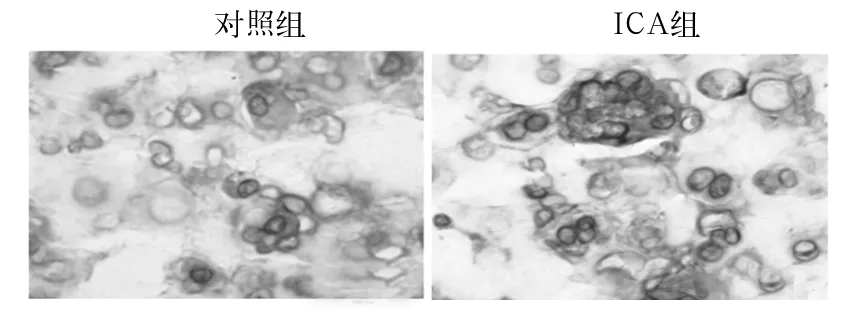
图1 两组软骨细胞活性和酸性黏多糖合成情况(阿利新蓝染色)
2.2 两组软骨细胞中Cyclin D1、Cyclin E、β-catenin蛋白及mRNA表达比较 与对照组比较,其ICA组软骨细胞中Cyclin D1、Cyclin E、β-catenin蛋白及mRNA表达均增加(P均<0.05)。见表2、图2。
3 讨论
胶原酸性黏多糖的蛋白核心结构上附着硫酸化糖胺聚糖(GAG),使其形成一个大的高度带负电荷的分子,容易与酸性染料阿利新蓝结合,阿利新蓝染色的深浅可反映软骨细胞酸性黏多糖合成量的多少[11]。本研究结果显示,10 μmol/L的ICA可促进小鼠关节软骨细胞的增殖与活性,并能提高细胞增殖相关蛋白的转录和表达水平。ICA显著增加了小鼠软骨细胞酸性黏多糖的合成与分泌,酸性黏多糖以及Ⅱ型胶原的致密结构又将软骨细胞围在致密的软骨陷窝里,保证软骨细胞代谢的营养供给,从而提高软骨细胞的活性[12];同时,软骨细胞外基质产生的因子本身也会增强软骨细胞活性。
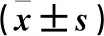
表2 两组软骨细胞Cyclin D、Cyclin E、 β-catenin的表达情况
注:与对照组比较,*P<0.05。
注:箭头所示为目标蛋白在细胞中的表达部位。
图2两组软骨细胞中Cyclin D1、Cyclin E、β-catenin蛋白表达情况(免疫组化法)
本研究显示,在藻酸盐3D培养下,ICA促进小鼠关节软骨细胞周期蛋白Cyclin D1、Cyclin E 蛋白和mRNA的表达。Cyclin D1属于周期蛋白家族成员之一,其功能是调节细胞周期,主要在G1期表达,驱动细胞向S期过渡,从而合成更多的DNA物质,为细胞分裂做准备。有研究表明,用RNA手段干扰大鼠软骨细胞Cyclin D1表达,大鼠软骨细胞细胞分裂停滞在G1期[13,14]。Cyclin E/周期依赖性激酶2(CDK2)复合体是细胞分裂从G1期进入S期重要的调节元件。文献报道,ICA通过上调Cyclin E、CDK2以及下调p21、p27的表达,提高胚胎干细胞的自我更新能力[13]。β-catenin作为一种多功能的蛋白质,主要介导细胞间黏附和参与基因的表达,以此参与成骨细胞和软骨细胞的增殖和分化[16,17]。本研究中,ICA激活了β-catenin的表达,Cyclin D1作为其靶基因和细胞分裂G1/S期的阳性助推器[18,19],表达水平也显著上调。但是,具体是通过HIF-1α/β-catenin通路激活β-catenin,还是Wnt/β-catenin通路调控β-catenin表达,仍需要进一步深入研究。
本研究发现,小鼠关节软骨细胞中β-catenin与Cyclin D1、Cyclin E均表达增加。究其机制,可能是藻酸盐这种材料使细胞聚集成团,形成内部相对致密三维立体环境[8,20,21]。这种环境与软骨细胞本身所处的软骨外基质非常相似,为小鼠关节软骨细胞提供了一个适宜软骨细胞增殖和代谢的微环境。在这种条件下,ICA通过某种信号通路,激活β-catenin的转录和表达,从而诱发及其下游基因Cyclin D1、Cyclin E的表达。而且,藻酸盐具有软骨结构非常相似的致密立体结构,有利于软骨细胞增殖和细胞之间的信号传递。由此可见,ICA可以通过上调β-catenin、Cyclin D1、Cyclin E表达,提高小鼠关节软骨细胞活性,促进小鼠关节软骨细胞增殖,该结论可为ICA用于细胞工程治疗骨关节炎提供理论基础。
