靶向核抗原的嵌合抗原受体T细胞构建及其分泌IFN-γ功能验证
2020-06-28徐忠法甄亚男赵春红王若谷张西坤李成军鲁守堂霍守俊韩钢杨美家
徐忠法,甄亚男,赵春红,王若谷,张西坤,李成军,鲁守堂,霍守俊,韩钢,杨美家
1 山东省医学科学院附属医院 山东第一医科大学第三附属医院,济南250031;2 Boston 3T Biotechnologies Inc.
近年来,嵌合抗原受体T细胞(CAR-T细胞)技术治疗在急性淋巴细胞白血病等血液系统肿瘤中取得了巨大成功,但对大多数实体瘤治疗效果不佳,如何突破实体瘤抑制性微环境的限制成为其治疗的难点之一。CAR-T细胞的抗原结合受体经基因工程技术改造可以识别肿瘤特异性或相关性抗原,激活T细胞发挥肿瘤杀伤效应;因此,通过适当选择CAR-T细胞靶向的抗原,有可能突破实体瘤的抑制性微环境,实现对实体瘤的杀伤作用。T细胞的激活发生在T细胞受体(TCR)与抗原提呈细胞(APC)上的抗原肽——主要组织相容性复合物(MHC)形成的免疫突触部位[1~3],ZAP70激酶[4]与TCR偶联的CD3ζ在细胞内结合和磷酸化参与了T细胞的活化。除TCR之外,T细胞活化还需要共刺激配体/受体的相互作用。例如,共刺激路径分子4-1BB可增强CD8+T细胞的增殖和存活能力,使体内细胞毒T细胞效应放大;最近发现,4-1BB共刺激路径可能会通过活化嵌合抗原受体(CAR)防止T细胞衰竭[5]。肿瘤被认为是一种免疫系统失调性疾病,免疫系统发现肿瘤细胞时,自然杀伤细胞分泌IFN-γ可抑制肿瘤的发生发展。然而,在系统性应用IFN-γ治疗肿瘤过程中发生了严重不良反应,临床应用受到限制[6]。细胞坏死被认为是一种特殊形式的程序性死亡,其代谢产物可进一步触发细胞坏死的发生[7]。实体瘤的核心经常发生细胞坏死,释放核内抗原成分;近年来发现,针对核内抗原成分的单克隆抗体具有抗肿瘤作用,从而形成了一种新型的肿瘤治疗方法即肿瘤坏死治疗。在肿瘤坏死治疗中,常构建细胞因子与核抗体融合蛋白,增加抗体的杀伤效应。2013年至今,我们设计了一种基因工程改造的能够特异性识别坏死组织核小体的T细胞,与核抗原接触后分泌IFN-γ,改变实体瘤的微环境,以达到抗肿瘤的效果。现报告如下。
1 材料与方法
1.1 主要材料 慢病毒载体为美国3T生物公司专利产品;IL-2购自ProSpec-Tany TechnoGene有限公司;辣根过氧化酶标记的山羊抗人球蛋白抗体购自Jackson ImmunoResearch Laboratories公司;Streptavidin PE购自BD公司。活化T细胞分选试剂盒购自ThermoFisher Scientific公司;细胞分选柱购自Miltenyi公司;淋巴细胞分离液购自Promocell公司;RPMI-1640为GIBCO公司产品;胎牛血清购自Hyclone公司。HEK293F细胞购自美国ATCC;蛋白转运抑制剂Brefeldin A购自美国Sigma-Aldrich公司。
1.2 核小体结合单链可变区(ScFv)构建 从已发表的文献中查找筛选了6种具有核小体结合活性的单克隆抗体,包括NHS、KSUG、3H9、D6、KS3和D5。根据杂交瘤技术克隆抗体基因,构建抗体的ScFv和可结晶片段(Fc)融合基因,通过体外实验验证ScFv-Fc融合蛋白的核小体结合活性。基本流程:构建的融合基因在HEK293F细胞中瞬时表达ScFv-Fc融合蛋白,提取融合蛋白备用。用DNA组蛋白复合物制备的核小体抗原包被96孔聚丙乙烯板,洗涤后加入融合蛋白,在特定培养基中孵育;洗涤去除培养基以及未结合的抗体,加入辣根过氧化物酶标记的山羊抗人球蛋白,加入显色剂检测融合蛋白。经体外实验证实具有核抗原结合活性,将相关的基因亚克隆到慢病毒载体上,在ScFv基因的上游加载人IL-2基因信号序列,下游为CD8α主干以及跨膜编码区基因,之后为CD3ζ链结构域编码基因,并克隆有4-1BB的共刺激结构域,共同构建形成CAR。
1.3 CAR表达验证 携带CAR编码序列的慢病毒载体在无血清培养基中转染HEK293F细胞,产生表达CAR的慢病毒颗粒,-80 ℃保存备用。取出慢病毒颗粒,室温融化后,加入FuSure(美国3T生物公司)试剂,混匀后静置5 min。将HEK293F细胞分为两组,转染组在体外转导携带CAR的慢病毒载体,对照组转导等量空载体。起始细胞量为1×106,连续培养;每次传代时取10 μL,进行细胞计数并用流式细胞仪检测CAR,实验重复3次。检测靶点为CAR抗原识别区,使用试剂为PE标记的山羊抗人可变区抗体。
1.4 CAR-T细胞构建 经山东省医学科学院附属医院医学伦理委员会批准,采集健康志愿者(均知情同意)血液10 mL;以分离液分离PBMC,用Pan-T细胞分离试剂(Miltenyi,德国)获得T细胞;将细胞密度1×106单细胞悬液置于37 ℃培养箱中,隔日加入200 U/mL IL-2,培养4 d。每4×105个T细胞中加入3.6 MOI的核小体CAR表达慢病毒进行转染,制备CAR-T细胞。
1.5 CAR-T细胞分泌IFN-γ功能观察
1.5.1 不同抗原诱导下CAR-T细胞分泌IFN-γ功能观察 收集转染后的CAR-T细胞,随机分为核小体抗原组、Brefeldin A组、联合组。核小体抗原组加入包被核小体抗原的96孔聚苯乙烯培养板中,Brefeldin A组在含Brefeldin A的培养基中培养,联合组在核小体抗原、Brefeldin A共同作用下培养。核小体抗原为组蛋白和DNA复合物,参照文献制备[8]。用FITC标记的抗IFN-γ抗体标记后,通过流式细胞仪检测IFN-γ表达细胞。
1.5.2 核小体抗原诱导下CAR-T细胞分泌IFN-γ功能动态观察 分离人CD3+CD28+T淋巴细胞,在含IL-2的培养基中培养活化;将携带CAR-T的慢病毒载体转染活化T淋巴细胞,用核小体抗原诱导T细胞表达IFN-γ;收集核小体抗原诱导0、2、48 h时的淋巴细胞,经用FITC标记的小鼠抗人IFN-γ单克隆抗体染色,以流式细胞仪检测IFN-γ表达细胞。
2 结果
2.1 CAR的表达情况 在培养10~15 d时,转染组表达CAR的HEK293F细胞比例达53.04%~87.17%,转染效率可以满足实验要求。CAR在HEK293F细胞的表达情况,见图1。
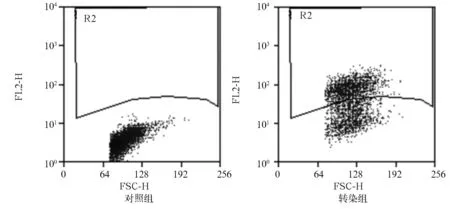
注:横坐标为前向角散射光;纵坐标为PE标记的山羊抗人可变区抗体强度;R2为表达CAR的HEK293F细胞。
图1 CAR在HEK293细胞的表达情况(流式细胞术)
2.2 CAR-T细胞分泌IFN-γ情况 不同抗原诱导下,核小体抗原组、Brefeldin A组、联合组分泌IFN-γ的T细胞比例分别为0.028%、0.034%、3.570%。核小体抗原诱导0、48 h时检测不到分泌IFN-γ的CAR-T细胞,2 h时分泌IFN-γ的CAR-T细胞最多。见图2。

注:横坐标为抗IFN-γ-FITC荧光强度;纵坐标为细胞数;R3为分泌IFN-γ的CAR-T细胞。
图2 核小体抗原诱导不同时点分泌IFN-γ的CAR-T细胞数量变化(流式细胞术)
3 讨论
本研究通过瞬时表达的ScFv-Fc片段验证了ScFv的核小体结合功能,并进而构建具有核小体结合功能的CAR。研究发现,从抗体衍生而来的ScFv与核小体抗原亲和力高,可用以构建高亲和力CAR。本研究中应用的部分核小体抗体,在以往研究中已被证实与IL-2融合后可以靶向肿瘤坏死中心。Gillies等[9]构建了IL-2与靶向肿瘤坏死区的单克隆抗体NHS76的融合蛋白NHS-IL2LT,可成功抑制侵袭性神经母细胞瘤和非小细胞肺癌动物模型肿瘤的生长,实验动物生存期延长。
本研究设计的CAR-T细胞可识别核小体抗原,并被激活分泌IFN-γ。细胞毒性T淋巴细胞(CTL)表面约有105个TCR表达,对于高亲和力配体,几百个TCR的参与便足够激活CTL[10,11]。与细胞膜上的MHC抗原复合体不同,本研究构建的CAR的激活需要核小体抗原参与,CAR在细胞表面表达的数量对转染T细胞的整体功能至关重要。本研究采用的慢病毒载体转染效率高,转染活化T细胞后形成的CAR-T细胞,可经抗原刺激充分激活。本研究结果显示,转染核小体受体的T细胞与核小体抗原共培养时会特异性表达IFN-γ,IFN-γ反过来激活抗原提呈细胞,诱导MHC Ⅱ肿瘤抗原复合物的表达[12],增强T细胞的抗肿瘤作用。因此,我们所构建的核小体抗原识别CAR-T细胞为IFN-γ表达细胞。
本研究发现,核小体抗原诱导CAR-T细胞短暂表达IFN-γ,IFN-γ表达水平随诱导时间延长递减。T细胞活化后存在T细胞耗竭现象,可以通过调节基因表达来抑制T细胞活化状态以达到免疫平衡[13]。最近,Imanishi等[14]报道自身坏死组织释放的核酸及坏死组织复合物可诱导共刺激反应,通过抑制Th1/Th2细胞转换关键因子T-bet表达,诱导T细胞向Th2细胞分化,继而诱导GATA-3和Th2细胞因子的产生。这提示核小体可能会促进肿瘤微环境中的T细胞向Th2转化,进而诱导肿瘤相关的巨噬细胞M2极化[15]。本研究构建的CAR-T细胞可能会消除肿瘤坏死中心积聚的大量核酸组蛋白等核小体复合物诱导的Th2免疫反应,抑制肿瘤细胞浸润及新生血管形成,并通过在肿瘤微环境中释放IFN-γ诱导局部免疫反应,达到抑制肿瘤的目的。
综上所述,本研究设计的CAR-T细胞可用于肿瘤治疗,能改善实体瘤的微环境。在前期临床试验中,实体肿瘤的CAR-T细胞治疗出现了严重的不良反应,导致重度细胞因子风暴或结肠炎[16~20]。本研究中CAR-T细胞的靶点为实体肿瘤坏死中心积聚的核小体抗原,核酸类抗原是较为安全的靶标,针对这次抗原的单克隆抗体经临床试验证实安全可靠,未诱发致死性不良反应[21]。核小体抗原存在于细胞核内,不会在细胞表面表达,从而降低了脱靶效应的风险。因此,本研究设计CAR-T细胞可能不会产生类似非特异性靶向肿瘤抗原的显著不良反应。在之后的研究中,我们将进一步确定CAR-T细胞进入肿瘤组织的数量,逆转肿瘤微环境所需要的活化状态,以及核小体CAR-T细胞是否对肿瘤的微转移起到抑制作用。
