3种常规结核分枝杆菌及耐药突变检测方法的对比研究
2020-06-28薛建昌邸红芹吴海峰郑立恒梁冰锋
薛建昌,邸红芹,吴海峰,郑 浩,郑立恒,梁冰锋
(1.河北省胸科医院检验科,河北 石家庄 050041;2.河北省胸科医院分子生物室,河北 石家庄 050041;3.河北省胸科医院超声室,河北 石家庄 050041;4.河北女子职业技术学院护理系,河北 石家庄 050091)
结核病是全球范围内导致死亡的十大原因之一,也是单一传染源导致死亡的主要原因。根据世界卫生组织(World Health Organization,WHO)估计,世界上约有四分之一的人口感染结核分枝杆菌(Mycobacteriumtuberculosis,MTB),且耐药结核病是威胁公共卫生的重大问题,几乎占全球耐多药结核病(multi-drug resistant tuberculosis,MDR-TB)的一半,中国以13%耐药比例位列第2,耐药形势十分严峻[1-2]。结核病的耐药性监测对于指导合理使用抗生素起着至关重要的作用,由于传统的结核菌培养联合抗结核药物的敏感性试验(药敏试验)仍是目前诊断结核病和耐药结核病的“金标准”,但确诊周期较长,不利于结核病及耐药结核病的防控[3-4]。近年来,随着分子生物学技术的快速发展,对MTB核酸及异烟肼、利福平等抗结核药物基因突变进行快速检测逐渐被广泛接受。WHO推荐的Gene Xpert MTB/RIF技术(Xpert法)采用实时荧光定量核酸扩增技术,可以及时快速对样本中的MTB核酸进行提取和检测,同时报告待检样本中MTB的利福平耐药情况[5-7]。MTB核酸检测(PCR-荧光探针法)能快速有效对样本中的MTB进行检出,MTB耐药基因检测(DNA微阵列芯片法)对检出的阳性样本中MTB的异烟肼和利福平耐药情况能够快速准确进行检测,具有较好的临床应用价值[8-9]。本研究对Xpert法、BD960液体快速培养法(BD960法)联合快速药物敏感试验(药敏试验)、MTB核酸检测(TB-DNA法)联合MTB耐药基因检测法(DNA芯片法)进行比较,分析不同方法检测MTB及耐药情况的效能,评估其在结核病及耐药结核病控制中的应用价值。
1 资料与方法
1.1一般资料 回顾性分析2018年7月—2019年6月在河北省胸科医院就诊的经临床明确诊断为肺结核患者246例,男性167例,女性79例,年龄15~86岁,平均(43.90±19.69)岁。患者标本包含痰标本143例,支气管肺泡灌洗液103例,所有标本均进行MTB鉴定,鉴定方法分别为BD960法、Xpert法和TB-DNA法。所有进行MTB鉴定阳性标本均对应进行耐药情况分析,对应方法包括药敏试验、Xpert法和DNA芯片法。其中部分样本参照实验室标准操作规程和试剂说明书进行了萋-尼抗酸染色、抗酸染色涂片检查(夹层杯法)及纤维支气管镜刷片抗酸染色检测。
1.2检测方法
1.2.1BD960法联合药敏试验 严格参照使用说明书进行操作,BD960法,试验标本均用1~2倍体积4%NaOH溶液消化15~20 min,加入无菌磷酸盐缓冲液混匀后离心,弃上清液,加入1 mL磷酸盐缓冲液重悬沉淀物,混匀后取0.5 mL接种于MGIT960液体快速结核菌培养基中,放入BACTEC MGIT960快速培养系统(Becton Dickinson公司,美国)中进行培养。药敏试验根据CLSI M24-A微量肉汤稀释法原理,将药物包括菌群分类药物事先包被在U-底板上,将结核菌研磨比浊为1麦氏单位,以培养基稀释后加入测试孔,根据各孔的培养结果获得MIC数据成界值范围,以此判断药物敏感性。
1.2.2Xpert法 按照使用说明书进行操作,加入样本处理液,充分混匀后,室温孵育15 min,使用新的移液管将2 mL混合液加入试剂匣(Cepheid产品,美国),最后放入检测模块中进行上机检测。反应结束后,在检测系统窗口下直接观察测试结果。MTB数量以MTB DNA拷贝分为高、中、低(极低)和未检出进行报告,利福平检测结果为敏感和耐药。
1.2.3MTB核酸检测联合MTB耐药基因检测 样本中加入1~2倍体积的4%NaOH前处理液,充分摇匀后,室温孵育15~20 min。取液化后标本1 mL加入1.5 mL离心管中,12 000 r/min离心5 min。弃上清液,沉淀中加入1 mL清洗液混匀,12 000 r/min离心5 min,重复洗涤1次。弃上清液,加入50 μL已混匀的DNA提取液,用移液器充分混匀后转入核酸提取管。将核酸提取管放入振荡器中,最高速率震荡10 min。震荡完成后,将核酸提取管进行95 ℃ 5 min加热孵育。加热后12 000 r/min离心5 min,上清即为核酸样本。参照分枝杆菌检测试剂盒(PCR-荧光探针法,成都博奥晶芯生物科技有限公司)说明书进行PCR。MTB核酸检测报告阳性的核酸样本,参照MTB耐药基因检测试剂盒(DNA微阵列芯片法,成都博奥晶芯生物科技有限公司)说明书进行耐药基因检测。
1.3统计学方法 应用SPSS22.0统计软件处理数据。检测结果一致性采用Kappa检验分析,Kappa值<0.4为一致性较差,Kappa值0.4~0.75为中度一致,Kappa值>0.75为高度一致。计数资料比较采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1不同检测方法对临床样本中MTB阳性检出率比较 BD960法的MTB阳性检出率低于分枝杆菌核酸检测和Xpert 法,差异有统计学意义(P<0.05),见表1。对于结核分枝杆菌的快速检测及鉴定方法,其中部分样本还进行了萋-尼抗酸染色、抗酸染色涂片检查(夹层杯法)及纤维支气管镜刷片抗酸染色检测,均是直接对样本中MTB进行病原学染色观察。萋-尼抗酸染色检测阳性率为47.69%(31/65),抗酸染色涂片检查(夹层杯法)检测阳性率为80.10%(161/201),纤维支气管镜刷片抗酸染色检测阳性率为40.63%(39/96)。3种病原学染色阳性检出率均显著低于BD960液体快速培养法(χ2=61.361,9.279,94.059,P<0.05)、MTB核酸检测法(χ2=118.490,39.008,152.980,P<0.05)和Xpert法(χ2=144.471,53.767,175.275,P<0.05),因3种病原学染色阳性检出率未达预期,文中不作进一步分析。
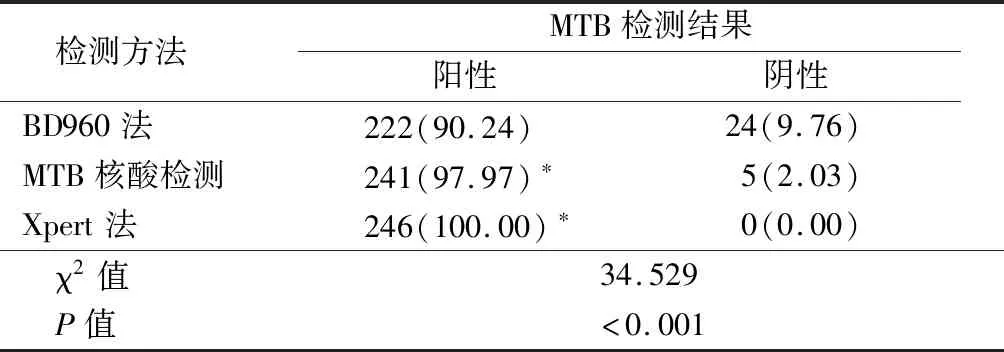
表1 3种方法检测MTB阳性检出率比较Table 1 Comparison of the positive detection rate of three methods for detecting MTB (n=246,例数,%)
*P值<0.05与BD960法比较(χ2检验)
2.2不同检测方法对临床样本中MTB耐药检出率比较 3种方法对利福平耐药检出率差异无统计学意义(P>0.05),见表2。
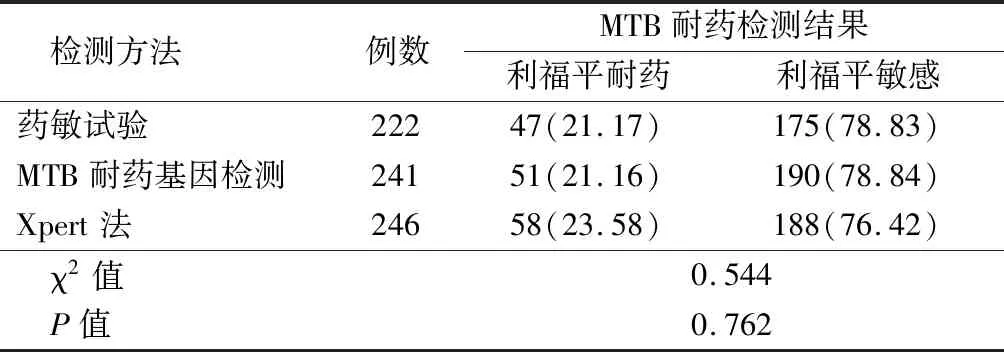
表2 3种方法对利福平耐药检出率比较Table 2 Comparison of the detection rates of resistance to rifampicin by three methods (例数,%)
以快速药物敏感试验检测结果作为检测“标准”,进一步分析Xpert 法和MTB耐药基因检测的检测效能,敏感度分别为95.65%(44/46)和91.30%(42/46),特异度分别为93.57%(160/171)和95.32%(163/171),阳性预测值分别为80.00%(44/55)和84.00%(42/50),阴性预测值分别为98.77%(160/162)和97.60%(163/167),准确度分别为94.01%(204/217)和94.47%(205/217),约登指数分别为89.22%和86.63%,均在80%以上。
为保证分析结果的可比性与准确性,已剔除BD960液体快速培养法和分枝杆菌核酸检测MTB为阴性的样本。以快速药敏试验检测结果作为检测“金标准”,Xpert 法和MTB耐药基因检测利福平耐药结果高度一致,Kappa值分别为0.833和0.840(均P<0.05),见表3。

表3 3种利福平耐药检测方法一致性分析Table 3 Analysis of consistency results of three methods for detection of rifampicin resistance (n=217,例数)
快速药物敏感试验和MTB耐药基因检测能对常规一线抗结核药物——异烟肼耐药情况进行检测,结果显示,2种方法异烟肼耐药结果检出率差异无统计学意义(P>0.05),见表4。

表4 异烟肼耐药检测方法检出结果差异分析Table 4 Analysis of the difference in detection results of isoniazid resistance (例数,%)
3 讨 论
MTB尤其是耐药MTB的产生与传播是导致结核病发病率居高不下的重要原因之一。目前MTB的细菌学检测仍是结核病诊断、治疗的重要依据,萋-尼抗酸染色、电子支气管镜刷片抗酸染色及抗酸染色涂片检查(夹层杯法)检测是目前实验室常规直接对样本中MTB进行病原学染色观察的方法,本研究中萋-尼抗酸染色和纤维支气管镜刷片抗酸染色阳性检出率仅为47.69%(31/65)和40.63%(39/96),抗酸染色涂片检查(夹层杯法)阳性检出率为80.10%(161/201),与文献报道的操作简单快速但阳性检出率和敏感度不高结果一致[10-12]。
Xpert法是集样本处理、核酸提取和扩增、MTB核酸特异性检测及利福平耐药基因rpoB突变检测于一体的结核病和利福平耐药结核病快速诊断方法[13-14]。研究显示,PCR-荧光探针法可快速检测样本中是否含有MTB,具有临床推广应用价值[15]。本研究结果显示,BD960法对MTB的阳性检出率低于MTB核酸检测和Xpert法,差异有统计学意义(P<0.05)。进一步分析阳性检出率差异发现,BD960法报告的9.76%(24/246)MTB阴性结果中,在Xpert检测结果中MTB带菌量低(极低)占79.17%(19/24),带菌量中占16.67%(4/24),带菌量高占4.16%(1/24);MTB核酸检测法报告的2.03%(5/246)MTB阴性结果中,Xpert法检测MTB带菌量低(极低)占80.00%(4/5),带菌量中占20.00%(1/5),这些中、低浓度带菌量的样本是造成阳性检出差异的主要原因。因此,MTB核酸检测和Xpert法更有利于结核病的诊治和预防,但是需要专业熟练地操作、配套使用的仪器和试剂盒,限制了其在地方性医院的推广。
目前,多重耐药和广泛耐药结核病仍以MTB耐药性测试或抗菌药物敏感性测试为主。本研究结果显示,3种方法利福平耐药检出率差异无统计学意义(P>0.05)。以快速药物敏感试验检测结果作为检测“金标准”,Xpert法和MTB耐药基因检测利福平耐药结果高度一致(Kappa值均大于0.75),敏感度、特异度、阴性预测值和准确度均大于90%,阳性预测值和约登指数均在80%以上,与以往的研究报道结果一致[7,16]。此外,快速药物敏感试验及MTB耐药基因检测还能够对样本中异烟肼耐药情况进行分析,结果显示,2种检测方法结果差异无统计学意义(P>0.05),与文献报道结果一致[17]。
研究过程中发现一些造成差异的可能原因,当临床样本中MTB带菌量低(极低)时,BD960快速培养和MTB核酸检测因最低检测限阈值问题造成结果易产生“假阴性”;当样本中野生型模板背景较高时,易产生非特异性扩增的“假阳性”,同时Gene Xpert技术在检测样本带菌量极低时,可能会出现假耐药的情况;表型耐药与基因型突变会存在一定差异,基于基因突变并不能完全涵盖所有突变位点的检测,样本中MTB浓度低时无法进行MTB耐药基因检测等[18-19]。因此,在实际临床应用中需结合表型和基因型检测方法,提高检测敏感度和特异度,以提高准确预测耐药性和耐药结核病治愈的可能性。
综上所述,Xpert法和MTB核酸检测能够快速准确地对样本中是否含有MTB进行检测,快速药物敏感试验、MTB耐药基因检测和Xpert法能够对样本中利福平(异烟肼)耐药情况进行分析,且MTB耐药基因检测和Xpert法具有较高的敏感度和特异度,可结合实际需求在耐多药结核病防治中推广和应用。
