疲劳运动及虾青素补充对大鼠血清代谢影响的代谢组学研究
2020-06-27吴丽君王僮
吴丽君 王僮


摘 要:目的:采用核磁共振(1H-NMR)代谢组学技术探讨疲劳运动及虾青素补充对疲劳运动大鼠血清代谢的影响。方法:将36只雄性SD大鼠随机分为3组:对照组(C)、运动组(E)、运动加给药组(EM)。EM组大鼠按每天6.6 mg/kg体重连续进行虾青素灌胃21天,E组与EM组大鼠进行递增负荷至疲劳的游泳运动。运动后即刻对大鼠进行股动脉取血并离心保存,对血样进行1H-NMR数据采集与处理后找出差异代谢物,并使用MetPA数据库分析代谢通路,结合KEGG数据库筛选出潜在标志物。结果:1)E组相比C组大鼠血清差异代谢物共15种,其中甘油、柠檬酸、氧化三甲胺(P<0.05)、乳酸、乙酰乙酸(P<0.01)浓度显著升高,葡萄糖、脂质、亮氨酸(P<0.05)、肌酸、异亮氨酸、丙氨酸、缬氨酸、α-酮戊二酸、琥珀酸、甜菜碱(P<001)浓度显著降低;15种代谢物共参与20条代谢通路,其中缬氨酸、亮氨酸与异亮氨酸的生物合成,酮体的合成与降解,丁酸代谢,乙醛酸与二羧酸代谢,甘油脂代谢,柠檬酸循环6条通路为疲劳干预潜在的靶标代谢通路,潜在代谢标志物为缬氨酸、亮氨酸、异亮氨酸、乙酰乙酸、琥珀酸、甘油、α-酮戊二酸与柠檬酸;2)EM组相比E组大鼠血清差异代谢物共7种,其中葡萄糖(P<0.05)、亮氨酸、异亮氨酸、缬氨酸(P<0.01)浓度显著升高,脂质(P<0.05)、乳酸、甘油(P<0.01)浓度显著降低;7种代谢物共参与9条代谢通路,其中包括缬氨酸、亮氨酸与异亮氨酸的生物合成,甘油脂代谢2条通路为虾青素干预潜在的靶标代谢通路,潜在标志物为缬氨酸、亮氨酸、异亮氨酸与甘油。结论:1)疲劳运动可通过影响缬氨酸、亮氨酸与异亮氨酸的生物合成,酮体的合成与降解,丁酸代谢,三羧酸循环,乙醛酸与二羧酸代谢及甘油脂代谢等6条代谢通路对大鼠机体产生不利影响;2)疲劳运动前补充虾青素可通过改变其中的缬氨酸、亮氨酸与异亮氨酸的生物合成及甘油脂代谢通路达到促进机体脂质代谢、节约BCAA利用、延缓运动疲劳的作用。
关键词:疲劳运动;虾青素;血清;代谢组学
众所周知,运动疲劳运动会损害运动员身心健康,影响其运动成绩。国内外学者在延缓运动疲劳的营养补剂方面做了大量研究,包括牛磺酸[1]、参芪口服液[2]、维生素D[3]、虾青素、多酚[4]等。虾青素(Astaxanthin,ASTA)是一种强自由基清除剂,广泛存在于虾、蟹、鱼、藻类以及鸟类羽毛中,具有超强抗氧化活性,可降低机体自由基水平,具有抗肿瘤、预防心脑血管疾病、保护神经、保护肝肾脏等多种作用。1987年虾青素被美国食品和药品监督管理局批准用于水产养殖业的饲料添加剂,并于1999年被批准用于膳食补充剂[5]。在运动人体科学领域,虾青素具有改善机体物质代谢、增强免疫力、抵抗肌肉炎症、提高身体耐力、缓解运动疲劳等功效[6],是近年来的研究热点之一。
代谢组学(metabonomics)是20世纪90年代末期继基因组学、蛋白质组学之后,迅速发展起来的以高通量检测和数据处理为手段、以信息建模与系统整合为目标、以群组指标分析为基础的一门生物学学科[7]。它主要以生物体液为研究对象,还可采用完整组织样品进行研究,可以在不预先设定将要检测的具体指标“全景式”扫描所有代谢物,从而反映药物、环境污染、运动等外界因素对机体代谢的影响[8],已广泛应用于药物研发、疾病研究、食品检测及运动或生活方式引起的干扰等领域[9]。基于疲劳运动对机体产生较大扰动,本研究采用1H-NMR代谢组学技术研究疲劳运动及虾青素补充对疲劳运动大鼠血清代谢的影响,试图从代谢角度阐明疲劳运动及虾青素补充对机体机能产生影响的作用途径与机理。
1 材料与方法
1.1 实验对象及分组
SPF级雄性SD健康大鼠36只,体重160~180 g,由北京维通利华实验动物技术有限公司提供。大鼠适应性饲养4天后随机分为3组,每组12只,分别为对照组(C)、运动组(E)、运动加给药组(EM),室温20℃~25℃,相对湿度为(50±10)%。
1.2 实验仪器与试剂
1.2.1 实验仪器
Brucker 600-MHz AVACNCEⅢ NMR谱仪,TGL-16高速台式冷冻离心机(湖南长沙),XW-80A旋涡混合器(上海),KQ5200E型超声波清洗器等。
1.2.2 实验试剂
D2O(Norell,USA),PBS(Phosphate buffer saline)緩冲液,甲醇(分析纯≥99.5%),虾青素(湖北武汉雅士达生物科技有限公司生产)。
1.3 实验设计与运动方案
实验方案参照Kalantari[10]与侯莉娟[11]的大鼠游泳方案。运动大鼠适应性游泳3天,水温(30±2)℃,水深40 cm。第一天游泳40 mim,第二天50 mim,第三天60 mim。适应性游泳结束后,正式开始游泳与灌药。EM组大鼠于上午8点进行虾青素灌胃,其余大鼠同时间灌服同剂量大豆油,连续给药21天。运动分为三个阶段:1)下午14:30游泳150 min,持续7天;2)下午14:30游泳180 min,持续7天;3)上午8:00、下午14:30游泳各180 min,持续7天。最后一周大鼠每次运动至力竭,最终积累导致疲劳。力竭判断标准:大鼠持续下沉10 s不露出水面[12]。疲劳判断标准:大鼠出现神情怠倦、皮毛蓬乱枯槁、脱毛,运动能力下降,对外界刺激反应迟钝等征状[11]。
1.4 样本采集与处理
1.4.1 样本采集
最后一天游泳结束后即刻对3组大鼠进行股动脉取血,以6 000 rpm离心30 min后采集血清,保存于-80℃冰箱备用。
1.4.2 1H-NMR样本处理
首先将血清样本解冻处理,后用移液枪吸取450 ul血清放于EP管并加入350 ul D2O,涡旋30秒后以1300 rpm 4℃离心20 min,取550 ul上清液于5 mm核磁管中通过CPMG(Carr-Purcell- Meiboom-Gill)脉冲序列进行1H-NMR检测,自旋弛豫延迟320 ms,谱宽8KHz,自由感应衰减64K数据点,进行64次扫描。随后用MestReNova软件(Mesterlab Research, Santiago de compostella, Spain)处理样本核磁信号图谱,首先用肌酸化学位移3.04作为参考定标,调整核磁谱图偏差位移,手动切除δ4.60-5.20水峰信号,用0.01 ppm作为分段单位,对图谱0.6 ppm-9.0 ppm段分段积分与归一化处理,保存数据到excel中。使用SIMCA-P13.0分析积分值,最终找出P0.05、VIP1的差异代谢物。
1.5 数据分析
采用SPSS17.0软件对实验数据统计分析,采用t检验与双因素方差分析检验样本显著性,从统计学角度分析补充虾青素及疲劳运动对机体影响。最后将差异代谢物代入MetaboAnalyst 4.0数据库(https://www.metaboanalyst.ca)中分析可能的代谢通路变化,结合KEGG数据库寻找潜在标志物。
2 结果与分析
2.1 疲劳运动前后大鼠血清差异代谢物
由图1可见,E组与C组样本PLS-DA模型验证成立,score图显示两组样本间区分明显,组内样本较集中,表明两组样本间具有显著差异性,S-Plots图上有些点明显与其他多数点分离且离原点较远,为显著性差异代谢物。由表1可见,疲劳运动后大鼠血清共15有种差异代谢物,E组比C组血清甘油、柠檬酸、氧化三甲胺(P<0.05)、乳酸、乙酰乙酸(P<0.01)浓度显著升高,葡萄糖、脂质、亮氨酸(P<0.05)、肌酸、异亮氨酸、丙氨酸、缬氨酸、琥珀酸、α-酮戊二酸、甜菜碱(P<0.01)浓度显著降低。
由图2可见,EM组与E组样本PLS-DA模型验证成立,score图显示两组间样本差异明显,组内样本较集中,表明两组间具有显著差异性,S-Plots图上有些点明显与其他多数点分离且离原点较远,为显著性差异代谢物。由表2可知,虾青素干预后两组大鼠血清共有7种差异代谢物,EM组相比E组血清葡萄糖(P<0.05)、亮氨酸、异亮氨酸、缬氨酸(P<0.01)浓度显著升高,脂质(P<0.05)、乳酸、甘油(P<0.01)浓度显著降低。
2.2 补充虾青素前后疲劳运动大鼠血清差异代谢物
由图2可见,EM组与E组样本PLS-DA模型验证成立,score图显示两组间样本差异明显,组内样本较集中,表明两组间具有显著差异性,S-Plots图上有些点明显与其他多数点分离且离原点较远,为显著性差异代谢物。由表2可知,虾青素干预后两组大鼠血清共有7种差异代谢物,EM组相比E组血清葡萄糖(P<0.05)、亮氨酸、异亮氨酸、缬氨酸(P<0.01)浓度显著升高,脂质(P<0.05)、乳酸、甘油(P<0.01)浓度显著降低。
2.3 代谢通路分析
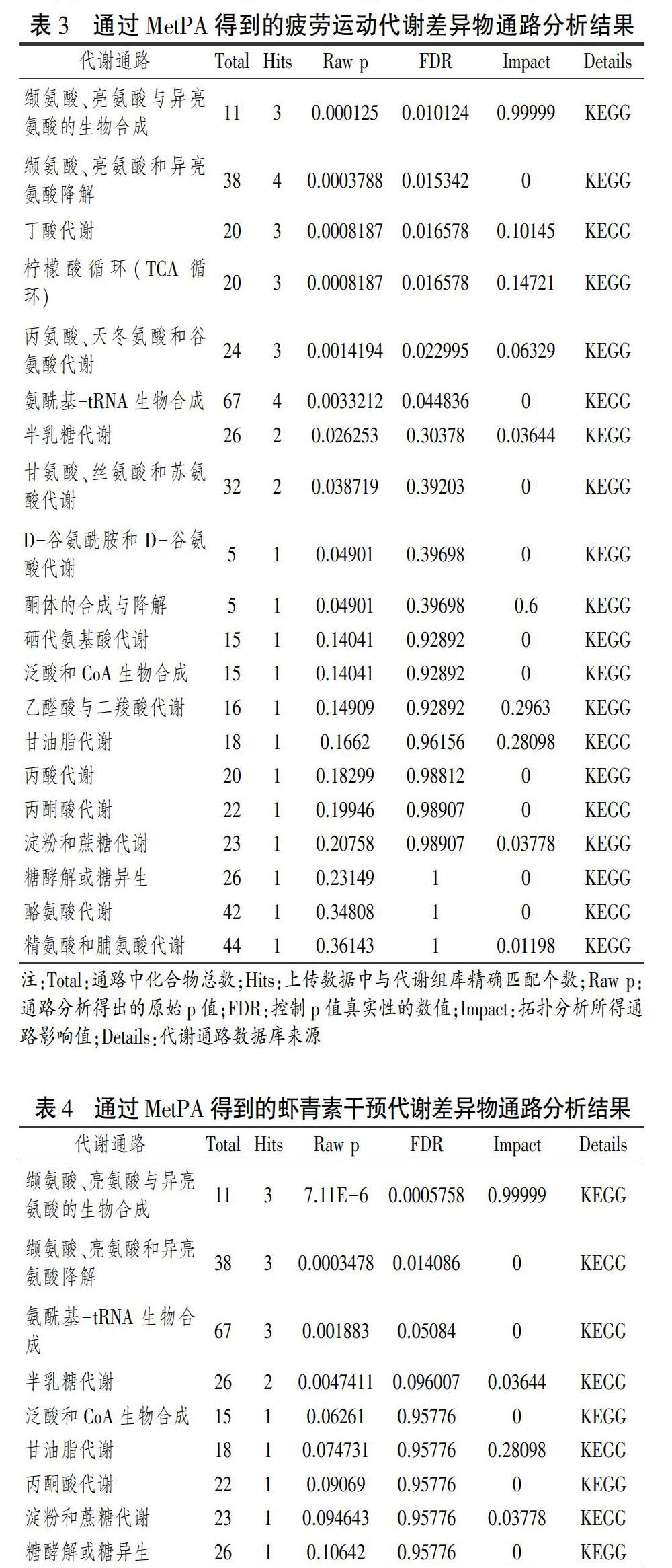
将疲劳运动后与虾青素干预运动后的差异代谢物分别输入MetPA数据库,对其所涉及的代谢通路进行分析,可以看出大鼠疲劳运动前后涉及的通路共20条(表3),本研究以影响值>0.1为阈值,对这些代谢通路进行筛选,高于此值为疲劳运动影响血清代谢的潜在靶标通路(图3A),代谢通路影响值大于0.1的靶标代谢路中代谢通路圆点越大表示对代谢组学的重要性越大[13],共筛选出靶标通路6条,分别是:缬氨酸、亮氨酸与异亮氨酸的生物合成,丁酸代谢,酮体的合成与降解,柠檬酸循环,乙醛酸与二羧酸代谢及甘油脂代谢通路。虾青素补充前后涉及的代谢通路共9条(表4),筛选出的靶标通路共2条(图3B),分别是:缬氨酸、亮氨酸与异亮氨酸的生物合成,甘油脂代谢通路。
3 讨论
本研究采用1H-NMR代谢组学技术、MetPA代谢通路分析工具,探讨疲劳运动及虾青素补充对疲劳运动大鼠血清小分子代谢物及代谢通路的影响。
3.1 疲劳运动对大鼠血清代谢的影响
E组与C组大鼠血清差异代谢物共15种,分别参与20条代谢通路,其中缬氨酸、亮氨酸与异亮氨酸的生物合成,丁酸代谢,酮体的合成与降解,柠檬酸循环,乙醛酸与二羧酸代谢及甘油脂代谢6条通路为疲劳运动干预主要涉及的靶标通路。参与以上6条通路的代谢物有缬氨酸(c00183)、亮氨酸(c00123)、异亮氨酸(c00407)、乙酰乙酸(c00164)、α-酮戊二酸(c00026)、琥珀酸(c00042)、柠檬酸(c00158)、甘油(c00116)。本研究将这8种代谢物视为影响疲劳代谢的潜在标志物。
缬氨酸(c00183)、亮氨酸(c00123)和异亮氨酸(c00407)参与缬氨酸、亮氨酸與异亮氨酸的生物合成通路(图4a)。这3种氨基酸均为人体必需氨基酸,统称支链氨基酸(BCAA)。BCAA具有维持血浆游离氨基酸浓度,在长时间耐力运动中参与肌肉氧化供能,调节肌肉蛋白质合成代谢[14],参与糖代谢,促进乳酸糖异生等作用[15]。研究表明,补充BCAA还可抵消长时间耐力运动导致的肌肉疲劳,减少肌细胞内蛋白分解入血[16],削弱延迟性肌肉酸痛,减少运动性肌肉损伤[17-18],增强运动能力[19],促进运动员疲劳恢复[20]。Karl等基于代谢组学的研究表明,51公里/4天的越野滑雪运动后,士兵血浆中BCAA分解代谢增加[21]。Lewis等的研究也表明马拉松运动后受试者血浆中缬氨酸浓度下降[22]。疲劳运动可降低BCAA转氨酶或支链SymbolaA@-酮酸脱氢酶的活化从而导致血浆中BCAA水平的变化[23]。BCAA的转氨作用主要发生在骨骼肌中,其转氨作用的破坏会导致苹果酸/天冬氨酸穿梭受损,从而减少丙氨酸和谷氨酰胺的形成,并增加乳酸与丙酮酸之比[24],而谷氨酰胺减少是过度训练的标志之一[25]。BCAA还可与抑制性神经递质5-羟色胺(5-HT)前体-色氨酸竞争同一载体进入血脑屏障,血清BCAA浓度升高可抑制色氨酸入脑从而减少5-HT的生成与积聚,进而达到延缓疲劳作用,反之亦然。本研究中疲劳运动大鼠血清异亮氨酸、亮氨酸与缬氨酸浓度均下降,表明疲劳运动可加快大鼠血清BCAA分解,或干扰其转氨作用,致使血清BCAA浓度降低,相应地增加了5-HT在脑中积聚,从而导致疲劳发生。
差异代谢物乙酰乙酸(c00164)、α-酮戊二酸(c00026)与琥珀酸(c00042)共同参与丁酸代谢通路(图4b)。丁酸是通过肠道微生物群发酵膳食纤维产生的短链脂肪酸之一,可由碳水化合物经α-酮戊二酸与琥珀酸生成。丁酸盐通过补充肠道防御屏障的各种成分、抑制炎症细胞因子形成及减少氧化应激,对结肠炎和结肠癌产生强烈抑制作用[26],并对大鼠脂肪细胞的储存和动员以及葡萄糖摄取有积极影响[27]。研究报道,低氧诱导因子脯氨酰羟化酶(PHD3)可通过与β2肾上腺素受体(ADRβ2)结合使其羟基化并降解,以上调肌肉中肌肉环状指基因1(MuRF1)和肌肉萎缩F基因(MAFbx, atrogin-1)的表达导致肌肉萎缩,而α-酮戊二酸可特异性下调PHD3的表达以抑制肌肉萎缩,从而改善大鼠肌肉的运动耐力[28]。本研究中SymbolaA@-酮戊二酸浓度下降,可能导致大鼠肌肉耐力下降从而发生疲劳。乙酰乙酸是酮体的一种,是脂肪酸不完全氧化的产物,参与酮体的合成与降解通路(图4c),此通路中β-羟基丁酸转化为乙酰乙酸,乙酰乙酸转化为乙酰CoA被氧化利用。在长时间运动中,供能底物逐渐由葡萄糖转变为甘油三酯和肌糖原,酮体合成增加[29]。Connor等研究表明,耐力自行车运动员尿液乙酰乙酸浓度显著增加,是由于长时间耐力运动使机体糖原大量消耗,脂肪供能加强,而氧供不足使血清中酮体含量明显升高[30]。Nozaki的研究也证实了疲劳运动后受试者血清酮体浓度增加[23],与本研究中疲劳大鼠血液中乙酰乙酸显著升高结果一致,表明本研究中运动供能方式已转变为大量动用脂肪供能,且机体出现供氧不足,从而导致疲劳发生。
差异代谢物柠檬酸(c00158)、α-酮戊二酸(c00026)、琥珀酸(c00042)共同参与三羧酸循环(TCA循环)通路(图4d)。TCA循环是机体氧化供能的最有效方式,TCA循环约产生机体总能量的2/3,是糖、脂质、蛋白质三大物质代谢的联络与转化枢纽,在糖异生、脱氨基与转氨基和脂肪生成中起重要作用[31]。本研究中代谢差异物柠檬酸(CA)作为乙酰-CoA进入TCA循环的起始物质,其浓度大小反映着TCA循环代谢水平的高低。TCA循环中氧化应激、质子泄漏、离子易位和柠檬酸裂解酶活性改变等因素均可使柠檬酸合成过程及氧化磷酸化出现偏离[32]。Zhou等研究表明力竭性游泳运动可显著提升大鼠血清中柠檬酸浓度[33],与本实验结果一致。Nozaki的研究也表明疲劳运动后受试者血清CA浓度升高,其机制可能为疲劳运动造成骨骼肌细胞受损、能量代谢紊乱[23]。CA还参与乙醛酸与二羧酸代谢通路(图4e),该代谢是在乙醛酸体中进行的与脂肪转化为糖密切相关的代谢过程,可通过影响三羧酸循环关键酶活性导致三羧酸循环中各种反应物和产物水平异常[34]。本研究中E组大鼠血清CA浓度升高、α-酮戊二酸与琥珀酸浓度降低,表明运动导致的TCA、乙醛酸与二羧酸代谢紊乱是造成机体疲劳的原因之一。
甘油(c00116)参与甘油脂代谢通路(图4f)。甘油脂代谢是甘油三酯(TG)水解为游离脂肪酸(FFA)和甘油后被机体利用的过程。运动训练可能通过上调葡糖转运蛋白4和下调肌肉素的表达来改善脂质代谢,促进甘油三酯分解[35]。其中甘油转变为3-磷酸甘油后被组织利用,而FFA不溶于水,必须与血浆白蛋白结合进行运输,它与血浆中5-HT前体色氨酸竞争结合蛋白载体,故FFA浓度升高会相应引起游离色氨酸增多,间接导致脑内5-HT聚积,为中枢性疲劳假说提供支持[36]。Lund研究表明,12周的综合耐力与力量训练促进了人运动后活检组织中肌管脂代谢增强[37]。Lyudinina的研究也证实越野滑雪运动时,运动员甘油脂代谢增强[38]。有报道称,马拉松运动时运动员出现广泛的脂肪分解,血浆甘油浓度显著升高,并与其他代谢物共同调节葡萄糖和脂质代谢调节因子Nur77的表达[22]。本研究的运动方式为疲劳运动,运动后血清脂质浓度降低,其分解物甘油浓度升高,表明疲劳运动脂肪动员加强,脂肪酸供能增多,与Stander[39]对运动员马拉松运动后血清代谢组中甘油浓度上升的研究结果一致。由于甘油必须通过有氧氧化途径为机体提供能量,供能速率相对较慢,故血液中甘油浓度增加。
3.2 补充虾青素对疲劳运动大鼠血清代谢的影响
EM组与E组大鼠血清差异代谢物有7种,共参与9条代谢通路,其中缬氨酸、亮氨酸与异亮氨酸的生物合成,甘油脂代谢2条通路为虾青素干预主要涉及的靶标通路。参与以上2条通路的代谢物有缬氨酸(c00183)、亮氨酸(c00123)、异亮氨酸(c00407)和甘油(c00116)。本研究中虾青素主要对疲劳运动涉及的6条靶标通路中的2条,8种潜在代谢标志物中的4种产生影响。
缬氨酸(c00183)、亮氨酸(c00123)和异亮氨酸(c00407)参与缬氨酸、亮氨酸与异亮氨酸的生物合成(图4a)通路。研究表明,BCAA补充可促进组织蛋白合成并加速新陈代谢、延缓运动疲劳[40],低浓度的BCAA与中枢性疲劳密切相关[41]。而虾青素可调节运动代谢,增强運动表现,促进疲劳恢复[42]。Tatiana等研究表明,大鼠45天连续服每天用1毫克ASTA/kg体重游泳疲劳时间明显延迟了29%[43]。Zanghi等研究表明,补充虾青素的狗疲劳运动后支链氨基酸水平明显高于对照组[44]。本研究中EM组大鼠血清BCAA浓度显著高于E组,与Zanghi等的研究结果相似,表明虾青素补充可通过抑制疲劳运动造成的BCAA减少,从而起到延缓疲劳的作用。
甘油(c00116)参与甘油脂代谢通路(图4f)。虾青素可降低肝脏甘油三酯、血浆甘油三酯和总胆固醇浓度,对治疗肥胖和代谢综合征有重要作用[45]。它可以直接与过氧化物酶体增殖物激活受体PPARα和PPARγ相互作用,激活PPARα同时抑制PPARγ,从而减少体外肝细胞的脂质积累[46]。还可促进甘油异生成糖,将甘油先转变为磷酸二羟丙酮,再在醛缩酶的作用下将其转变为1,6-二磷酸果糖,最终转变为葡萄糖被组织摄取利用[47]。Aoi研究表明,补充虾青素4周与正常饮食组大鼠相比,虾青素补充组大鼠运动时的脂肪利用显著提高,且运动时间延长[48]。Ikeuchi研究表明,服用虾青素后,游泳小鼠血浆中脂肪堆积显著降低,运动时间明显延长[47]。Liu等研究也表明,与正常饮食大鼠相比,虾青素喂养大鼠运动后血浆甘油、脂肪酸浓度显著降低,脂质利用加速[49]。本研究中补充虾青素组大鼠血清甘油浓度显著降低,与Ikeuchi及Liu等的研究结果类似,表明虾青素可促进疲劳运动大鼠血清甘油利用,为疲劳运动提供能量。
本研究中的代谢物也可作为底物对信号通路产生影响,下一步的研究可结合相关信号转导通路中酶活性、蛋白或基因表达等变化,从分子和代谢两个水平深入探究疲劳运动对代谢通路与信号传导通路的整体调节作用。
4 结论
4.1 疲劳运动可通过影响缬氨酸、亮氨酸与异亮氨酸的生物合成,酮体的合成与降解,丁酸代谢,三羧酸循环,乙醛酸与二羧酸代谢及甘油脂代谢等6条代谢通路对大鼠机体产生不利影响。
4.2 疲劳运动前补充虾青素可通过改变其中的缬氨酸、亮氨酸与异亮氨酸的生物合成及甘油脂代谢通路达到促进机体脂质代谢、节约BCAA利用、延缓运动疲劳的作用。
参考文献:
[1]WALDRON M, PATTERSON S D, TALLENT J, et al. The Effects of an Oral Taurine Dose and Supplementation Period on Endurance Exercise Performance in Humans:A Meta-Analysis [J]. Sports Medicine, 2018, 48 (5):1247-1253.
[2]袁海峰, 马薇娇, 李泽龙,等.参芪口服液对运动性疲劳大鼠运动能力及氧化应激的影响 [J]. 当代体育科技, 2018,8(6):7-10.
[3]OWENS D J, ALLISON R, CLOSE G L. Vitamin D and the Athlete:Current Perspectives and New Challenges [J]. Sports Medicine, 2018, 48 (1):3-16.
[4]BOWTELL J, KELLY V. Fruit-Derived Polyphenol Supplementation for Athlete Recovery and Performance [J]. Sports Medicine, 2019, 49 (1):3-23.
[5]GUERIN M, HUNTLEY M E, OLAIZOLA M. Haematococcus astaxanthin:applications for human health and nutrition [J]. Trends in Biotechnology, 2003, 21 (5):210-216.
[6]DJORDJEVIC B, BARALIC I, ANDJELKOVIC M, et al. The Effect Of Astaxanthin On Mucosal Immunity, Oxidative Stress And Inflammation In Soccer Players [J]. Medicine & Science in Sports & Exercise, 2015, 47 (5S):894-894.
[7]OLIVER S G, WINSON M K, KELL D B, et al. Systematic functional analysis of the yeast genome [J]. Trends in Biotechnology, 1998, 16 (9):373-378.
[8]KUEHNBAUM N L, GILLEN J B, KORMENDI A, et al. Multiplexed separations for biomarker discovery in metabolomics:Elucidating adaptive responses to exercise training [J]. ELECTROPHORESIS, 2015, 36 (18):2226-2236.
[9]MARKLEY J L, BRüSCHWEILER R, EDISON A S, et al. The future of NMR-based metabolomics [J]. Current Opinion in Biotechnology, 2017(43):34-40.
[10]KALANTARI A, SAREMI A, SHAVANDI N, et al. Impact of Four Week Swimming Exercise with Alpha-Tocopherol Supplementation on Fertility Potential in Healthy Rats [J]. Urology journal, 2017, 14 (5):5023-5026.
[11]侯莉娟, 劉晓莉, 乔德才. 大鼠游泳运动疲劳模型建立的研究 [J]. 实验动物科学与管理, 2005 (1):1-3.
[12]郭庆军, 常耀明, 李金声,等.大鼠游泳运动疲劳模型力竭标准的研究 [J]. 现代生物医学进展, 2010, 10 (15):2855-2858.
[13]杨银平. 基于细胞代谢组学技术的人参皂苷Rb1对SH-SY5Y细胞保护机制研究 [J]. 分析化学, 2019, 47 (1):49-58.
[14]JACKMAN S R, WITARD O C, PHILP A, et al. Branched-Chain Amino Acid Ingestion Stimulates Muscle Myofibrillar Protein Synthesis following Resistance Exercise in Humans [J]. Frontiers in Physiology, 2017(8):390.
[15]HORMOZNEJAD R, ZARE JAVID A, MANSOORI A. Effect of BCAA supplementation on central fatigue, energy metabolism substrate and muscle damage to the exercise:a systematic review with meta-analysis [J]. Sport Sciences for Health, 2019:1-15.
[16]PATTERSON S D, WALDRON M, JEFFRIES O. Chapter 13 - Proteins and Amino Acids and Physical Exercise [M]//WALRAND S. Nutrition and Skeletal Muscle,Academic Press,2019:183-196.
[17]RA S-G, MIYAZAKI T, KOJIMA R, et al. Effect of BCAA supplement timing on exercise-induced muscle soreness and damage:a pilot placebo-controlled double-blind study [J]. J Sports Med Phys Fitness, 2018, 58 (11):1582-1591.
[18]KIM D-H, KIM S-H, JEONG W-S, et al. Effect of BCAA intake during endurance exercises on fatigue substances, muscle damage substances, and energy metabolism substances [J]. J Exerc Nutrition Biochem, 2013, 17 (4):169-180.
[19]GUALANO A B, BOZZA T, LOPES DE CAMPOS P, et al. Branched-chain amino acids supplementation enhances exercise capacity and lipid oxidation during endurance exercise after muscle glycogen depletion [J]. J Sports Med Phys Fitness, 2011, 51 (1):82-88.
[20]JAFARI H, ROSS J B, EMHOFF C-A W. Effects of Branched-Chain Amino Acid Supplementation on Exercise Performance and Recovery in Highly Endurance-Trained Athletes [J]. The FASEB Journal, 2016(30):lb683-lb683.
[21]KARL J P, MARGOLIS L M, MURPHY N E, et al. Military training elicits marked increases in plasma metabolomic signatures of energy metabolism, lipolysis, fatty acid oxidation, and ketogenesis [J]. Physiological reports, 2017, 5 (17):e13407.
[22]LEWIS G D, FARRELL L, WOOD M J, et al. Metabolic Signatures of Exercise in Human Plasma [J]. Science translational medicine, 2010, 33(2):33-37.
[23]NOZAKI S, TANAKA M, MIZUNO K, et al. Mental and physical fatigue-related biochemical alterations [J]. Nutrition, 2009, 25 (1):51-57.
[24]SHE P, ZHOU Y, ZHANG Z, et al. Disruption of BCAA metabolism in mice impairs exercise metabolism and endurance [J]. Journal of Applied Physiology, 2010, 108 (4):941-949.
[25]SMITH D J, NORRIS S R. Changes in glutamine and glutamate concentrations for tracking training tolerance [J]. Med Sci Sports Exerc, 2000, 32 (3):684-689.
[26]CAGLAR A, TOMAR O, EK?倫Z T. Butyric Acid:Structure, Properties and Effects on Health [J]. Kocatepe Veterinary Journal, 2017, 10 (3):213-225.
[27]HEIMANN E, NYMAN M, DEGERMAN E. Propionic acid and butyric acid inhibit lipolysis and de novo lipogenesis and increase insulin-stimulated glucose uptake in primary rat adipocytes [J]. Adipocyte, 2015, 4 (2):81-88.
[28]CAI X, YUAN Y, LIAO Z, et al. α-Ketoglutarate prevents skeletal muscle protein degradation and muscle atrophy through PHD3/ADRB2 pathway [J]. The FASEB Journal, 2017, 32 (1):488-499.
[29]EVANS M, COGAN K E, EGAN B. Metabolism of ketone bodies during exercise and training:physiological basis for exogenous supplementation [J]. The Journal of Physiology, 2017, 595 (9):2857-2871.
[30]OCONNOR, JAMES W. Comparative changes in plasma, urine and sweat during endurance exercise using NMR-based metabolomics [J]. Medical Research Archives, 2015, 2 (3):15-21.
[31]AKRAM M. Citric Acid Cycle and Role of its Intermediates in Metabolism [J]. Cell Biochemistry and Biophysics, 2014, 68 (3):475-478.
[32]ALVES TIAGO C, PONGRATZ REBECCA L, ZHAO X, et al. Integrated, Step-Wise, Mass-Isotopomeric Flux Analysis of the TCA Cycle [J]. Cell Metabolism, 2015, 22 (5):936-947.
[33]ZHOU W, ZENG G, LYU C, et al. The Effect of Exhaustive Exercise on Plasma Metabolic Profiles of Male and Female Rats [J]. J Sports Sci Med, 2019, 18 (2):253-263.
[34]張宁. 穿山龙抗急性痛风性关节炎的肾脏代谢组学研究 [J]. 中华中医药杂志, 2017(5):2034-2039.
[35]YU J, ZHENG J, LIU X F, et al. Exercise improved lipid metabolism and insulin sensitivity in rats fed a high-fat diet by regulating glucose transporter 4 (GLUT4) and musclin expression [J]. Brazilian Journal of Medical and Biological Research, 2016, 49(5):e5129.
[36]MANAF F A, LAWLER N G, PEIFFER J J, et al. Characterizing the plasma metabolome during and following a maximal exercise cycling test [J]. Journal of Applied Physiology, 2018, 125 (4):1193-1203.
[37]LUND J, RUSTAN A C, LVSLETTEN N G, et al. Exercise in vivo marks human myotubes in vitro:Training-induced increase in lipid metabolism [J]. PLOS ONE, 2017, 12 (4):e0175441.
[38]LYUDININA A Y, IVANKOVA G E, BOJKO E R. Priority use of medium-chain fatty acids during high-intensity exercise in cross-country skiers [J]. Journal of the International Society of Sports Nutrition, 2018, 15 (1):1-8.
[39]STANDER Z, LUIES L, MIENIE L J, et al. The altered human serum metabolome induced by a marathon [J]. Metabolomics, 2018, 14 (11):150.
[40]GERVASI M, SISTI D, AMATORI S, et al. Effect of a Carbohydrate/Branched Chain Aminoacids/Alanine sport nutritional supplement (Friliver performance) on perceived exertion in a 9-weeks high intensity interval training sessions [J]. Clinical Nutrition, 2018(37):S299-S299.
[41]QUIROGA N, DINUNZIO C, VAN SCOY J, et al. EFFECTS OF BRANCH CHAIN AMINO ACID SUPPLEMENTATION IN DELAYING CENTRAL FATIGUE; proceedings of the International Journal of Exercise Science:Conference Proceedings, F, 2017 [C].
[42]BROWN D R, GOUGH L A, DEB S K, et al. Astaxanthin in Exercise Metabolism, Performance and Recovery:A Review [J]. Frontiers in Nutrition, 2018,76(4):1-9.
[43]POLOTOW T G, VARDARIS C V, MIHALIUC A R, et al. Astaxanthin supplementation delays physical exhaustion and prevents redox imbalances in plasma and soleus muscles of Wistar rats [J]. Nutrients, 2014,12(6):5819-5838.
[44]ZANGHI B M, MIDDLETON R P, REYNOLDS A J. Effects of postexercise feeding of a supplemental carbohydrate and protein bar with or without astaxanthin from Haematococcus pluvialis to exercise-conditioned dogs [J]. American Journal of Veterinary Research, 2015,76(4):338-350.
[45]IKEUCHI M, KOYAMA T, TAKAHASHI J, et al. Effects of Astaxanthin in Obese Mice Fed a High-Fat Diet [J]. Bioscience, biotechnology, and biochemistry, 2007,71(4):893-899.
[46]JIA Y, WU C, KIM J, et al. Astaxanthin reduces hepatic lipid accumulations in high-fat-fed C57BL/6J mice via activation of peroxisome proliferator-activated receptor (PPAR) alpha and inhibition of PPAR gamma and Akt [J]. The Journal of Nutritional Biochemistry, 2016(28):9-18.
[47]IKEUCHI M, KOYAMA T FAU - TAKAHASHI J, TAKAHASHI J FAU - YAZAWA K, et al. Effects of astaxanthin supplementation on exercise-induced fatigue in mice [J]. 2006, 29 (10):2106-2110.
[48]AOI W, NAITO Y FAU - TAKANAMI Y, TAKANAMI Y FAU - ISHII T, et al. Astaxanthin improves muscle lipid metabolism in exercise via inhibitory effect of oxidative CPT I modification [J]. Biochemical and Biophysical Research Communicadons, 2008, 366 (4):892-897.
[49]LIU P H, AOI W, TAKAMI M, et al. The astaxanthin-induced improvement in lipid metabolism during exercise is mediated by a PGC-1alpha increase in skeletal muscle [J]. J Clin Biochem Nutr, 2014, 54 (2):86-89.
