辣椒抗白粉病基因CaML04的克隆和表达分析
2020-06-24肖仲久李小霞宋培勇
肖仲久 李小霞 宋培勇


摘要:MLO基因是植物中特有的一类抗病负调控因子,该基因突变导致植物产生广谱抗病性。为研究MLO基因在辣椒中表达模式及功能分析,以前期本课题组通过SSH文库获得的ESTs,设计引物,采用RT- PCR和RACE的方法,成功克隆了一个CaML04基因,并对该基因的特性和表达模式进行了初步分析,结果显示了该CaML04基因可能参与辣椒白粉病的调控过程。
关键词:辣椒;MLO基因;表达分析
中图分类号:S641 文献标识码:A 文章编号:1674-9944 (2020) 2-0188-03
1 引言
辣椒在我国栽培面积约100多万hm2[1]妇,面积居蔬菜的第二位,消费人群高达5亿多人[2]。在我国,以贵州、湖南、重庆等16个省份为重点辣椒种植区,辣椒产业已经成为我国许多省区农业增效和农民增收的一条重要途径。辣椒白粉病(Leveillula taurica)是一种世界性病害,已经相继在我国各辣椒产区普遍发生[3-6]。
MLO基因最早是在禾本科植物类中描述的,MLO家族成员在单子叶和双子叶植物中起到调节宿主对白粉病菌响应的作用[7,8]。学者们目前已对拟南芥、水稻、玉米和杨树中的Mlo基因家族有深入的研究,而在辣椒中报导较少。因此,本研究以前期获得的ESTs,设计引物,采用RT- PCR和RACE的方法成功克隆了一个CaML04基因,并对其序列特性和表达模式进行了初步的分析,以期为辣椒CaML04基因在辣椒抗病分子育种中的应用提供依据[9]。
2 材料与方法
2.1 材料及处理
实验所用抗病辣椒材料为‘遵辣一号。辣椒培养条件及白粉菌接种等方法参考文献[10]。
2.2 RNA提取和cDNA第一链合成
所有辣椒组织在液氮中磨成粉末。总RNA用Tr-izol -步法抽提试剂盒提取,参照TaKaRa公司反转录试剂盒说明书进行反转录合成cDNA第一链。
2.3 CaML04基因的克隆及测序
利用课题组前期获得的辣椒ESTs数据,设计引物,以“遵椒一号”的cDNA为模板,采用TaKaRa公司的RACE及RT- PCR试剂盒,克隆获取基因的全长序列。条带割胶后用TaKaRa DNA凝胶回收试剂盒进行回收、纯化,再用TaKaRa公司的pMD18-T对回收、纯化后的片段进行连接,挑取阳性克隆送诺赛基因公司测序。
2.4 生物信息学分析
在NCBI网站(http://www,ncbi.nlm. nih.gov/)上BLASTp進行蛋白预测,利用Specialized BLAST( CDDsearch)进行保守域分析。在蛋白生物信息学网站( http://www. expasy.org/proteomics)上对CaM-L04蛋白进行理化性质、亲/疏水性、跨膜结构及三级结构预测和分析。
2.5 CaML04基因的表达分析
2.5.1 半定量RT- PCR分析
根据CaML04测序结果,利用Primer Premier5.00软件设计引物,检测了CaMLO4基因在接种辣椒白粉菌后不同时间点的表达模式,以辣椒Actin基因为内参调整半定量RT- PCR的模板用量。RT- PCR反应的体系为25μL,包括:经内参调整的适宜体积的cD-NA模板,10×PCR buffer 2.5μL, MgC12 (25mol/L),dNTP(IO mmol/L)0.5μL,正向引物(10 mmol/L)1μL,反向引物(10 mmol/L)1μL,Taq DNA polymerase(2.5 U/μL)0.5 μL,ddH20补足至25μL。反应条件为:94℃预变性3 min,94℃变性30 s,55℃退火30 s,72℃延伸30 s,共进行35个循环(扩增平台期前),最后72℃延伸5 min。
2.5.2 Norther杂交验证
经过探针标记、标记效率检测、RNA变性电泳、RNA印迹转移、杂交、洗膜、杂交显色及拍照等步骤,分析Norther杂交结果。
3 结果与讨论
3.1 完成辣椒总RNA的提取及反转录
高质量的总RNA是构建cDNA文库的首要前提。本试验采用Trizol 一步法抽提试剂盒(稍作改良)提取辣椒叶片的总RNA,紫外分光光度计测定OD260/OD280为1.9~2.0,表明所提取的总RNA纯度较高,质量较好,基本没有蛋白质和DNA残留;利用1.2%的非变性琼脂糖凝胶电泳检测,28S、18S和5SrRNA条带清晰、无拖尾,且28S带的亮度约为18S的1.5~2倍;说明所提取的总RNA其完整性较好,所提取的RNA未出现降解,质量较好,根据260nm处的光吸收值计算RNA样品的浓度,稀释RNA浓度至100 ng/μL以备用。为后续进行反转录实验提供了可能(图1)。
3.2 辣椒CaML04基因的克隆
以课题组前期获得的CaMLO基因的ESTs片段为设计引物,利用RT -PCR和RACE技术,通过多次扩增、产物克隆和测序等手段,从辣椒材料中克隆获得了1个CaML04全长序列。CaML04基因的cDNA序列全长为1637 bp,包括1515 bp的ORF,其ORF编码一个含有504个氨基酸的蛋白质。
CaML04基因编码的氨基酸:
MGNLEGASFSETPTYAVATVVTVI_VSIGFI_IH GSLKKFGKWLHKTKREPLYAALEKIKEELMVFGL LSLLMGHWIIYVAKICVKASAVSSHFYPCSPPRNK TESAITRFVI_SGSSYSNFSISRLLLSSGHVNYCPE GLQSFASKESLEQLHRFLLVL_GVSHVSYSFFAIAL AMIKIYSWRTWENNAKSMALQRLEGSEEPVANN TRMGRLSTFTFH HTTHPWSQHRAI_VWLLCFSR QFWSSINEADYMALRLGFITTHQLPLTYDFHKY MLRSMEEEFRDIVGISVPLWIFVII.CVFLSFHGTN IYFWISFFPAILILLVGTKLHRVVVKLAVEIMDSSP LEGFHQFNLRDELFWFGKPRFLLRIIQFISFQWE IKGASCFTENHTFl_VIRLSFGVlsoFWCSFVTFP LYVIVAQMGSRYKKTIVSENVRTSLHGWRHKVK ARLEGSVVSPETLLAATSLDSMEEDEADQIHTIVS DQHVTLEQSCTNEISECDELHIPLSPRI
3.3 生物信息学分析
利用在线软件ExPASy中的ProtParam程序预测CaML04蛋白的理化性质,结果表明:该蛋白的分子式为C2659H4075N6830715S21,由8153个原子组成,分子质量为57724. 01,氨基酸总数为504,含量最多的是亮氨酸(11.5%),其次是丝氨酸(10.7%)、笨丙氨酸和缬氨酸(7.3%);带负电荷的残基总数(Asp+Glu)为43,带正电荷的残基总数(Arg+Lys)为46,说明该蛋白带正电荷;总平均亲水性( GRAVY)为0.176,为疏水性蛋白;理论等电点为8. 29,为偏碱性蛋白;摩尔消光系数为24930,在哺乳动物网织红细胞内的半衰期为30 h,不稳定指数为43. 38,脂肪指数为98. 61,根据Gu-ruprasad方法表明CaML04为不稳定蛋白。利用在线软件ExPASy中的ProtScale程序预测CaML04蛋白的亲水性/疏水性(图2),294位点处有最大值为3. 678,100位点处有最小值为-2. 322,故CaML04蛋白为疏水性,与理化性质预测的结果一致。
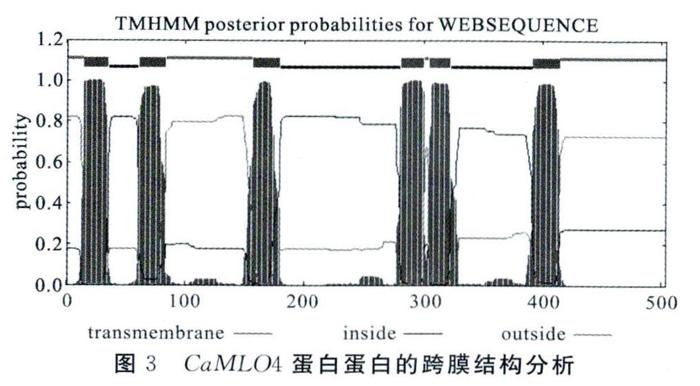
跨膜结构域是膜中蛋白与膜脂结合的主要部位,一般由20个左右的疏水氨基酸残基组成,形成a螺旋,与膜脂相结合。预测和分析跨膜结构域对认识蛋白质的结构、功能、分类以及在细胞中的作用部位均存在一定的意义。利用TMHMM2.O Serve在线软件对CaM-L04基因的氨基酸进行了跨膜结构域的分析。如图3所示,CaML04蛋白的跨膜结构预测结果均显示包含6个跨膜结构( seven- TM)。CaML04蛋白的6次跨膜结构域,分别在15 - 35,61- 83, 157 - 179. 281 - 300,305-322,392-414个氨基酸处形成跨膜的结构域。
利用 NCBI 中的 Conserved Domain Database( CDD)数据库对CaML04蛋白的保守结构域进行预测,结果显示(图4)该蛋白为MLO蛋白超家族成员。利用在线软件PSORT II Prediction分析CaML04蛋白的亚细胞定位,发现该蛋白在plasma membrane中分布最多,达60. 9%,其次为endoplasmic reticulum和vacuolar,达13.0%,再次是nuclear,mitochondrial,Golgi中也有分布,达4.3%。利用在线软件SWISS-MODEI。对CaML04蛋白进行同源模建,预测其三级结构模型,其最佳模型是(图5),序列一致性为23. 08%;另一模型是4ib4.1,A。
3.4 CaML04基因表达模式分析
RT- PCR分析表明(图6),样品在35个循环时就有大量擴增产物出现,说明供试基因在白粉菌接种后的cDNA群体中表达丰度较高,在未接种白粉时CaML04基因有一定的本底表达,接种白粉病菌后24 h表达量开始升高,36 h时达到最大,后续出现了较明显的下调,基因的Northern杂交中(图7),可以看出,在oh时就略微有表达,在36h时开始增加,并且在以后的48h表达量最高,与RT- PCR验证有一些区别。这与已经报道的拟南芥和甜瓜MLO基因表达模式相似,说明CaML04基因可能参与辣椒白粉病的调控过程。
4 结论
白粉病是辣椒生产上重要的病害之一,主要是叶片受害。抗病育种是解决辣椒白粉病的一种有效方法[11]。MLO是植物所特有且广泛存在的基因家族,不同植物中的MLO家族成员数差异较大,但其中多数MLO基因的功能尚不明确[12,13]。研究发现,本研究克隆的CaML04受到白粉病菌的诱导,在未接种白粉时CaML04基因有一定的本底表达,接种白粉病菌后24h表达量开始升高,36~48 h时达到最大,后续出现了较明显的下调,说明CaML04基因可能参与辣椒白粉病的调控过程,推测其为辣椒白粉病抗性相关基因,目前CaML04的功能作用仍在进一步研究中。因此,通过对辣椒ML04基因的克隆及序列特性的分析,可为后续MLO基因在辣椒抗病分子育种中的应用提供重要信息。
参考文献:
[1]中华人民共和国农业部,中国农业统计资料[M].北京:中国农业出版社,2003:318.
[2]林 明.辣椒应答逆境的转录谱分析及相关候选基因cDNA分离与鉴定[D].福州:福建农林大学博士学位论文.2008.
[3]李明远.茄科蔬菜白粉病的发生与防治[J].中国蔬菜,2004(6):57 -58.
[4]白 滨,胡冠芳.甘肃省辣椒病害新纪录——辣椒白粉病[J].甘肃农业科技,2002(7):46.
[5]方德立,贾菊生,张 丽,等.新疆辣椒病害——新纪录——辣椒白粉病[J].新疆农业科学,2002,39(1):25-26.
[6]李凡,胡东维,陈锋,等,小麦TaMIo基因的原核表达、抗体制备及细胞化学分析(简报)[J].实验生物学报,2005, 38(6):550 -554.
[7]刘建霞,温日宇,周风,等.抗白粉病小偃麦衍生系的遗传学研究[J].广东农业科学,2011, 38(2):21-22.
[8]魏小春,孟纯阳,赵艳艳,等.辣椒CaWRKY13基因克隆及非生物胁迫下表达分析[J].中国农学通报,2019,35 (21):118 - 124.
[9]肖仲久,蒋选利,李小霞,等,壳寡糖诱导辣椒抗白粉病的初步研究[J].湖北农业科学.2009·48(3):617-619.
[10]陈玲,邱显钦,张颢,等.不同物种Mlo基因生物信息学分析[J].西南农业学报,2012 ,25(4):1302-1308.
[11]张孝廉,张吉顺,郭玉双,等.烟草NtML05a和NtMI.05b基因克隆和表达分析[J].植物生理学报,2019 ,55(2):148—158.
[12]Wang X, Ma Q, Dou L,et al.Genome wide characterizationand comparative analysis of the MLO gene family in cotton[J].Plant Physiol Biochem, 2016( 103): 106 -119.
[13]Fujimura T, Sato S,Tajima T, et al.Powdery mildew resistancein the Japanese domestic tobacco cultivar Kokubu is associatedwith aberrant splicing of ML() orthologues [J]. Plant Pathol,2016(65)11358-1365,
作者简介:肖仲久(1980-),男,教授,研究方向为植物病理学。
