2种内膜准备方案对反复种植失败患者子宫内膜孕激素受体和整合素αⅤβ3表达的影响
2020-06-24许虹康小玲徐丽清朱秀兰张曦倩
许虹,康小玲,徐丽清,朱秀兰,张曦倩
反复种植失败(repeated/recurrent implantation failure,RIF)是现代辅助生殖技术的“顽疾”,对于多次移植优质胚胎均失败的患者来说,如何改善子宫内膜容受性、提高子宫内膜与胚胎发育的同步性是成功获得妊娠的关键[1-2]。因此,冻融胚胎移植(frozenthawed embryo transfer,FET)内膜准备方案的选择至关重要[3]。子宫内膜的孕激素受体(progesterone receptor,PR)、整合素αⅤβ3等是目前研究认为较有代表性的子宫内膜容受性标志物。本研究通过比较自然周期(naturecycle,NC)和激素替代周期(hormone replacement treatment,HRT) 内膜准备方案对RIF患者种植窗口期PR和整合素αⅤβ3表达的影响,探讨这2种方案对子宫内膜容受性的影响,为临床医生针对RIF患者选择FET内膜准备方案提供参考。
1 对象与方法
1.1 研究对象 选取2017年6月—2019年4月在广东省妇幼保健院(我院)行体外受精-胚胎移植(IVF-ET)或胞浆内单精子注射(ICSI)助孕,经历3次或3次以上移植周期且每周期至少移植1枚优质胚胎仍未获得妊娠者为研究对象,共43例。患者取卵年龄<38岁,基础内分泌及月经周期正常。排除标准:①双子宫、单角子宫、中隔子宫、子宫黏膜下肌瘤(剔除术后)、宫腔粘连、既往周期子宫内膜≤6 mm等病理因素,②盆腔子宫内膜异位症、卵巢子宫内膜异位囊肿或子宫腺肌病,③输卵管积水,④多囊卵巢综合征。本研究获得我院伦理委员会批准,所有患者签署知情同意书。
1.2 研究方法
1.2.1 子宫内膜的收集43例患者根据内膜准备方案分成2组:NC组25例,HRT组18例。内膜准备方案按照我院《IVF及衍生技术临床操作规程》执行[4]。NC组均月经周期规律,月经第3~5天行阴道超声了解子宫内膜厚度和卵巢情况,月经第10~12天开始监测卵泡发育,确定排卵日,黄体酮肌内注射或阴道给药行黄体支持。HRT组月经第3~5天查性激素及阴道超声检查,符合标准者口服戊酸雌二醇(4~6 mg/d),每5~7 d根据子宫内膜厚度及血清雌二醇(estradiol,E2)水平适时调整药物剂量,当子宫内膜厚度达到8 mm或以上且E2水平至少150 ng/mL时,黄体酮肌内注射或阴道给药进行内膜转化。
在黄体中期采用内膜取样器(北京赛普九洲)收集子宫内膜(NC组排卵后5~7 d,HRT组孕酮转化后5~7 d)。同一天上午8:00~10:00检测静脉E2和孕激素(progesterone,P)。
1.2.2 检测方法
1.2.2.1 E2和P的测定由本科实验室检测,采用全自动化学免疫发光法,试剂盒购自罗氏诊断产品上海有限公司,批间和批内变异系数均<5%。
1.2.2.2 常规病理检查所有采集的标本均按照常规病理组织处理流程进行处理,对测试病例的HE切片进行镜下再筛选,挑出代表蜡块进行连续切片,厚度3~4 μm。1张用于常规HE染色镜检,按Noyes标准行子宫内膜组织学分期,另2张用于免疫组化测定。
1.2.2.3 PR和整合素αⅤβ3的免疫组化检查一抗分别为兔抗人整合素αⅤβ3多克隆抗体(Bioss公司)和PR兔抗人单克隆抗体(罗氏公司),用SP法对子宫内膜整合素αⅤβ3和PR表达进行定位和半定量测定。根据说明书,用稀释液将抗体分别配置成1∶50、1∶100、1∶200三个浓度,对已知阳性片进行测试,选择最佳浓度,为1∶100。试剂盒已知抗体阳性切片作为阳性对照,阴性片由磷酸盐缓冲液(PBS)作为空白对照。按照实验步骤对玻片进行脱蜡、柠檬酸盐缓冲液抗原修复和免疫组化染色。
免疫组化结果由我院2名病理医生采用盲法阅片。按Budwit-Novotny提出的组织化学评分(H-score)法判断表达程度,阳性细胞是细胞膜或者胞浆(αⅤβ3表达)或者细胞核(PR表达)染成黄色、棕色或棕褐色者。随机选择每张切片的5个高倍镜视野(×400),计数每个视野中每100个细胞的阳性细胞数,得出阳性细胞百分率,折换成染色强度评分(0:阴性,1:弱阳性,2:中等强度阳性,3:强阳性),计算平均值。
1.3 统计学方法 采用SPSS 24.0进行统计分析。定量资料正态分布的数据用均数±标准差(±s)表示,组间比较用t检验;方差齐性检验不齐者使用t′检验。非正态分布的数据用中位数和百分位数[M(P25,P75)]表示,组间比较用秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 2组患者一般临床资料的比较 2组患者在年龄、既往移植周期数、黄体中期(收集标本日)子宫内膜厚度和血清P水平比较,差异均无统计学意义(均P>0.05),HRT组黄体中期血清E2水平比NC组高,差异有统计学意义(t′=3.097,P=0.005)。见表1。

表1 2组患者一般临床资料的比较 (x±s)
2.2 2组患者黄体中期子宫内膜PR、整合素αⅤβ3的表达和比较 PR主要表达于子宫内膜腺上皮细胞(见图1箭头A和图2箭头A)和间质细胞(见图1箭头B和图2箭头B)的细胞核中,细胞质中未见表达(见图1和图2,封三)。2组患者腺上皮细胞PR和间质细胞中PR表达的H-score评分比较,差异均无统计学意义(均P>0.05)。整合素αⅤβ3主要在子宫内膜腺上皮的细胞质和胞膜表达,间质细胞未见表达(见图3、图4,封三)。2组患者子宫内膜腺上皮细胞整合素αⅤβ3表达的H-score评分比较,差异无统计学意义(Z=-0.013,P=0.990)。见表2。
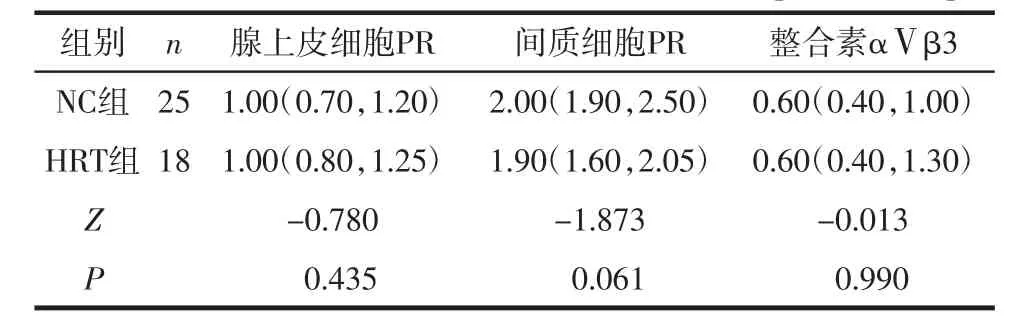
表2 2组患者子宫内膜整合素αⅤβ3和PR的H-score评分比较[M(P25,P75)]
3 讨论
子宫内膜容受性差、子宫内膜和胚胎发育不同步是RIF的主要原因[5-6],如何提高种植窗子宫内膜容受性,增加子宫内膜与胚胎发育的同步性是获得成功妊娠的关键。笔者既往回顾性分析结果表明,选择恰当的内膜准备方案有助于RIF患者获得满意的结局,NC、HRT、诱发排卵和降调节后HRT几种方案助孕结局相当,NC和HRT方案更常应用于临床[4]。因此,本研究选取NC和HRT方案,进一步探讨这两种方案对RIF患者子宫内膜容受性影响的分子机制。
种植窗期是指正常月经周期时,受精卵着床开始于排卵后5~9 d,一般为月经周期的第20~24天。雌、孕激素作用于雌激素受体(estrogen receptor,ER)和PR,引发子宫内膜发生一系列形态学、分子生物学和蛋白质组学的变化,启动和维持子宫内膜种植窗的开放。PR在子宫内膜的表达受雌孕激素的调控,增生期随着E2水平升高内膜腺体中PR的表达逐渐升高,分泌中晚期PR的表达受孕激素调控明显下降,但各时期子宫内膜间质中PR的表达未见明显变化。以往研究证实,分泌期孕激素升高PR下调是触发着床起始的关键,是胚胎着床的必要条件[7]。Young等[8]研究显示,孕激素抵抗引起种植窗期PR异常高表达,可导致黄体功能不全、流产和不孕等。Chai等[9]研究表明,超促排卵周期患者子宫内膜腺体ERα表达量比NC患者高,而PR表达量比NC患者低,超促排卵使患者体内产生的大剂量E2影响子宫内膜容受性,导致胚胎种植失败。但也有研究表明,种植窗口期ER对子宫内膜容受性影响不大,而腺上皮细胞PR下调和间质细胞PR上调的失败是导致子宫内膜容受性下降的原因之一[10]。本研究HRT组黄体中期血清E2水平比NC组稍高,但并不足以影响子宫内膜容受性。NC组和HRT组种植窗期子宫内膜腺体和间质的PR表达差异无统计学意义,其原因为本研究无论是NC还是HRT方案均添加外源性孕酮加强黄体支持,取样日2组患者孕激素水平差异无统计学意义,介导内膜PR表达下调亦一致。总之,在临床工作中,对于RIF患者FET周期采用何种内膜准备方案应根据患者具体月经周期、既往方案情况等决定,合适的黄体支持是提高种植窗口期子宫内膜容受性的关键。
整合素αⅤβ3是细胞黏附分子家族的重要成员,通过连接细胞外基质和细胞骨架,参与细胞内外信息传递,同时介导胚胎与子宫内膜的双向识别、黏附和种植。整合素αⅤβ3在子宫内膜腺上皮细胞的表达具有时空特异性,峰值时间与种植窗口开放高度一致,是目前公认最具代表性的与子宫内膜容受性相关的黏附分子。以往研究发现,输卵管积水、子宫内膜异位症[11]、未破裂卵泡黄素化[12]和不明原因不孕[13-14]患者子宫内膜整合素αⅤβ3低表达,导致子宫内膜容受性降低,是这类患者不孕的病因之一。冯亭亭[15]研究提示,RIF患者种植窗期子宫内膜整合素αⅤβ3的表达比既往有助孕妊娠史拟再次助孕患者低,推测整合素αⅤβ3的表达异常导致子宫内膜接受胚胎的能力降低,这可能是引起RIF的原因之一。Tei等[16]的前瞻性研究表明,不明原因RIF患者子宫内膜整合素αⅤβ3表达比病因明确不孕患者低,采用达那唑治疗可明显提高不明原因RIF患者子宫内膜整合素αⅤβ3的表达。女性体内雌、孕激素通过ER、PR发挥调节子宫内膜整合素表达的作用,孕激素上调子宫内膜整合素表达,而雌激素则抑制整合素表达。本研究表明2组患者种植窗期孕酮水平和PR表达差异无统计学意义,HRT组E2水平比NC组高,但都在黄体中期正常生理范围内,因而NC组和HRT组黄体中期子宫内膜整合素αⅤβ3表达差异亦无统计学意义,这2种方案并不影响子宫内膜容受性。
因此,对RIF患者应用哪种内膜准备方案不是关键,更重要的是种植窗口期合适的雌、孕激素水平;对于临床医生,采取恰当的黄体支持方案能改善子宫内膜容受性,增加RIF患者成功获得妊娠的可能。
