乳房早发育女童的临床转归及中枢性性早熟危险因素分析
2020-06-24陈瑾林蕴周一凝林爱琳
陈瑾 林蕴 周一凝 林爱琳
乳房早发育是性早熟的一种类型,定义为女孩在8岁之前只出现乳房早发育,而不伴有其他第二性征,绝大部分为良性自限性疾病,有小部分会进展为中枢性性早熟(central precocious puberty,CPP)[1],鉴别单纯性乳房早发育和CPP是很重要的,后者可能影响最终的成人身高和初潮年龄,也可能造成严重的心理影响[2-3]。乳房早发育发生的年龄与CPP之间的关系尚不清楚。较多研究认为乳房发育较晚出现,特别是2岁以上,与青春期提前有关[4-5]。近期也有研究发现2岁以下发病的女童中有相当一部分(29.1%)出现青春期提前[6]。本研究旨在对乳房早发育的不同年龄段患儿进行临床随访研究,了解其临床转归,并对可能的CPP危险因素进行分析,现报道如下。
1 对象和方法
1.1 对象 选取2016年1月至2017年6月在本院儿科门诊就诊的8岁前出现乳房早发育的女童128例,年龄9~96个月,中位年龄50个月。根据发病年龄分成2组:A组56例(<24个月),B组72例(24~96个月)。所有患儿无其他性征发育,无青春期身高突增,无骨龄加速等表现。排除中枢神经系统器质性疾病、外周性性早熟、其他内分泌代谢疾病、长期用药史的患儿。本研究经过医院医学伦理委员会批准,并获得患儿家长的知情同意。
1.2 方法
1.2.1 随访内容 记录所有患儿初诊年龄(患儿首次就诊时的年龄)和发病年龄(患儿出现乳房发育的年龄),并在就诊时及随访时均记录实际年龄(chronological age,CA)、身高、身高标准差评分(height standard deviation score,H-SDS)、体重、体重标准差评分(weight standard deviation score,W-SDS)、体重指数(body mass index,BMI)、乳房发育是单侧还是双侧、按Tanner标准评价乳房发育分期。定期门诊随访,每3个月随访1次,如遇乳房增大随时就诊,最少随访时间为12个月。
1.2.2 性激素测定 采用免疫化学发光法测定性激素水平:促卵泡激素(follicle stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、催乳素(prolactin,PRL)、雌二醇(estradiol,E2)、睾酮(estradiol,T)。乳房发育不消退或退而反复的患儿进行促性腺激素释放激素(gonadotropin releasing hormone,GnRH)激发试验,戈那瑞林针(马鞍山丰原制药有限公司生产,批号:国药准字H10960064)2.5μg/kg(最大剂量 100μg)静脉注射,分别于注射后 0、30、60、90、120min 采血测定血清 LH 和FSH,以LH峰值>5U/L、LH/FSH峰值>0.6作为下丘脑-垂体-性腺轴(hypothalamic-pituitary-gonadal,HPG 轴)活化的标准。
1.2.3 影像学检查 拍摄患儿左手腕骨龄片,根据G-P(Greulich-Pyle)图谱法评估骨龄(bone age,BA),在整个随访期间,评估BA/CA比率。对子宫及其附件进行B超检查,记录子宫长径(uterine longitudinal diameter,ULD)、左卵巢容积(left ovarian volume,LOV)、右卵巢容积(right ovarian volume,ROV)。必要时进一步行头颅MRI检查。
1.2.4 CPP诊断 第二性征提前出现,线性生长加速,骨龄超前,性腺增大,并有HPG轴功能启动[7]。
1.3 统计学处理 应用SPSS 20.0统计软件,正态分布的计量资料以±s表示,两组间比较采用两独立样本t检验;非正态分布的计量资料采用中位数、四分位数表示,两组间比较采用Mann-Whitney检验;计数资料以百分率表示,组间比较采用χ2检验;采用多因素logistic回归进行危险因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 两组患儿初诊时临床资料的比较 见表1。
由表 1可见,两组间病程、H-SDS、W-SDS、乳房发育分期Tanner2期/3期比例、BA/CA、FSH值比较差异均有统计学意义(均P<0.05),而两组出生体重、BMI、乳房发育单/双侧比例、LH、E2值的比较差异均无统计学意义(均P>0.05)。
2.2 两组患儿随访结果比较 128例患儿失访15例,随访成功113例,其中A组 44例,B组69例,随访率为88.28%。随访成功的患儿年龄10~96个月,中位年龄60个月,其中A组10~24个月,中位年龄20个月,B组40~96 个月,中位年龄 81 个月;随访时间 12~24(17.42±3.80)个月,其中A组12~24(17.31±3.63)个月,B 组 12~24(17.48±3.94)个月。经家长同意,有29例患儿行头颅MRI检查,均未见异常,27例患儿行GnRH激发试验。A组有4例患儿乳房发育持续不退,其中1例进展为CPP;B组中有4例患儿乳房发育退而反复,其中2例进展为CPP,有17例乳房发育持续不退,其中11例进展为CPP,有4例患儿乳房从B2期进展为B3期,均进展为CPP。至随访结束,两组患儿乳房发育消退84例(74.34%),持续不退或进展25例(22.12%),退而反复4例(3.54%),A组患儿乳房发育消退率明显高于B组,差异有统计学意义(P<0.05)。见表 2。
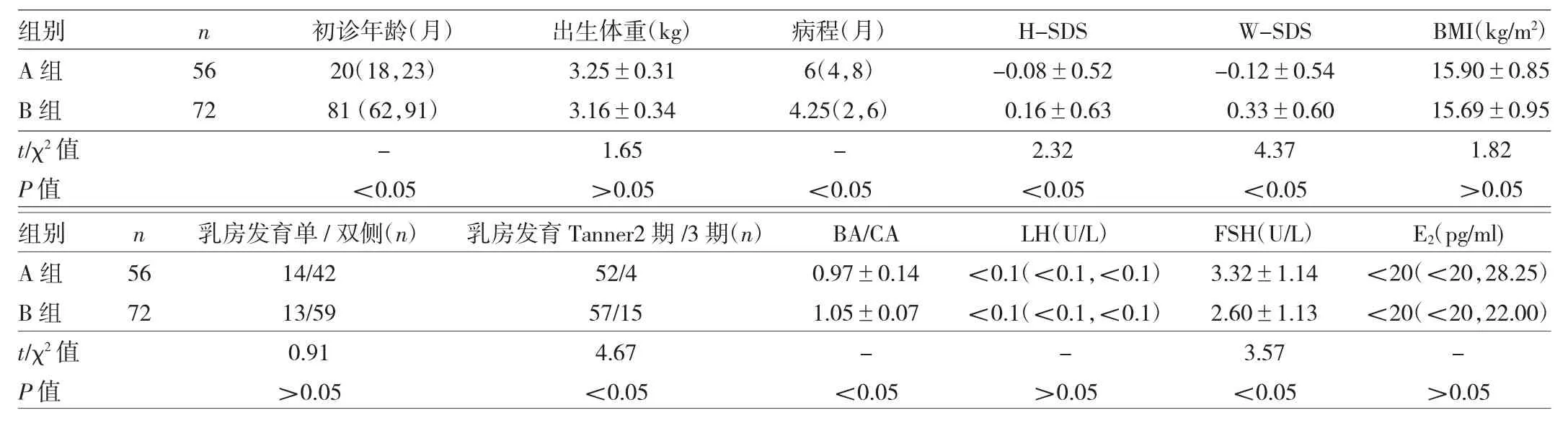
表1 两组患儿初诊时临床资料的比较
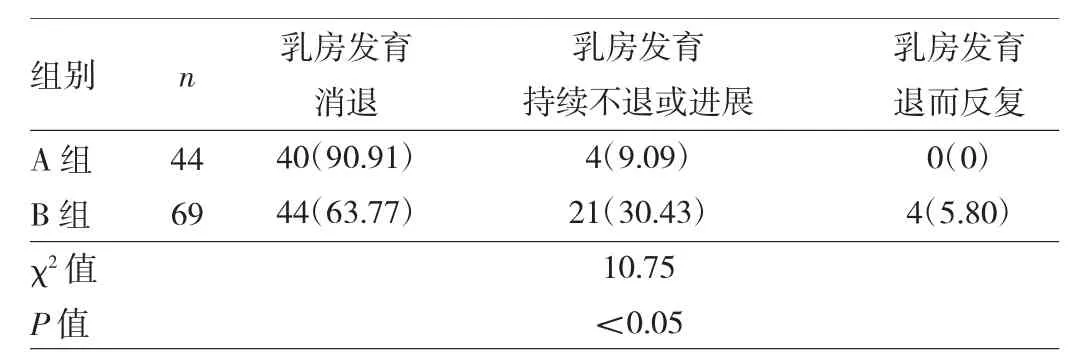
表2 两组患儿乳房发育情况的随访结果[例(%)]
2.3 CPP与非CPP患儿临床资料的比较 见表3。
由表3可见,CPP患儿发病年龄、初诊时W-SDS、BMI、ULD值均高于非CPP患儿,差异均有统计学意义(均P<0.05)。多因素logistic回归分析发现发病年龄、初诊时ULD是乳房早发育女童进展为CPP的危险因素(P<0.05或 0.01),见表 4。
3 讨论
乳房早发育是青春期最常见的疾病,目前国内针对乳房早发育的随访研究主要集中在0~2岁儿童,本研究扩大至0~8岁。本研究128例乳房早发育女童中有72例(56.25%)在2岁以后出现症状,与2岁前发病的患儿相比,2岁后发病的患儿症状持续时间较短。de Vries等[8]发现2岁以后出现症状的患儿较2岁以前出现症状的患儿更早接受医疗服务,这与本研究结果一致。表明,在父母看来,2岁前乳房发育被认为更具生理性,导致他们推迟就医。本研究发现与2岁后发病的患儿相比,<2岁发病的患儿FSH基础值更高,可能与这一时期的FSH生理性升高有关[9],出生后的新生儿血循环中有高浓度雌激素,随着雌激素被清除,HPG轴激活,其分泌的激素可达到青春期水平,2岁后则以HPG轴抑制为主。本研究发现,2岁后出现症状的女童H-SDS、W-SDS、BA/CA比值高于2岁前出现症状的女童,,Ci,cek等[10]研究发现除了上述指标,BMI-SDS也存在统计学差异。
乳房发育大部分是生理性的,呈自限病程,但依然不能忽视乳房发育作为性早熟的一个重要体征的意义。过去认为婴幼儿乳房早发育随年龄增长会逐渐消退,或持续不退而不影响青春期发育,近期国内对0~2岁儿童的研究发现,乳房早发育的自然消退率从89.3%~96.77%不等[11-12]。本研究发现2岁内发病的乳房消退率达90.91%,明显高于 2岁后发病的乳房消退率,与de Vries等[8]的研究一致。本研究还发现113例患儿有18例(15.93%)进展为CPP,其中B组17例,明显高于A组。Volta等[13]研究发现8岁前出现CPP的比例为18.4%,,Ci,cek等[10]研究发现性早熟的转化率较高,达29.7%,可能与随访时间较长有关。
单纯性乳房早发育无需特殊治疗,而CPP可以使用GnRH类似物有效治疗从而改善成人身高和推迟早初潮,尽早区分单纯乳房早发育和早期CPP,对治疗和预后来说都是至关重要的[14],但因大部分CPP最初也表现为孤立的乳房早发育,故仅根据临床症状很难区分它们,目前尚无临床征象或实验室检查可以帮助预测哪些患儿有发生性早熟的风险[15]。,Ci,cek等[10]发现进展为性早熟的患儿初诊时的W-SDS、BMI明显高于非性早熟组,与本研究一致,但他们尚未进一步行多因素logistic回归分析。本研究进一步行多因素logistic回归分析发现W-SDS、BMI并非乳房早发育女童进展为CPP的独立危险因素,而发病年龄是乳房早发育女童进展为CPP的危险因素,提示乳房发育的发病年龄越大,进展为CPP的可能性越大。Bizzarri等[16]指出年龄越大(主要是2岁以后)与性早熟的转化呈正相关,而de Vries等[8]研究发现年龄影响乳房早发育的临床转归,但不是转化为CPP的危险因素。除了发病年龄,本研究还发现初诊时ULD也是性早熟转化的危险因素。Yu等[17]对248例7~8岁乳房早发育的女童行B超检查发现CPP组ULD、横径、体积、基底部及横截面积明显大于单纯性乳房早发育组,而卵巢容积在两组间无统计学差异,与本研究一致。考虑可能与雌激素暴露相关,本研究结果显示CPP患儿初诊时血基础E2第75%分位值虽然高于非CPP患儿,但差异无统计学意义,可能与以下因素有关:(1)E2本身的波动,(2)由于条件有限,本研究所能检测到的最低E2水平为20pg/ml。
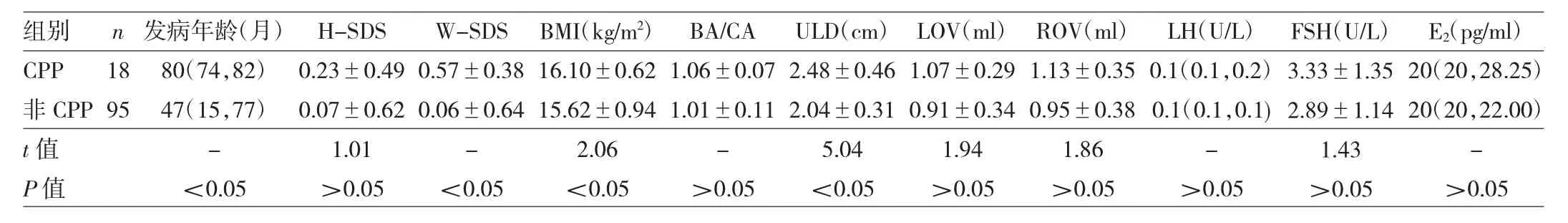
表3 CPP与非CPP患儿临床资料的比较

表4 乳房早发育患儿进展为CPP的危险因素logistic回归分析
尽管尚不清楚乳房早发育确切的病理生理机制,但许多文献提示其在大多数情况下是良性的临床过程,少部分可能转化为CPP。本研究发现2岁以后发病者CPP转化的风险性较2岁前发病者要高,发病年龄和初诊时的ULD是转化为CPP的危险因素,对于有危险因素的患儿应加强临床随访,密切监测病情进展,及时明确诊断并给予相应治疗。
