建立基于临床数据的儿童阻塞性睡眠呼吸暂停综合征预测模型
2020-06-23张静何珊陈洁殷勇
张静,何珊,陈洁,殷勇
(上海交通大学医学院附属上海儿童医学中心 a.呼吸科,b.耳鼻喉科,上海200127)
阻塞性睡眠呼吸暂停综合征(obstructive sleep apnea syndrome,OSAS)是指以夜间打鼾、憋气,甚至呼吸暂停为主要临床特征的疾病。研究显示,儿童夜间习惯性打鼾的发生率为7.45%,OSAS的发病率为1%~4%[1]。中国男童和女童OSAS的发病率分别为5.8%和3.8%[2]。儿童OSAS诊断的“金标准”是整夜的、有人值守的睡眠中心内多导睡眠监测(polysomnography,PSG)。监测过程需要专业人员值守以及专业的场地和设备,监测数据需要具备专业资质的人员进行分析和报告[3]。目前国内能够按照上述要求开展睡眠监测的医院非常有限,无法满足大量临床病例的监测需求。因此,临床医师,尤其是基层儿科医师迫切需要找到一种能够有效利用、易于获取的临床资料,并兼具灵敏性、特异性以及无偏倚的诊断方法,用于前瞻性筛查有临床鼾症的儿童,并提供适当的诊疗意见。
学者们已经在这方面进行了探索并取得一定的研究成果,包括使用经过信效度验证的筛查问卷[4-5]、使用无人值守的便携式睡眠监测[6]等,但对于基层儿科医师,这些筛查方式并不足够可靠或完全适用。基层儿科医师需要的是利用临床基本症状、体征以及简单的客观检查信息通过组合计算获取相应分值进行准确预测的临床决策。本研究希望利用简单易得的临床数据建立可以在大部分临床环境中应用的儿童OSAS预测模型,以期提高基层儿科医师的临床决策能力。
1 资料与方法
1.1一般资料 回顾性分析2018年1—12月在上海交通大学医学院附属上海儿童医学中心睡眠门诊和耳鼻喉科门诊就诊的、以夜间打鼾或呼吸暂停为主诉的136例患儿的临床资料,其中男81例,女55例。根据PSG监测结果中阻塞性呼吸暂停低通气指数(obstructive apnea-hypopnea index,OAHI)将患儿分为对照组(OAHI<2次/h)和OSAS组(OAHI≥2次/h),其中对照组94例,OSAS组42例。本研究经医院医学伦理委员会批准(批准号:SCMCIRB-K2016043)。
1.2纳入与排除标准 纳入标准:①体重正常,体质指数(body mass index,BMI)Z评分[7]为-2~2);②完成PSG监测和鼻咽部侧位片检查;③年龄1~12岁;④研究开始前家长签署书面知情同意书。排除标准:①颅面部畸形;②慢性基础疾病(心脏疾病、早产儿慢性肺部病变、脑瘫、神经肌肉疾病、糖尿病、糖原累积病等遗传代谢性疾病、21-三体综合征等染色体病);③精神疾病;④既往接受过腺样体、扁桃体手术;⑤扁桃体体积明显不对称;⑥伴有其他睡眠障碍的疾病。
1.3观察指标
1.3.1一般情况 性别和年龄取自门诊病历信息。
1.3.2BMI Z评分 行PSG监测前,使用标准方法完成体重和身高的测量;体重测量精确至0.1 kg,身高测量精确至0.1 cm;BMI Z评分使用美国宾夕法尼亚儿童医院在线评分软件计算(http://stokes.chop.edu/web.zscore)。
1.3.3体格检查 由两位具备临床经验的五官科医师独立完成。腭扁桃体分为4度:1度,扁桃体不超过腭咽弓;2度,扁桃体超出腭咽弓但小于腭咽弓至悬雍垂连线的50%;3度,扁桃体超出腭咽弓并且大于腭咽弓至悬雍垂连线的50%;4度,扁桃体超过悬雍垂或双侧扁桃体互相接触[8]。
由睡眠专科医师在PSG监测前完成颈围测量和Mallampti分级。颈围测量方法:患者清醒,取站立位,平静呼吸,两眼平视前方,使用软尺紧贴环甲膜上水平测量周径,精确至0.1 cm。Mallampti分级是指患者端坐,用力张口伸舌,根据咽部显露程度分成4级。Ⅰ级,可见软腭、咽腭弓和悬雍垂;Ⅱ级可见软腭、咽腭弓,悬雍垂被舌根部分遮盖;Ⅲ级,仅见软腭;Ⅳ级,未见软腭[9]。
1.3.4睡眠问卷 儿童睡眠问卷(pediatric sleep questionnaire,PSQ)是美国儿科协会在OSA诊疗指南中唯一推荐的筛查问卷,其中文版问卷已经过信度和效度检验,被认为是可以在中文地区使用的有效的儿童睡眠筛查问卷[10]。PSQ问卷共包含22个问题,包含常见的OSAS症状如鼾声、可见的呼吸暂停、睡眠期呼吸困难、日间嗜睡、多动及注意力不集中等表现。PSQ问卷中有8个以上的条目回答为“是”的,表明PSQ筛查结果为阳性,提示可能存在OSAS[5]。
1.3.5PSG监测方法和相关参数 PSG监测仪为澳大利亚Compumedics公司生产(型号:Grael)。监测前2周内患儿无呼吸道感染。检测前24 h禁用安眠药,禁止饮酒和兴奋性饮料。睡眠监测室内环境温度维持在24 ℃,连接脑电图、眼动图、肌电图、口鼻气流、胸腹呼吸运动、心电图、经皮脉搏血氧饱和度(percutaneous oxygen saturation of pulse,SpO2)、鼾声以及实时数字视频等,在1名家属陪护下,受试者完成导联连接后,在21:00~21:30关灯自然入睡,次日7:00唤醒或自然觉醒。采用美国睡眠学会2017年制订的操作指南[11]对睡眠结构及相关呼吸事件进行定义和分析。
PSG监测相关参数:①阻塞性睡眠呼吸暂停,睡眠过程中口鼻气流停止而胸腹运动持续存在,持续至少2个呼吸周期;②低通气,睡眠中呼吸气流下降>50%,伴有SpO2下降>0.04和(或)觉醒;③OAHI,总睡眠时间中平均每小时阻塞性呼吸暂停和低通气次数;④夜间最低SpO2。
1.3.6鼻咽部侧位片 鼻咽部摄片是使用低剂量X线(0.2 mSv)进行侧位摄片。从获取的影像中观察椎体、口腔以及鼻咽部的气道、鼻咽部、会厌、部分气管、腺样体以及扁桃体的结构。腺样体的大小可用腺样体-鼻咽部比值(adenoidal-nasopharyngeal ratio,A/N)表示。
1.4OSAS诊断标准 OAHI≥2次/h即可诊断为OSAS[12]。

2 结 果
2.1两组研究对象一般情况的比较 OSAS组患儿夜间最低SpO2低于对照组,扁桃体1~2度和PSQ<8项答案“是”的比例低于对照组(P<0.05);两组患儿的性别、年龄、BMI Z评分、颈围、Mallampti不同分级例数以及A/N比值比较差异无统计学意义(P>0.05)。见表1。
2.2二元Logistic回归建立儿童OSAS预测模型 将表1中的所有变量采用后向逐步选择法进行二元Logistic回归分析。其中A/N、Mallampti分级、性别和扁桃体体积在统计分析过程中被移出方程。最终有5项变量包括夜间最低SpO2、BMI Z评分、PSQ、年龄以及颈围进入儿童OSA预测模型,见表2。建立的Logistic回归方程为:X=31.66-0.324×(夜间最低SpO2-连续性变量)+0.641×(BMI Z评分-连续性变量)+1.212×(PSQ ≥8项的答案为“是”-两分类变量)+0.415×(年龄-连续变量)。以OAHI≥2次/h为儿童OSAS的诊断标准,ROC曲线下面积为0.82(95%CI0.73~0.90),提示本模型具有良好的临床筛查能力,见图1。模型预测的灵敏度为80.9%,特异度为76.2%。儿童OSAS的发生率定义为EXP(X)/[1+EXP(X)]×100%。
3 讨 论
儿童OSAS的慢性病理生理过程包括间歇性缺氧、二氧化碳潴留或睡眠片段化,最终导致儿童白天注意缺陷、多动、血管内皮功能损害、代谢综合征、情绪障碍、颅颌面发育异常、认知功能受损等多系统功能损害[13-17]。由于OSAS具有慢性、持续性、多系统损害的特点而日益受到家长和儿科医师的重视。
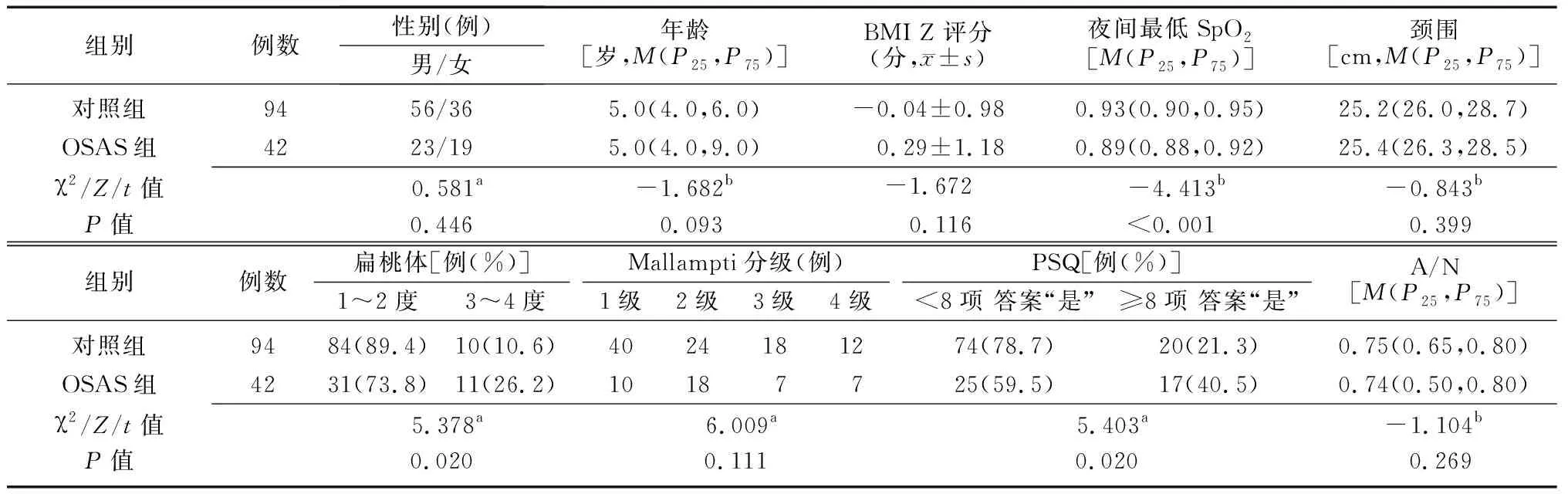
表1 两组研究对象一般资料的比较
BMI:体质指数;SpO2:脉搏血氧饱和度;PSQ:儿童睡眠问卷;A/N:腺样体/鼻咽部比值;a为χ2值,b为Z值,余为t值
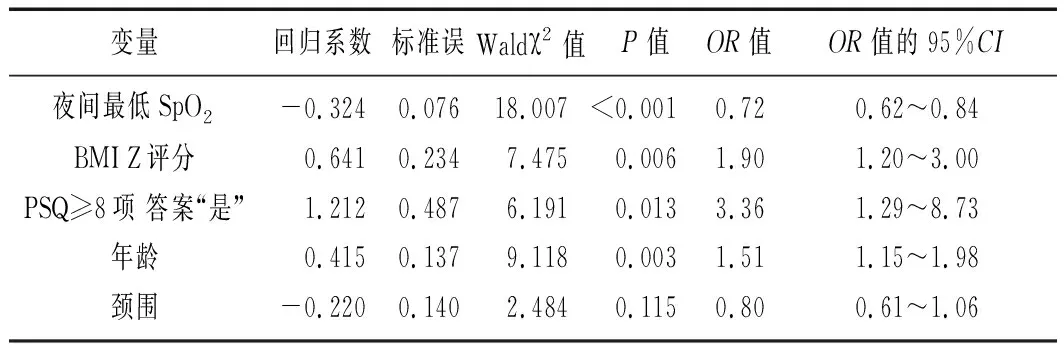
表2 二元Logistic回归模型预测儿童OSAS
OSAS:阻塞性睡眠呼吸暂停综合征;SpO2:脉搏血氧饱和度;BMI:体质指数;PSQ:儿童睡眠问卷
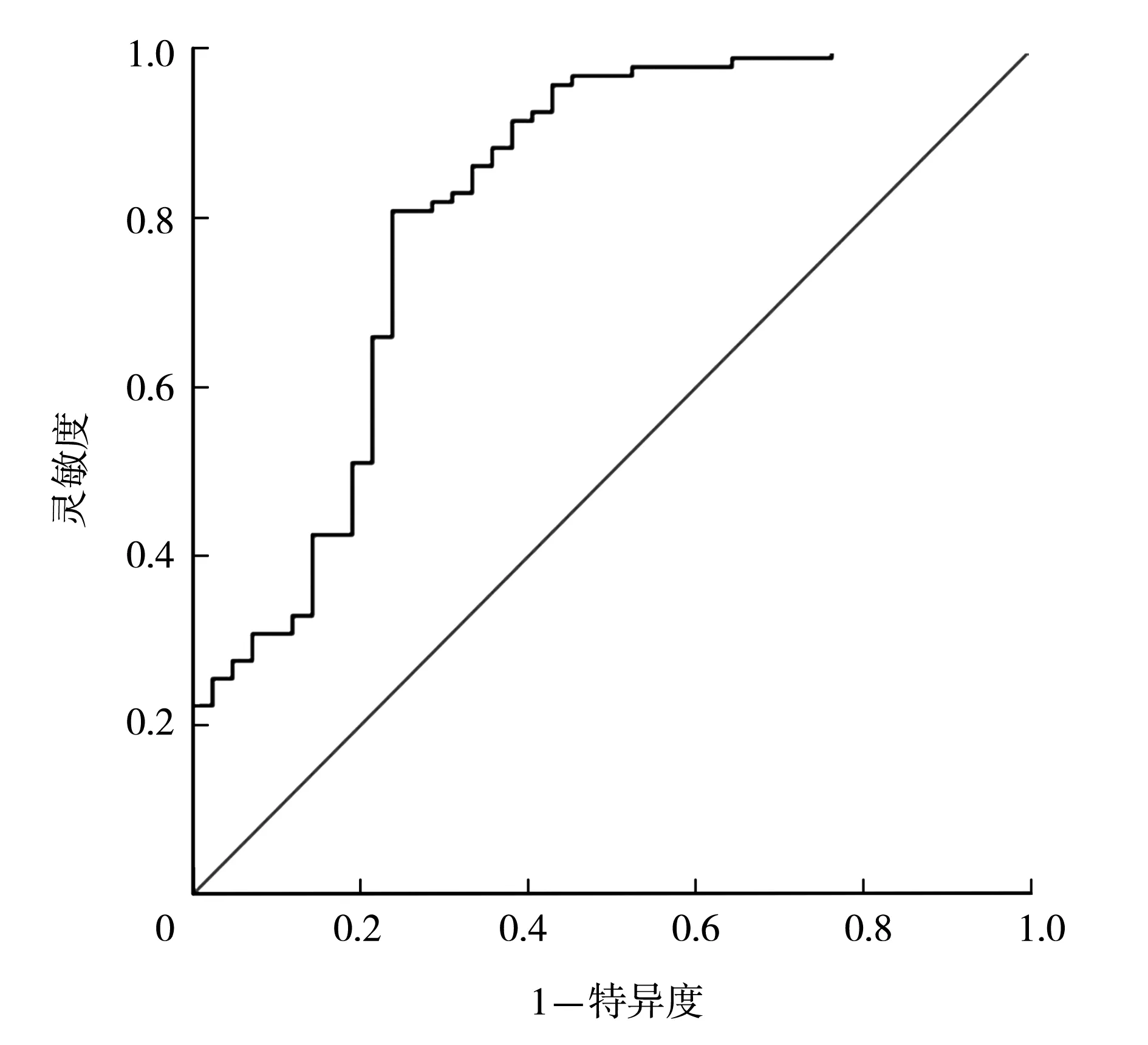
OSAS:阻塞性睡眠呼吸暂停综合征;ROC:受试者工作特征曲线
图1 儿童OSAS预测模型的ROC曲线
绝大部分儿童OSAS是由腺样体或扁桃体肥大导致气道阻塞造成的,因此腺样体扁桃体切除术是治疗儿童OSAS的一线方案[18]。在临床工作中积极识别OSAS,并给予适时的治疗是逆转各系统损害的关键[19]。
传统诊断儿童OSAS的方法包括询问临床症状、完善体格检查、鼻咽部侧位X线检查以及PSG监测。在这些诊断方法中,单独的临床症状、体格检查或鼻咽部摄片对于OSAS的诊断存在极大的局限性。睡眠中心内PSG监测虽然是诊断儿童OSAS的“金标准”,但由于需要专业的场地设备,且检查费用昂贵,专职人员夜间值守和监测效率低下,导致在中国很多地区包括发达地区的基层医院都无法实现。帮助基层儿科医师利用简便易得的临床资料判断分析儿童OSAS的发生率,为家长提供有效的诊治意见是本项研究的目的。
近年来研究者们尝试采用睡眠中心内PSG监测以外的,更为便捷的方法预测儿童OSAS或相关并发症。Lai等[20]通过收集OSAS儿童的临床数据包括BMI Z评分、扁桃体体积、舌体位置、鼾声视觉量表、鼻腔阻塞以及张口呼吸情况建立预测模型,即儿童呼吸暂停低通气指数(apnea-hypopnea index,AHI)=0.108+0.103×鼾声视觉量表+0.894×鼻腔阻塞+0.207×BMI Z评分。预测AHI≥5或AHI≥10的灵敏度分别为75.6%和84.6%,特异度分别为61.7%和56.5%。该项研究侧重于筛查中重度OSAS,但灵敏度和特异度并不理想,可能与纳入变量中缺乏夜间监测的客观数据有关。Certal等[21]通过收集临床怀疑OSAS儿童的年龄、体重、身高、BMI、PSQ评分、扁桃体体积以及氧减指数进行回归分析并建立模型。模型公式定义为:X=-3.383+0.295×(氧减指数)+1.633×(PSQ问卷中8条以上答案为“是”)+1.909×(扁桃体3度或4度增大)。预测儿童OSAS(AHI≥1)的灵敏度和特异度分别为88%和86%。但该研究未使用OSAS金标准进行模型构建,可能会造成研究结果的偏倚。目前国内基层儿科不具备分析夜间氧减指数的设备和能力,因此该模型的应用也受到限制。Crespo等[22]通过监测整夜的SpO2并自动分析计算得到的夜间平均每小时出现SpO2下降≥3%的次数,对具有OSAS高危因素的儿童进行有效筛查,今后可能成为替代PSG的更简单的筛查方法。但该项技术仍然存在SpO2数据采样参数和自动分析参数设置方面的局限,仍需要进一步验证后才能真正用于临床。另有研究者尝试通过检测晨尿中某些蛋白质或小分子物质对儿童OSAS进行临床筛查,目前仍处于研究阶段[23]。所有上述研究均未进行多中心或项目以外的进一步评估和验证。
与既往研究相比,本项研究利用基层儿科医疗机构易于获得的临床信息和夜间最低SpO2数据构建OSAS筛查模型,同时在模型构建过程中应用OSAS诊断的“金标准”PSG进行OSAS的诊断,该模型便于在基层应用,在筛查结果方面也具有科学性。将本项研究统计获得的计算公式置入电脑或制作成电子化计算表格植入智能手机的APP端,也便于基层医师的临床使用和传播。本模型ROC曲线下面积为0.82时,预测的灵敏度为80.9%,特异度为76.2%,均优于上述同类筛查模型[20]。根据筛查模型计算获得的OSAS发生率可将临床病例分为3类。1类是风险概率评分<10%,可以提供给家长的诊疗意见是“根据临床症状、体格检查以及夜间最低SpO2检查结果,基本可以排除OSAS诊断”;2类是风险概率为10%~50%,可以告知患儿家长“他可能存在OSAS,但根据目前的临床信息还不足以确诊,需要进一步至儿童睡眠中心完善PSG监测并定期随访”;3类风险概率评分>50%,需要提醒患儿家长“患儿很有可能患有OSAS,需要至耳鼻喉科或睡眠专科门诊接受进一步的治疗(可能是扁桃体腺样体切除术或药物抗炎治疗)”。根据筛查模型计算儿童OSAS的发生率,给予相应的临床诊疗指导,帮助基层儿科医师进行有效的OSAS筛查。
本研究也存在着局限性:①研究数据来自单中心的病例样本,在下一步的研究中将联合其他儿童睡眠中心进行多中心的研究和验证。②本研究对象的年龄跨度较大,后续研究将增加病例数,并针对不同年龄段进行研究以优化和改进现有模型。③夜间SpO2监测在部分基层医院尚不能开展,但目前有成品化且价格适中的腕表式设备可用,但不同腕表设备间可能会存在差异,需要在临床应用前进行设备参数的严格选择。
综上所述,基层儿科医师可通过采集患者的年龄、颈围、BMI Z评分、PSQ问卷和夜间最低SpO2,结合本研究获得的儿童OSAS临床预测模型,对有夜间鼾症的儿童进行筛查,以提高基层儿科医师对儿童OSAS的筛查能力。
