有机肥及复配硫酸盐对土壤-水稻系统砷镉有效性的调控*
2020-06-23林朝君谭长银章新平
严 露,林朝君,王 欣,彭 渤,谭长银,章新平
(湖南师范大学资源与环境科学学院,湖南师范大学环境重金属污染机理及生态修复重点实验室,长沙 410081)
作为国际癌症研究署列出的第Ⅰ类明确致癌物,砷(As)和镉(Cd)污染在土壤与灌溉水中的广泛发生已导致其在食物链中富集,正在不同程度上危害着全球人类健康[1-2]。水稻作为我国三大粮食作物之一,由于独特的水分管理模式、土壤 pH 条件以及固有遗传特性,其对Cd 和As 的吸收转运效率远大于其他农作物[3-4]。特别在我国水稻主产区之一的湖南省,作为国家有色金属采选、冶炼布局最为密集的重要省份,正面临着最为突出的稻米Cd、As 污染[5-6]。例如,雷鸣等[7]研究表明湖南矿区和冶炼区稻谷精米中 As、Cd 含量均高于食品安全国家标准-食品中污染物限量[8]。因此,阻控水稻对 Cd和 As 的吸收及其向籽粒的转运是实现我国农业安全生产的重中之重。
研究发现,作为改良土壤肥力的重要策略,水溶性有机肥具有全水溶、高活性、全吸收、见效快等优点[9],且有机肥向土壤中施用可通过其丰富的酸性官能团的络合作用提高土壤对 Cd 的吸附持留能力,降低 Cd 的植物有效性,阻碍其通过根系吸收进入食物链[10]。同时,施用有机肥可提高土壤水溶性有机碳(DOC)含量,有利于促进 As 的甲基化过程[11],降低土壤高毒性无机 As 含量。另一方面,考虑到As/Cd 均为亲硫(S)元素,在施用有机肥使土壤DOC(作为微生物代谢底物)含量升高时,土壤氧化还原电位(Eh)下降,有利于硫酸盐向硫化物的还原转化,可进一步促使部分As/Cd 形成硫化物沉淀或与硫化亚铁形成共沉淀[12-13]。我国是亚洲最缺硫(S)的国家之一,特别是长江以南地区因高温多雨,土壤有机质含量低,S 易淋失[14]。那么在此背景下,施用有机肥及其与硫酸盐肥料协同施用可否对土壤-水稻体系中Cd/As 两种重金属的生物有效性与环境迁移性产生减控效应?
为解决该科学问题,本文研究了单独施用有机肥及其复配硫酸盐对水稻土中As、Cd 的溶出特性和形态转化的影响;此外,为进一步探讨两种肥料对水稻As、Cd 的减控作用,分别在幼苗和成熟阶段测定了水稻不同部位As、Cd 的积累浓度以及As 化学形态,为利用以有机肥和硫酸盐为基础的农艺策略控制水稻 As/Cd 污染提供重要的基础参考。
1 材料与方法
1.1 试验材料
为达到探究有机肥、硫酸盐对复合重金属污染调控作用的目的,将湖南省常德市石门县砷污染的水稻表层土(0~20 cm)及湖南省湘潭市镉污染的水稻表层土取回风干后,用研钵研磨并过10 目筛后按 1︰1.2 混合,混合之前的水稻土 As 浓度为110±4 mg·kg-1,Cd 浓度为 2.1±0.1 mg·kg-1,得到实验土壤全 As 为 52.51±1.87 mg·kg-1, 全 Cd 为1.06±0.06 mg·kg-1,分别代表了湖南稻田土壤中典型的 As、Cd 污染浓度值,As/Cd 污染均超过农用地土壤污染风险筛选值(GB15168-2018[15],As ≤30 mg·kg-1,Cd≤0.4 mg·kg-1)。硫酸钠为分析纯;有机肥购于安琪酵母股份有限公司,是以酵母浓缩液为主要原料的水溶有机肥;盆栽桶为无盖圆柱形桶,直径280 mm(内径),高240 mm;水稻品种选用湖南地区常见的陵两优211(杂交稻)。供试土壤及有机肥的基本理化性质见表1。
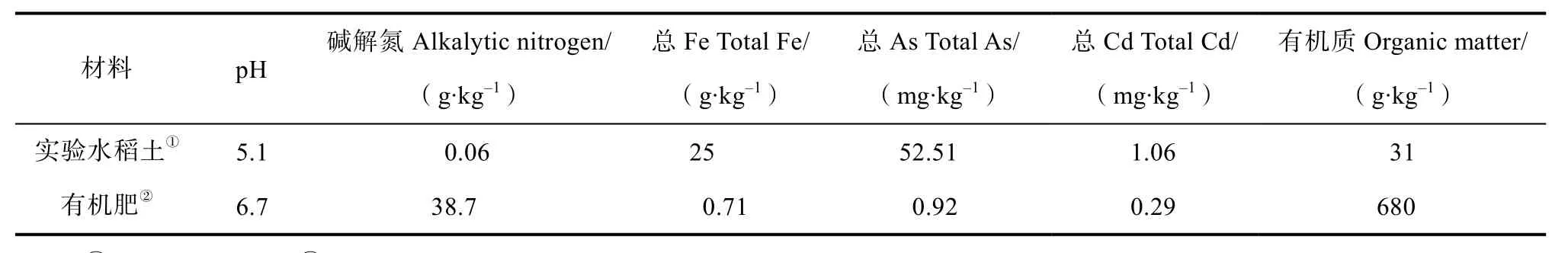
表1 供试土壤及有机肥的基本理化性质Table 1 Basic physical and chemical properties of the tested soil and water-soluble organic manure
1.2 水稻育苗及盆栽试验设计
根据杜艳艳等[16]的水稻育种方式,对水稻种子进行选种及育苗。将3 500 g 等份的实验土壤置于盆栽桶中并分别进行三个处理:(1)加入3 000 mL 去离子水(CK);(2)加入17.5 g 有机肥和3 000 mL去离子水(OF);(3)加入 17.5 g 有机肥,4.08 g硫酸钠和3 000 mL 去离子水(SOF)。其中,有机肥的施用量是根据产品说明建议的合理用量而选择;硫酸盐用量是根据Burton 等[12]的研究结果进行选择,其研究表明在厌氧条件下硫酸盐还原菌使Fe2+生成 FeS,并可以螯合大量 As 从而降低 As 的有效性。每种处理设置3 盆平行样并标记水位。稳定2 d 后,将土壤孔隙水取样器(MOM-19.21.21F,Rhizon,荷兰;长10 cm,直径2.5 mm)插入土壤的中心,定期抽取土壤孔隙水。淹水一周后在每个盆中均匀种植预发芽的水稻种子,将种植水稻的盆置于玻璃房中,水稻培育共持续106 d 至籽粒完全成熟。在整个培养期间每天添加去离子水将淹水水位保持在标记处。
1.3 淹水土壤pH 与Eh 及孔隙水指标测量
水稻幼苗期和分蘖期每周利用氧化还原电位去极化法自动测定仪(FJA-6,南京传滴仪器设备有限公司)测定一次土壤pH 和Eh 并抽取孔隙水;抽穗扬花期和成熟期内每两周测定一次土壤pH 和Eh 并抽取孔隙水;再分别利用原子荧光光度计(AFS,LCAFS6500,北京海光仪器有限公司)和原子吸收分光光度计(AAS,AAnalyst900T,Perkin Elmer)分别测定当天所得新鲜孔隙水样中的 As(Ⅲ)、As(Ⅴ)、总Fe、总Cd 浓度;利用紫外-可见分光光度计(VOLUTION 260 BIO,Thermo Fisher Scientific,美国)和离子色谱仪(ICS5000,Thermo Fisher Scientific,美国)分别测定当天所得新鲜孔隙水样的 Fe(Ⅱ)、Fe(Ⅲ)和浓度,并根据对氨基二甲基苯胺光度法采用紫外-可见分光光度计测定孔隙水浓度;此外,利用总有机碳(TOC)分析仪(TOC-4200,Shimadzu,日本)测定孔隙水DOC含量。
1.4 淹水土壤孔隙水结合态As 测量
使用1 000 MWCO(截留分子量)再生纤维素酯膜透析袋(MD34,美国)将无机游离态As 与有机结合态As 分离,透析袋在使用前24 h 用去离子水洗涤以除去任何可浸出的有机碳(OC),然后置于5 mmol·L-1的 NaCl 中;将每个处理淹水一周后抽取的10 mL 等份的孔隙水置于透析袋中,并用透析夹封闭袋的末端;每24 小时从透析袋外取样,采用AFS 进行 As 量化并用新鲜的 5 mmol·L-1的 NaCl 溶液替换外部溶液,直至外部溶液 As 浓度低于检出限;最后,采用AFS 分析来自透析袋内部样品DOC结合的As 浓度[17]。
1.5 水稻植株As、Cd 提取与测定
采集各处理水稻幼苗(培育30 d),分为根部和地上部,将地上部分洗净后于滤纸上吸干并在液氮中冻干后,在液氮中研磨,再将研磨样品(0.2~0.5 g)用20 mL PBS(磷酸盐缓冲液,2 mmol·L-1NaH2PO4和 0.2 mmol·L-1Na2-EDTA)在超声处理下提取1 h,用0.45 μm 滤膜过滤,然后用AFS 分析As 形态[18]。此外,将剩余的新鲜水稻幼苗在105 ℃下杀青30 min 并于60 ℃下烘干72 h 至恒重,之后对其研磨,并参考美国环保部的标准方法(US EPA3051a)[19]对研磨样品利用微波消解仪(CEM MARS6,Matthews,美国)进行消解,并分别利用AFS 和 AAS 测定 As、Cd 含量。
待收获后,将水稻植株分为根部、地上部秸秆与稻谷,依次采用自来水和去离子水洗净。将秸秆与稻谷于 105 ℃下杀青 30 min 并于 60 ℃下烘干72 h 至恒重,对稻谷样品进行脱壳,之后分别对秸秆、稻壳和糙米样品进行研磨,参考本节测定水稻幼苗总As、总Cd 含量方法测定其总As、总Cd 含量;另将糙米经过精米机(LTJM-2099,上海蒸哲精密仪器有限公司)获得白米样品并研磨,并按照上述操作测定白米总As 含量,再根据Zhu 等[5]提出的方法分析白米As 形态。
利用连二亚硫酸钠-柠檬酸钠-碳酸氢钠(DCB)法提取新鲜成熟根系的表面铁膜[20],分别利用 AFS 和AAS 测定提取液中As、Cd、Fe 含量;将提取根表铁膜后的白根于60 ℃下烘干72 h 至恒重,经微波消解后测定 As、Cd 含量;另将提取根表铁膜后的白根以及幼苗期新鲜根系参考本节幼苗期地上部分As 形态测定方法进行As 形态检测。
1.6 土壤As、Cd 、S2-提取与测定
为分析有机肥及硫酸盐对土壤 As、Cd 赋存形态的影响,在成熟期收获水稻后,小心收集与根系紧密黏连的根际土,自然风干后研磨过100 目筛。根据 Wenzel 等[21]所建立的土壤 As 赋存形态分级提取法和 Tessier 等[22]所建立的土壤 Cd 赋存形态分级提取法,对根际土As、Cd 形态进行提取分析。根据杨丽洲和陶大钧[23]提出的硫化砷提取方法对根际土进行硫化砷提取分析。为进一步探明两种肥料对土壤S2-形成量的影响,根据冷扩散法[24]提取土壤S2-,并利用对氨基二甲基苯胺光度法测定其浓度。
1.7 数据分析与质量保证
各处理均设置3 个平行样,p H 和Eh 测定前进行校准液的测定,偏差不超过合理范围(pH±0.05,ORP(氧化还原电位)电极浸泡液256±15 mV)时开始测定样品,且在样品分析测试过程中,标准曲线拟合优度R2≥0.999;每 10 个样品的测定中安插一个校准标准液。此外,关于本工作中使用的AFS和 AAS,AFS 检测限为 0.01 μg·L-1,火焰 AAS(FAAS)检测限为 0.001 5 mg·L-1,用 AAS 测定镉的相对标准偏差(RSD)为1%,加标回收率为90%~100%;AFS 测定砷的相对标准偏差为 0.8%,回收率为90%~110%。
利用 Excel 2010 对数据进行整理,利用Origin 2018 进行数据处理制图,采用SPSS 22.0 对相关数据进行差异显著性分析,显著性分析采用方差分析(ANOVA),组间比较采用邓肯检验(Duncan’s test)进行分析处理,P<0.05 为差异有统计学意义。
2 结 果
2.1 有机肥及其复配硫酸盐对水稻根际化学特性及As、Cd 溶出特性的影响
在为期 16 周的淹水培育进程中,各处理土壤氧化还原电位(Eh)和pH 的动态变化如图1a)和图1b)所示,随着淹水培育时间的延长,各处理土壤 pH均逐步上升,与之相对应的土壤Eh 随着淹水呈现下降趋势。此外,土壤 pH 的上升同时伴随着土壤孔隙水As、Fe 浓度的逐步升高(图1d)~图1f)、图2a)~图 2b)),指示 pH 的升高不利于 Fe-As 共沉淀的形成。OF 处理土壤Eh 大多在CK 之下,说明有机物加剧了土壤的还原强度,而向有机肥处理中加入硫酸盐能提高Eh,这说明硫酸盐可作为电子受体影响土壤的还原强度,此外,土壤Eh 的下降伴随着孔隙水中As(Ⅲ)的上升、Cd 的下降(图1b)、图 2a)、图 2c)),这说明还原条件有利于提高 As的水溶性而降低Cd 的溶出。
有机肥为土壤添加了大量的外源DOC,但在第10 周后孔隙水 DOC 逐渐下降至与 CK 接近的水平(图 1c)),这是因为有机肥为微生物群落提供大量有机质后能促进微生物快速繁殖,从而消耗更多的DOC。所有处理组土壤孔隙水As 均以无机As(Ⅲ)为主,且 CK 的 As(Ⅲ)浓度大部分时间均高于OF(图 2a)),无机 As(Ⅴ)在长期淹水环境下始终保持较低浓度,甚至更多的时候低于检出限,整个淹水期间仅有 3 个取样时间点测出了 As(Ⅴ)。进一步通过渗析法可知,OF 透析率(1.5%)低于CK(3.3%)(表2),说明OF 促进无机As(Ⅲ)转化为络合态As,稳定存在于孔隙水中。
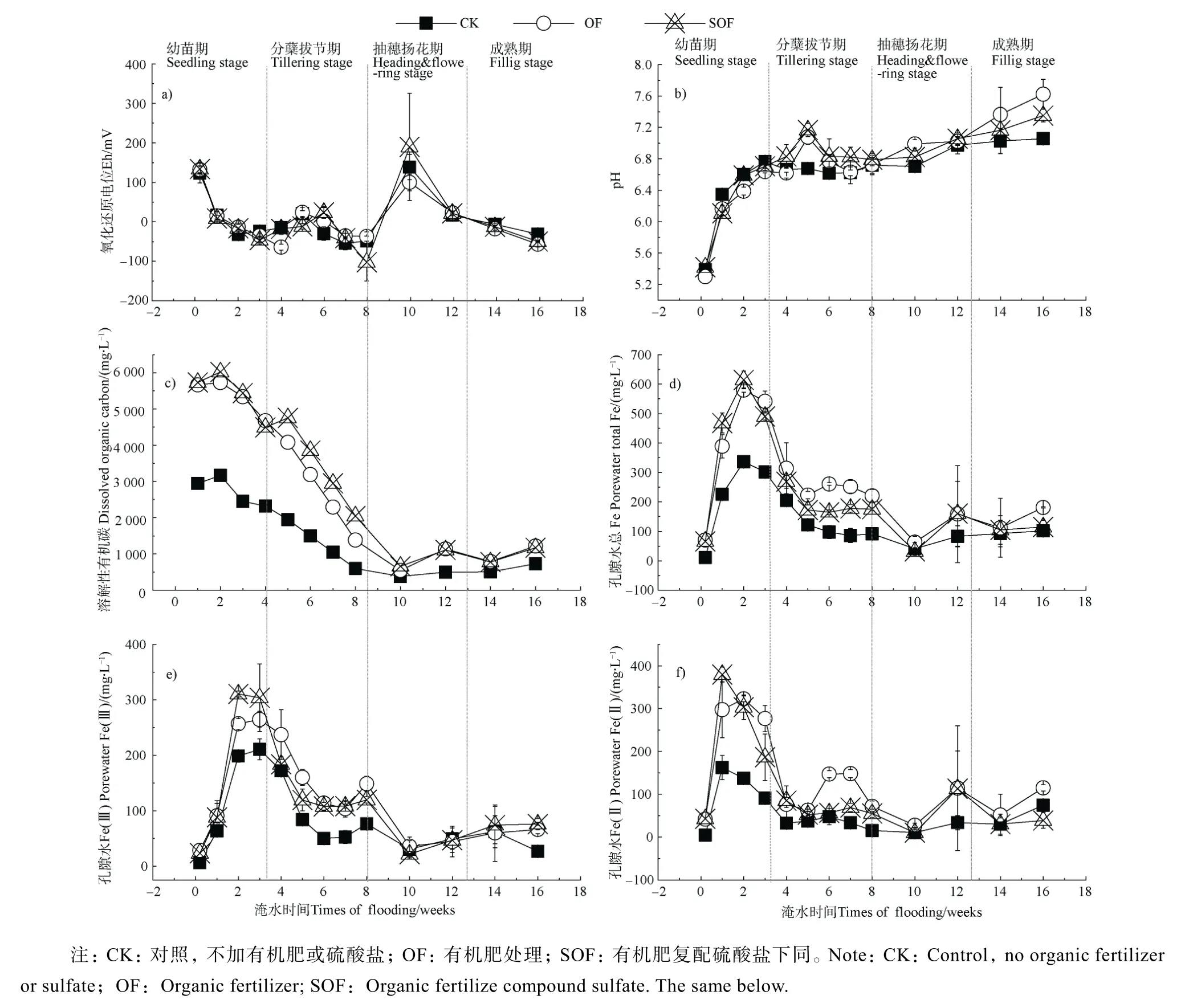
图1 淹水期间土壤氧化还原电位(a))、pH(b))和孔隙水溶解性有机碳(c))、Fe(d)-f))变化Fig. 1 Changes in soil Eh(a)),pH(b)),and DOC(c)) and Fe(d)-f)) in porewater in flooded soil
2.2 有机肥及复配硫酸盐对土壤固相中 As、Cd化学结合态的影响

图2 淹水期间土壤孔隙水As(a)-b))、Cd(c))、(f))的浓度变化Fig. 2 Changes in concentration of As(a)-b)),Cd(c)), (d)),S2-(e)) and soil in soil porewater in flooded soil

表2 淹水一周孔隙水透析前后As 变化Table 2 Variation of soil As before and after dialysis of porewater in the soil flooded for one week
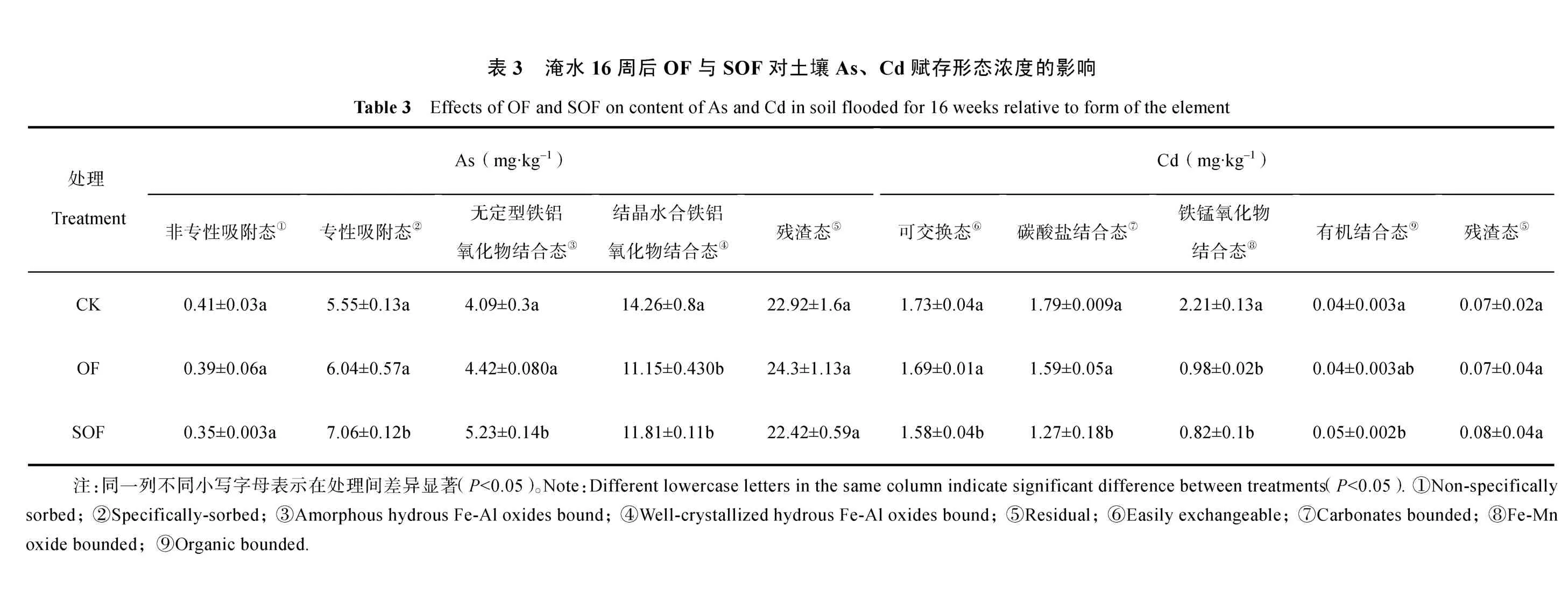
在淹水培育水稻 16 周之后,CK 土壤 As 形态主要与结晶 Fe/Al 氧化物结合态和残渣态相关,两种As 赋存形态分别占土壤总 As 的30%和49%(表 3),而OF 处理使晶体Fe/Al 氧化物结合态 As 减少了 6%,这可能是由于 DOC 作为微生物氧化代谢底物,其含量的升高促使淹水土壤中(兼性)厌氧微生物对良好结晶态铁/铝氧化物的还原转化强度增大,导致稳定结合态As 向非稳态转化,使无定形铁/铝氧化物结合态和专性吸附态 As 含量分别升高约8%和9%。当协同施用硫酸盐时,土壤晶体和无定形铁/铝氧化物结合态As 以及专性吸附态As 含量均较OF 处理有所增加(4%~5%),主要归因于可替代铁氧化物作为电子受体,耦合微生物氧化DOC,从而减少铁氧化物的还原转化及其结合态 As 的溶解还原,这与SOF处理中孔隙水Fe低于OF相一致(图1d))。但值得注意的是,SOF 处理中的加入不能完全逆转铁氧化物由稳定晶体态向其非稳定态的转化,OF 与SOF 处理中孔隙水Fe 含量依然显著高于CK(图1d)),表明有机肥是驱动土壤As 活化溶解的主导因素。类似地,由表3 可看出,在淹水16 周之后OF 处理使铁/锰氧化物结合态Cd 较CK 减少了15%,同时碳酸盐结合态Cd 也较CK 降低了11%,这一结果表明OF 处理使土壤 Cd 有向易溶态转化的趋势,而的加入未对以上过程产生明显的逆转效应(表3)。
?
2.3 有机肥及复配硫酸盐对水稻不同部位的As、Cd 累积的影响
由图3 可知,培育一个月后,水稻As 主要集中于根部,有机肥显著抑制水稻As 积累,分别使茎叶和根部As 含量降低44%和47%。从水稻As 形态看,有机肥的加入未对水稻幼苗根系和茎叶 As 形态产生显著影响,而协同施用硫酸盐条件下,水稻茎叶As(Ⅲ)含量较OF 降低19%,表明有利于促进茎叶部As(Ⅲ)向 As(V)的氧化转化。OF 处理使水稻幼苗茎叶和根部 Cd 累积量分别上升了 7倍和 6 倍,且使 Cd 从根部向茎叶的转运效率(0.224→0.185)较CK 增加了21%,而添加硫酸盐(SOF)使 Cd 在幼苗体内的累积量和向地上部分的转运效率迅速下降至与CK 相当的水平。
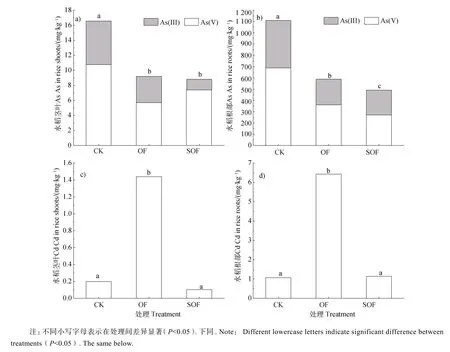
图3 水稻培育1 个月后水稻地上部分及根部As(a)~b))、Cd(c)~d))含量Fig. 3 Content of As(a)~b))and Cd(c)~d))in shoots and roots of rice after 1 month of rice cultivation
水稻成熟收获后利用 DCB 法提取水稻根表铁膜,OF 与SOF 处理分别使Fe 膜含量较CK 下降22%和36%;与此同时,OF 和SOF 处理分别使Fe 膜所持留As 较CK 升高14%和减少32%(图4)。
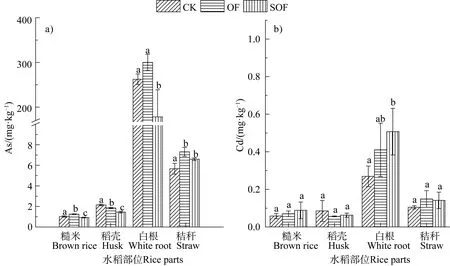
图5 水稻收获后其糙米、稻壳、白根及秸秆As(a))、Cd(b))含量Fig. 5 Contents of As(a))and Cd(b))in brown rice,rice hulls,white roots and straw after rice was harvested
与之对应的是,OF 和SOF 处理中水稻白根As含量分别增加了 14%和降低 32%,糙米 As 含量分别增加了22%和降低了10%(图5a)),这一结果提示成熟期根表 Fe 膜吸附态As 是水稻根系 As 的吸收“源”,根表Fe 膜对As 持留量的增加可促进水稻根系对As 的吸收以及向籽粒的转运与积累。与CK和OF 处理相比,协同施用硫酸盐的SOF 处理使Fe膜和白根内 As 含量明显降低,表明施用有利于减控土壤 As 生物有效性,这一方面归因于可替代铁氧化物作为DOC 氧化终端的电子受体,从而抑制铁氧化物还原溶解;另一方面,处理条件下土壤 S2-含量增加(图 2e)~图 2f)),这将有利于生成Fe/As 硫化物沉淀(图 6b))。进一步对白米As 进行化学形态分析,结果表明,OF 处理使无机 As(Asi)含量较 CK 升高 12%,均高于食品安全标准对大米Asi含量的限定(0.2 mg·kg-1,GB2762-2017);与此同时,OF 处理使白米DMA(二甲基砷酸)含量较CK 下降36%(图6a))。而SOF 处理中硫酸盐的进一步施加对 OF 处理所引发的白米As 形态转化的影响效应较弱,白米Asi含量与OF 基本持平且高于国家食品安全标准。
与 As 不同,水稻成熟期根表 Fe 膜对土壤 Cd主要起到“障碍层”,阻止土壤Cd 向水稻各部位的运输;由于OF 与SOF 处理使Fe 膜持留Cd 量下降至 CK 的 61%和 59%,导致 OF 和 SOF 白根 Cd 积累较CK 分别升高了52%和88%(图5b)),这直接进一步使OF 和SOF 糙米Cd 含量增加至CK 的1.2倍和 1.5 倍,这说明有机肥及其与硫酸盐的协同施用对稻米Cd 积累的减控作用并不显著。
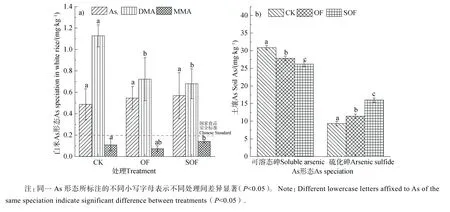
图6 水稻白米无机As(Asi)、二甲基砷酸(DMA)、一甲基砷酸(MMA)含量(a))及土壤固相硫化砷含量(b))Fig. 6 Content of inorganic As(Asi),dimethylarsinic acid(DMA),monomethylarsonic acid(MMA) in rice(a)) and arsenic sulfide in soils(b))
3 讨 论
3.1 水溶性有机肥及其复配硫酸盐对土壤液相及固相中As、Cd 的影响
本研究指示土壤 pH 升高不利于 Fe-As 共沉淀的形成,这与李金珠等[25]和吕洪涛等[26]的研究结论一致,即Fe-As 共沉淀物的溶解度随体系pH 升高而急剧增加,稳定性明显下降。同时,渗析法结果及孔隙水As 形态说明,水溶性有机肥促进了无机自由态As(Ⅲ)转化为络合态并以DOC-As 的形式稳定存在于孔隙水中,其中,DOC 可与 As 形成As-DOM 二合络合物或借助金属桥形成As-X-DOM三合络合物,Fe 是目前发现的在As-DOM 络合中最有效的金属桥[27]。同时,水溶性有机肥在施用初期显著提高了孔隙水 Cd 的浓度,这很可能是由于水溶性有机肥的施用使土壤DOC 浓度显著增加,大量DOC 通过络合作用使土壤Cd 水溶性迅速升高,这与陈同斌和陈志军[28]的研究结果一致;随着淹水培育过程的进行,土壤Eh 迅速下降,主导Cd 形态由DOC-Cd 向沉淀态转化,该结果与Honma 等[29]的结果相一致。Burton 等[11]和O’Day[12]等的研究结果表明,硫酸盐可使厌氧条件下土壤水溶态As 通过形成Fe/As-S 沉淀或吸附于Fe-S 沉淀表面而使As 从土壤液相中得到去除。本研究结果表明,土壤 S2-含量出现与孔隙水含量恰好相反的变化趋势,与此同时,伴随着还原,SOF 处理使孔隙水 As(Ⅲ)、总Fe 以及Fe(Ⅱ)浓度均较OF 出现明显降低(图1,图 2)。
在土壤固相中,本研究结果表明,水溶性 OF处理使土壤固相 As 向生物有效性较高的化学形态转化,同时使土壤稳定态Cd 含量减少,而的加入未对以上过程产生明显的逆转效应(表3)。水溶性 OF 使土壤非稳态 As/Cd 含量升高的主要原因可能在于:作为微生物氧化代谢底物,土壤DOC 的显著增加促进了淹水条件下铁氧化物的还原溶解,从而导致铁氧化物结合态As/Cd 释放,这与钟松雄等[30]的研究结果一致;同时,微生物氧化 DOC 所生成的H+可能是导致碳酸盐结合态Cd 含量减少的主要原因[31]。
3.2 水溶性有机肥及其复配硫酸盐对水稻不同部位As、Cd 累积的减控效应
本研究发现,水溶性有机肥(OF)可显著降低幼苗期水稻茎叶As 含量,且协同施用硫酸盐条件下,水稻茎叶氧化态As(Ⅴ)比例较OF 明显增加,表明有利于 As(Ⅲ)向 As(V)的氧化转化,但目前尚不能确定该氧化过程是否部分发生在水稻体内。同时,根据本文结果,水溶性有机肥具有使水稻幼苗Cd 积累量和转运效率提高的重要风险(图3),类似地,有研究表明施用稻草也将促进水稻茎、叶对 Cd 的吸收[32],而施用猪粪、鸡粪可抑制水稻茎、叶对 Cd 的积累,表明不同类型有机肥对水稻 Cd 吸收积累的影响效果不同。其中,水溶性有机肥在Cd 污染稻田土壤中应谨慎施用。
值得说明的是,水稻收获后,水溶性OF 处理使成熟期水稻白根、茎秆和糙米As 积累量增加(图5)。针对这一现象,本文分析推测以下产生原因:此类有机肥在应用初期对土壤 As 溶出性和有效性产生以下两方面作用:第一,含量迅速升高的DOC 作为速效碳源可促进淹水土壤还原性微生物对铁氧化物及其结合态As 的还原溶解;第二,DOC 同时通过络合作用减少自由态无机As(如As(Ⅲ))含量,短期内可降低As 的根系可利用性。但是,随着水稻培育时间的增加,DOC 逐渐被微生物氧化消耗(图 1c)),由此使DOC 对无机As 的络合作用减弱直至消失,因此,在水稻生长后期(灌浆期,淹水培育 10 周后,图 2a)和图 2b)),大量水溶态 As以无机形态大量进入籽粒(该推论仍需后续进一步证实)。根据以上结果和分析,后续实验可尝试改变水溶性有机肥的加入方式,由“一次性施加”调整为“小剂量多次施用”,目的是使 DOC 对 As 的络合作用能够在整个水稻生育期内稳定持续,同时控制其对土壤铁氧化物的还原溶解。
此外,通过进一步对白米As 进行化学形态分析发现,OF 处理使白米无机As(Asi)含量升高而DMA(二甲基砷酸)含量下降(图6a)),这一点与前人所报道的向土壤添加有机质可促进As 甲基化的结论相反[33],推测其可能的原因如下:1)本研究中 OF 处理使土壤 pH 有所升高。通常认为,DMA 与 MMA(一甲基砷酸)浓度与土壤 pH 呈显著负相关[10],例如,Carbonell-Barrachina 等[34]的研究结果表明在污泥悬浮物pH 为6.5 时,有机态As 为主要形态,而pH 为8 时无机As 增加为主导形态。2)OF 处理可能打破了Asi甲基化和DMA 去甲基化菌群之间的平衡。目前已知硫还原菌群具有最高的As 甲基化能力[35],但是淹水条件下的去甲基化菌群目前人们仍知之甚少,因此针对我国南方稻田土壤,有机质的增加将对 As 甲基化和矿化转化菌群产生怎样的影响效应?这是一个值得进一步研究的重要科学空白,对于控制由施用有机肥引发的白米 Asi积累风险具有重要意义,直接关系到我国大面积As 污染土壤的安全利用。结果说明了有机肥具有增加白米无机 As积累的重要风险,尽管硫酸盐对糙米总As 积累有一定的减控作用,但对白米无机As 含量无显著的降低效应。与此同时,OF 与 SOF 处理使 Fe 膜中的 Cd持留量下降,导致白根Cd 积累升高,这进一步导致糙米Cd 含量增加,这说明水溶性有机肥及其与硫酸盐的协同施用对稻米Cd 积累具有重要促进作用,可对Cd 污染稻田土壤的安全利用产生重要威胁。
4 结 论
向淹水耕作稻田土壤中施用水溶性有机肥将增强土壤铁氧化物的还原溶解,使 As、Cd 生物有效性升高;特别对于土壤As 污染,有机肥可能通过影响 As 甲基化和去甲基化菌群的相对丰度与活性而增加白米对高毒性无机As 的积累。因此,水溶性有机肥在As/Cd 污染稻田土壤中的应用风险值得引起高度关注,而利用硫酸盐减控复合污染稻田土壤As/Cd 作物有效性的有利土壤化学条件则需要进一步探索。
