基于SRAP标记的国兰种质资源遗传多样性分析
2020-06-19袁媛曹彬张咏琪陈清西陈南川
袁媛 曹彬 张咏琪 陈清西 陈南川


摘 要:采用SRAP(sequence related amplified polymorphism)技术对154份国兰(杂交兰)种质资源的亲缘关系进行分析。从168对SRAP引物中筛选出16对条带多、带型清晰、多态性强的引物组合对所有样品进行扩增,共获得874条带,其中多态性条带857条,多态性比率为98.1%,平均每对引物每个样品产生5.74条带。UPGMA聚类分析表明:Me6-Em3引物能较好地揭示154份国兰种质间的遗传多样性与亲缘关系,在遗传相似系数0.818处将它们分为8个类群,遗传相似系数变化范围为0.772~1.000。此外,发现引物Me8-Em4、Me11-Em2和Me12-Em11可以较可靠地联合鉴定建兰。该研究结果可为国兰种质资源利用及杂种后代鉴定提供参考。
关键词:国兰;种质资源;SRAP标记;遗传多样性
中图分类号:S682.31 文献标识码:A
Genetic Diversity Analysis of Cymbidium Germplasms Based on SRAP Markers
YUAN Yuan1, CAO Bin1, ZHANG Yongqi1, CHEN Qingxi1*, CHEN Nanchuan2
1. College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China; 2. Fujian Bainong Ecological Technology Co., Ltd, Zhaoan, Fujian 363500, China
Abstract: SRAP (sequence related amplified polymorphism) was applied for the determination of the diversity of 154 samples of Cymbidium germplasm. 16 SRAP primer pairs were screened from 168 SRAP primers and applied to all the materials, resulting in 874 amplified DNA bands. For the amplified DNA bands, 857 were polymorphic, with a ratio of 98.1%. The average number of bands of each SRAP primer for each Cymbidium germplasm was 5.74. UPGMA cluster analysis showed that the genetic diversity and genetic relationship of the Cymbidium germplasms could be revealed by Me6-Em3 primer pair and could be classified into eight groups with a similarity coefficient 0.818 and the genetic similarity of the germplasms ranged from 0.772 to 1.000. It was found for the first time that the primer pairs Me8-Em4, Me11-Em2 and Me12-Em11 could be used together to identify C. Ensifolium reliably. Results in the present study could provide references for the utilization of Cymbidium germplasm and the identification of Cymbidium hybrid cultivars.
Keywords: Chinese Cymbidium; germplasm; SRAP marker; genetic diversity
DOI: 10.3969/j.issn.1000-2561.2020.05.012
国兰一般指中国兰花,是兰科(Orchidaceae)兰属(Cymbidium)草本植物,传统上分为春兰(C. goeringii)、建兰(C. ensifolium)、墨兰(C. sinense)、蕙兰(C. faberi)、寒兰(C. kanran)、春剑(C. longibracteatum)、莲瓣兰(C. tortisepalum)这7大类和其他国兰杂交资源[1-2]。除传统的国兰7大类分类外,有学者将建兰、墨兰分为建兰组,寒兰、春兰、春剑分在春兰组[3],或将春兰归为春兰组,建兰、寒兰、春剑和墨兰归为蕙组等[4]。杂交兰是兰属地生兰和附生兰种间杂交培育而成的兰花新种类,集地生兰的植株小巧、幽香、典雅和附生兰的花大、色纯靓丽等优异特性,花期长,有花观花、无花观叶,观赏价值和经济价值高,逐渐成为消费市场的新宠,开发潜力巨大[5]。
在国兰的育种工作中,由于种间及种内杂交频繁,导致许多国兰杂交品种的遗传背景复杂,且形态学分类在一些杂交品种的分类中存在着很大的局限性[6],这就为研究其分类和遗传多样性工作带来了很大的阻碍。此外,国兰资源命名不规范,存在“同物异名”和“同名异物”现象,且中文名称和拉丁文学名混乱,加上信息资源管理手段落后,限制了杂交兰的种质资源保存、交流、利用和创新。在此背景下,分子标记技术逐渐成为一种精确、快速鑒定国兰(杂交兰)之间亲缘关系的重要手段,包括SRAP、RAPD、AFLP、ISSR等[7-11]。其中,SRAP(sequence related amplified polymorphism)分子标记技术因高效、简便、不需预知物种序列信息、引物设计简单等特点[12],能提供的多态性信息比SSR分子标记更有效[13],比AFLP 分子标记更加优良[14],更适合国兰鉴定[15],已应用于建兰[16]、野生兰[17]、杂交兰[18]、寒兰[19]等国兰的研究中。
本研究采用SRAP 分子标记技术对154份国兰(杂交兰)样品的亲缘关系进行鉴定,并从中筛选3对引物作为联合鉴定建兰的标记引物,以期为种质资源鉴定、杂交育种中的亲本选配和种质资源的合理利用提供科学依据与技术基础。
1 材料与方法
1.1 材料
供试的154份国兰样品由福建百秾生态科技有限公司提供,样品编号和杂交类型详见表1。选取无病虫害,生长正常的植株,取新鲜幼嫩叶片3~5片,保存在?80 ℃冰箱中。
1.2 方法
1.2.1 提取DNA 使用高效植物基因组DNA提取试剂盒(天根生化科技有限公司)提取叶片DNA,使用微量紫外分光光度计测定浓度(UV- Vis Spectrophotometer Q5000,Quawell),用无菌ddH2O将DNA稀释至50 ng/μL工作液,?20 ℃冰箱中保存备用。
1.2.2 SRAP引物筛选 根据龚理等[20]在中国兰SRAP-PCR研究中筛选引物的结果,选择正向引物12条、反向引物14条(表2),共168对引物组合(铂尚生物技术上海有限公司)。以提取的2个亲缘关系近的国兰材料K41和K180的DNA样本为模板,分别用这168对引物组合进行PCR扩增,扩增产物用1.5%琼脂糖凝胶在105 V恒压电泳45 min,在凝胶成像仪下观察、拍照保存分析,最后选出扩增结果条带多、带型清晰、多态性强的引物组合16对。
1.2.3 SRAP-PCR扩增反应 用筛选的16对引物分别对154个国兰叶片DNA模板进行SRAP- PCR扩增反应(仪器为Bio-Rad S1000TM Thermal Cycler PCR)。PCR反应体系共25 μL,包含2×Taq Master Mix(北京全式金生物技术有限公司)12.5 μL、DNA模板1 μL、正向引物(10 μmol/L)0.5 μL、反向引物(10 μmol/L)0.5 μL、无菌ddH2O 10.5 μL。PCR扩增程序为:94 ℃预变性5 min,反应前5个循环为94 ℃变性1 min,35 ℃退火1 min,72 ℃延伸2 min;后35个循环为94 ℃变性1 min,50 ℃退火1 min,72 ℃延伸2 min,循环结束后再72 ℃延伸10 min。反应结束后取10 μL PCR产物用1.5%琼脂糖凝胶进行电泳检测,电压105 V,电泳时间45 min,电泳结束后在凝胶成像系统上(Bio-Rad SYSTEM Gel Doc XR+)采集图像,拍照保存。
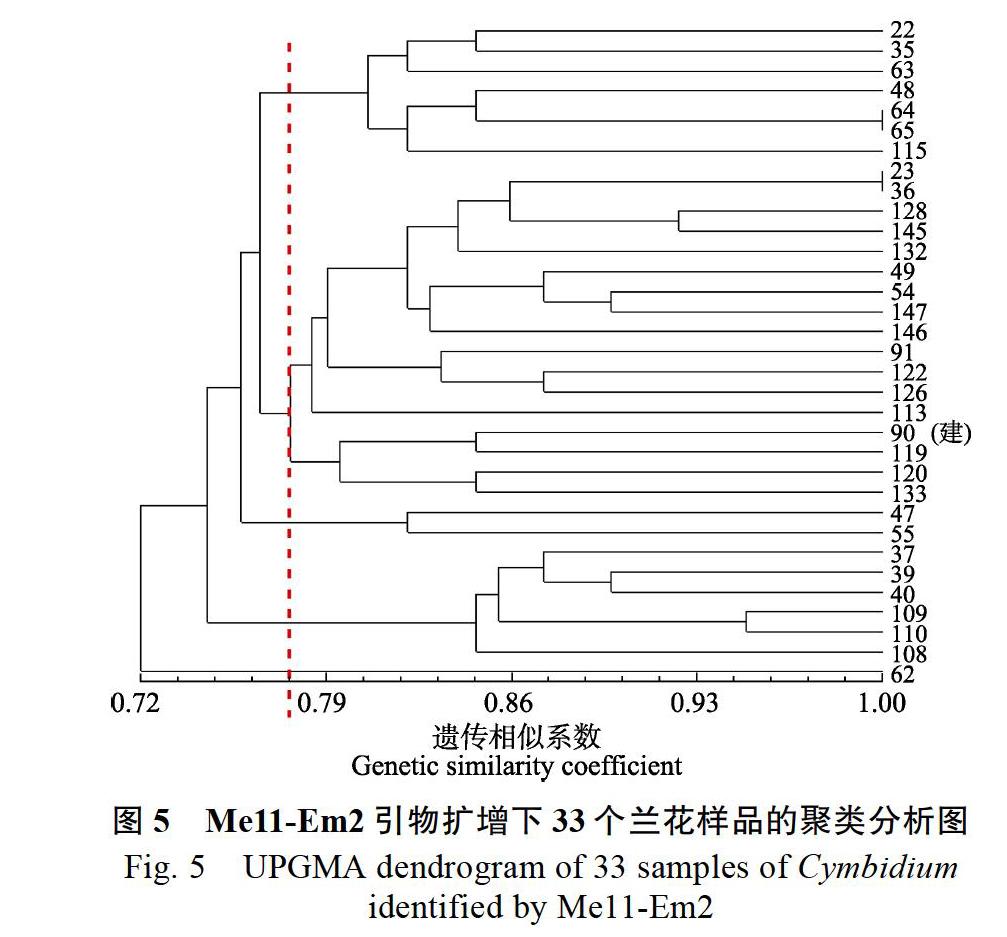
1.2.4 建兰鉴别引物的核验 通过16对引物扩增的图谱中,获得3对能较集中聚类建兰的引物,推测它们能在将来鉴定建兰中发挥一定作用,为核验它们联合鉴定建兰的功能,随机选取32个不同类别的国兰样品和1个建兰种质(90号)作为对照,分别使用这3对引物组合对这33个国兰样品进行SRAP分析,制作聚类树状图,然后统计3张聚类树状图中与90号建兰聚类的国兰种质,再将这些种质取交集,查询交集种质的来源是否为建兰,从而验证这3组引物鉴定建兰的可靠性。
1.3 数据处理
采用人工计数的方式读取SRAP-PCR扩增的条带,以DL2000 Marker为标准,在同一引物、同一位点有条带记为“1”,无条带记为“0”,统计结果用Excel 2010软件制作(0,1)矩阵。通过NTSYS-pc 2.10软件的SAHN Clustering分析(0,1)矩阵,使用UPGMA算法得到遗传相似性系数(GS),并由软件自动生成聚类树状图。依次制作16对引物的扩增聚类图谱,并从中筛选出能特异性鉴别建兰的引物。
2 结果与分析
2.1 国兰DNA提取和检测
154份国兰叶片DNA经过电泳检测,条带清晰完整(图1);用紫外分光光度计检测,浓度均在50 ng/μL以上;OD260/230比值1.8~2.0,OD260/280比值1.74~2.0,表明DNA完整性、浓度、纯度均
符合实验要求。
2.2 国兰SRAP多态性分析
从168对SRAP引物组合中,筛选出16对扩增条带数目多、条带清晰的引物组合,分别为Me5- Em14、Me6-Em3、Me7-Em3、Me8-Em2、Me8-Em4、Me8-Em5、Me8-Em8、Me8-Em13、Me8-Em15、Me9-Em3、Me11-Em2、Me11-Em4、Me11-Em15、Me12-Em9、Me12-Em11、Me12-Em12,用于全部国兰样品的SRAP-PCR扩增反应。
用筛选出的16对引物对154份国兰种质进行SRAP-PCR扩增。图2为其中一对引物的扩增图谱。16对引物共扩增出54个位点,共获得874条具有重复性的DNA带,其中多态性条带857条,多态性比率为98.1%。平均每对引物扩增每个样品获得5.74条。表明SRAP标记在国兰种质中具有较为丰富的多态性,能较好地揭示国兰材料间的亲缘关系。
2.3 遗传相似性分析
154份国兰种质遗传相似系数(GS)在0.772~ 1.000区间内,说明大部分国兰种质之间遗传距离相对较近。12号‘K10-秋香与14号‘K44、100号‘福隆与101号‘雪兰之间的遗传相似系数最高,为1.000,表明它们的遗传距离最近;67号‘金华山与12号‘K10-秋香的遗传相似系数最低,为0.772,表明它们的遗传距离较远。
2.4 国兰样品SRAP聚类分析
根据筛选出的16对多态性引物扩增得到SRAP扩增结果,利用NTSYS软件进行UPGMA聚类分析,得出154份国兰材料的亲缘关系聚类图(图3)。在遗传相似系数为0.818处将154份国兰材料分为8个大类,第Ⅰ類是67号;第Ⅱ类是126号;第Ⅲ类包括46、48、89、93、47、87、102、88和115号材料,这些材料大部分含有春兰的基因;第Ⅳ包括137号;第Ⅴ类包括128号;第Ⅵ类包括65、66、71和119号4份材料,其中65号‘花开富贵与66号‘S04-62聚类到一起,71号‘K33a-3和119号‘K30黄金小神童聚类到一起;第Ⅶ类包括105、45、104、106、110、112、118、108、109、111和113号材料;第Ⅷ类为剩下的所有国兰材料。
在此基础上,第Ⅷ类在相似系数为0.825处可划分为A、B、C 3个亚类(图3)。A类在相似系数0.860处划分为6类,其中A1类包括1、5、9、12、14、15、16、7、86、68、84、97、132、82、91、99、100、101、103、6、27、73、125、146、29、142、83、85、127、145、26、74和43号材料;A2类包括79、81、143、78、95、94和96号材料;A3类包括69、70、72和90号材料;A4类包括2、124、3、77、13、18、25、130、24、75、4、11、129、22、8、10和23号材料,主要为建兰或墨兰后代;A5类包括17、148、44、98、147、49、133、19、135、76、20、50、138、80、144、136、21、121、123和141号材料;A6类包括56、60、57、59和131号材料。B类在相似系数0.860处可划分为4类,B1类包括54号和153号两份材料;B2类包括28、31、63、107、114、92和116号材料,除未知杂交类型的材料外,其余大部分为大花蕙兰与其他类型兰花的杂交后代;B3类包括30、32、37、51、38、40、41、150、33、34、39、149、58、122、62、35、154、151、42、36和64号材料;B4类为117号和120号。C类包括53、61、52、152、55、139、134和140号材料。
2.5 联合鉴别建兰引物的核验
在16对引物中,有3对引物的聚类分析结果显示建兰材料较为集中地聚集在一起,推测它们对建兰的鉴定作用更显著,进而推测联合使用3对引物可以从不同国兰材料中鉴别出建兰及其后代。为了核验这种推测,本研究使用3对引物Me8-Em4、Me11-Em2和Me12-Em11对33个国兰样品进行PCR扩增,其中90号建兰‘金荷作为鉴别参照。在Me8-Em4鉴别聚类图中(图4),GS变化范围为0.73~0.97,在GS为0.826时,与90号‘金荷聚为一类的样品有:40、120、91、110、119、122、62、147、113、63、64和115号。
在Me11-Em2鉴别聚类图(圖5)中,GS变化范围为0.72~1.00,在GS为0.769时,与90号‘金荷聚为一类的样品有:23、36、128、145、132、49、54、147、146、91、122、126、113、119、120和133号。
在Me12-Em11鉴别聚类图(图6)中,GS变化范围为0.74~1.00,在GS为0.788时,与90号‘金荷聚为一类的样品有:54、55、64、91、109、110、120和122号。
33个国兰种质在3对不同引物的聚类分析下均与90号建兰‘金荷聚类的是120、91和122号。通过查询这3种国兰的种质来源,发现三者确实为建兰,在表型上也具有建兰的特点,如叶带型前部有锯齿、花序直立并通常短于叶、总状花序、花瓣狭长或椭圆等(图7)。
3 讨论
3.1 SRAP技术能较为准确地鉴定国兰的亲缘关系
SRAP分子标记技术由于具备了AFLP分子标记的多态性高、可靠性强以及可重复性好的特点,同时具备了RAPD分子标记的随机性、方便性和引物设计的简便性等多方面的优势,备受国内外研究者青睐[6],在花卉、草坪草、农作物、果树中的应用中均发现其是一个较为稳定和准确的标记系统[21-27]。
本研究的结果也证实,根据已有的材料来源数据,SRAP分析得到的聚类结果能较真实地反应供试材料的亲缘关系,如A4类中10号‘K24-1福韵丹霞与22号‘K26有相同的父本。A5中20号‘S1309-3和147号‘K02-68的父本都来自于‘K21紫妍氏,而‘K21紫妍氏与19号‘K21-1紫妍氏又有着较近的亲缘关系,二者均为红花,唇瓣带胭脂红斑,为大卷舌。A6类中57号‘K56紫妍氏三星蝶和59号‘K52绿翡翠爪艺都是墨兰和大花蕙兰杂交后代芽变而来,不同的是,前者是芽变花艺品,而后者是芽变叶艺品。B3类中150号‘(K26×C683)-7、34号‘(K26×C705)-11、62号‘(K26×C683)-83种杂交兰的亲本之一均为‘K26福韵红霞,且35号‘K24福韵丹霞与‘K26福韵红霞为兄弟株。C类中53号‘泗港水老叶无叶艺和61号‘泗港水聚类到一组,前者的老叶艺退化,而后者有叶艺。这个结果说明各种质间的亲缘关系与来源、花色、花型、叶型、叶艺等均有一定的相关性,与钟淮钦等[28]、牛田等[29]、马红勃等[30]分析国兰花亲缘关系的研究结果一致。79号建兰材料‘一品梅和81号墨兰材料‘C150-2、3号建兰材料‘C428绿梅和77号墨兰材料‘C387遗传相似系数均为0.939,表现出较近的亲缘关系,这与前人研究发现建兰、墨兰和寒兰三者的亲缘关系比较近,而春兰与它们的亲缘关系较远[4, 17, 31]的结论一致。
尽管大部分结果与实际相吻合,但聚类分析出现一些目前尚无法解释的结果,如97号墨兰材料‘C387青叶达摩和132号春兰材料‘C625帝冠聚为一簇;100号建兰材料‘福隆和101号春兰材料‘雪兰聚为一簇,但它们在花型、叶型上的表现完全不同;在Me8-Em4聚类图谱中,86号春剑杂交种和109号建兰聚到一起,而目前并没有研究证明春剑和建兰有较近的亲缘关系。这些结果可能是由于供试材料遗传背景较为复杂,或植株出现芽变,或引物不够特异等,其原因有待进一步研究。
3.2 SRAP技术可为杂种后代鉴定提供依据
在漫长且复杂的选育过程中,有些品种可能会由于记录不够完善导致丢失或不确定其分类类型或杂交类型,可通过SRAP进行聚类分析,推测其遗传背景。例如A3类中70号‘C456-1和90号‘金荷均为建兰,推测69号‘DF705B和72号‘L1120与建兰亲缘关系很近;65号‘花开富贵为春兰杂交品种,119号‘K30黄金小神童为建兰和大花蕙兰杂交品种,推测66号‘S04-62可能含有春兰基因,71号‘K33a-3可能含有建兰或大花蕙兰基因;26号‘K21-2先与墨兰和大花蕙兰的杂交后代74号‘K42 金吉利聚为一树,再与同样为墨兰和大花蕙兰的杂交后代的43号‘K32-3聚为一树,推测26号‘K21-2也可能为墨兰和大花蕙兰的杂交后代;A4类中8号‘K06黄金三结义、10号‘K24-1福韵丹霞和22号‘K26福韵红霞三者表现出较近的亲缘关系,而10号‘K24-1福韵丹霞和22号‘K26福韵红霞均为大花蕙兰与墨兰的杂交后代,且父本来源相同,推测8号‘K06黄金三结义极有可能为大花蕙兰与墨兰的杂交种;在A6类的五个品种中,56号‘K29黄金小神童爪艺、57号‘K56紫妍氏三星蝶和59号‘K52绿翡翠爪艺三者均为大花蕙兰与其他类型国兰的杂交后代,推测60号‘K40-1和131号‘K58也可能携带大花蕙兰基因;在Me8-Em4聚类图谱中,当GS为0.952时,70号‘C456-1先和75号‘L1101、79号‘一品梅、91号‘C1103聚到一起,再与76号‘C459小桃红、94号‘DF402和125号‘C11大国冠聚到一起,其中除75号和125号分类未知外,其余70、79、91、76和94号均为建兰,由此推测75号和125号可能也是建兰或者含有建兰亲本的杂交兰。当GS为0.968时,27号‘S457-11、61号‘泗港水、142号‘GS1001-1和146号‘幸姬与126号‘K31-2玉凤之华聚类到一起。27号为建兰,61号为墨兰,二者聚到一起,说明二者具有一定的相似性且亲缘关系相近,这与唐源江等[32]应用SRAP分子标记技术研究国兰种质资源遗传关系聚类结果相同,也与文李等[33]利用RAPD分子标记技术得出建兰与墨兰亲缘关系最近,且两者具有更强的亲和性的结果相符。142号与146号为墨兰种间杂交,126号为墨兰和大花蕙兰杂交,它们聚到一起,推测142号含有墨兰基因。这些结果可为品种间的分类、杂种后代鉴定和杂交育种提供理论依据。
3.3 基于SRAP技术利用多对引物联合鉴定建兰
根据UPGMA聚类结果,从16对引物中选择出聚类较为清晰、明显,且能较集中聚类建兰的3对引物,即Me8-Em4、Me11-Em2和Me12-Em11。虽然这3对引物单独使用时无法将所有建兰及其后代聚集在一起来准确鉴定建兰,但推测联合使用3对引物将有望增加鉴定建兰的准确性。为验证这一猜想,使用3对引物分别对包括90号建兰在内的33个兰花种质(随机选择,包括春兰、墨兰、建兰、寒兰或其后代)进行聚类分析,取3对引物中和建兰聚类到一起的交集品种,即可推断其为建兰,如3组引物中均与90号建兰‘金荷聚类在一起的是120、91和122号,通过追溯他们的来源,发现它们的确属于建兰,表明利用这3对引物联合鉴别建兰确实具有一定的准确性和可靠性。相比通过单一引物对鉴定国兰种质的方法,这种多对引物联合鉴定的方法具有一定创新性,也为鉴定其他国兰种质提供新的思路。鉴于本研究仅选取了33种国兰材料,利用这3对引物联合鉴定建兰的严谨性还需要结合形态评价、增加样本量等方法进行深入的研究。
4 结论
本研究利用SRAP标记技术,对154份国兰材料的亲缘关系进行分析,从聚类结果来看,154份国兰材料间表现出的遗传背景比较复杂,具有丰富的遗传多样性,在遗传相似系数0.818处可将154份供试材料划分为8个类群,再对8个大类作细分,最终可将全部供试材料分为18类。SRAP标记在这些材料的亲缘关系分析中表现的可信度较高,且可根据聚类结果推定未知材料的来源。此外,本研究发现,联合3對SRAP引物Me8-Em4、Me11-Em2和Me12-Em11在鉴定建兰及其后代上具有一定的可靠性和准确性。从本研究的结果来看,SRAP技术可为杂交兰品种改良、分类命名及杂种后代鉴定等提供依据,多对引物联合鉴定建兰也具备一定的准确性和可靠性,需要进一步增大样品数量以确认其严谨性。
参考文献
敖素燕, 范义荣, 段艳皊, 等. 31个国兰品种的数量性状分析[J]. 江苏农业科学, 2014, 42(9): 131-134.
严 华, 张冬梅, 罗玉兰, 等. 38种国兰亲缘关系的ISSR分析[J]. 分子植物育种, 2010, 8(4): 736-741.
Puy D D, Cribb P. The genus Cymbidium[M]. London, Portland, Oregan: Christophor Helm Timber Press, 1988.
吴应祥. 中国兰花[M]. 2版. 北京: 中国林业出版社, 1993.
陆 然. 杂交兰: 生产渐成规模 产销优势明显[J]. 中国花卉园艺, 2013(1): 23-24.
龚 理. 部分国兰品种(系)的SRAP遗传多样性研究[D]. 福州: 福建农林大学, 2014,
甘 娜, 谭向红, 陈其兵, 等. 应用RAPD标记和细胞质基因组PCR-RFLP技术研究大花蕙兰的遗传多样性[J]. 园艺学报, 2006, 33(2): 349-355.
肖文芳, 李 佐, 尤 毅, 等. 兰属杂交兰绿翡翠组培变异的RAPD检测与鉴定[J]. 广东农业科学, 2014, 41(21): 135-139.
田韦韦, 王彩霞, 田 敏, 等. 文心兰体细胞无性系变异的倍性检测和CE-AFLP分析[J]. 核农学报, 2017, 31(2): 241-247.
张亚楠, 杨柏云, 熊冬金, 等. 寒兰转录组SSR信息分析及其分子标记开发[J]. 南昌大学学报(理科版), 2017, 41(3): 249-254.
江亚雯, 孙小琴, 罗火林, 等. 基于ISSR标记的江西野生寒兰居群遗传多样性研究[J]. 园艺学报, 2017, 44(10): 1993-2000.
Li G, Quiros C F. Sequence-related amplified polymorphism (SRAP), a new marker system based on a simple PCR reaction: its application to mapping and gene tagging in Brassica[J]. Theoretical and Applied Genetics, 2001, 103(2-3): 455-461.
Ahmad R, Potter D, Southwick S M. Genotyping of peach and nectarine cultivars with SSR and SRAP molecular markers[J]. Journal of the American Society for Horticultural Science, 2004, 129(2): 204-210.
Ferriol M, Picó B, Nuez F. Genetic diversity of a germplasm collection of Cucurbita pepo using SRAP and AFLP markers[J]. Theoretical and Applied Genetics, 2003, 107(2): 271-282.
随粉粉. 福建国兰种质资源遗传多样性研究[D]. 福州: 福建农林大学, 2010.
张 芬, 李 达, 吕长平, 等. 兰花SRAP指纹图谱的构建[J]. 湖南农业科学, 2011(3): 129-132.
杨光穗, 任 羽, 王荣香. 利用SRAP技术分析海南野生兰属植物的亲缘关系[J]. 热带农业科学, 2011, 31(9): 1-3.
何俊蓉, 蒋 彧, 孙淑霞, 等. 13个国兰品种遗传关系的SRAP分析[J]. 分子植物育种(网络版), 2011, 9(1): 1619-1625.
蹇 黎, 朱利泉. 寒蘭品种类型的SRAP分子鉴定[J]. 中国农业科学, 2010, 43(15): 3184-3190.
龚 理, 黄添毅, 王 芳, 等. 国兰杂交品种(系)SRAP- PCR反应体系优化及引物快速筛选[J]. 热带作物学报, 2014, 35(5): 925-932.
孙荣喜. 国槐种子形态变异与品种/无性系SRAP分子识别研究[D]. 北京: 中国林业科学研究院, 2011.
薛丹丹, 郭海林, 郑轶琦, 等. 结缕草属植物杂交后代杂种真实性鉴定——SRAP分子标记[J]. 草业学报, 2009, 18 (1): 72-79.
谢立峰, 李 宁, 李 烨, 等. 茄子种质遗传多样性及群体结构的SRAP分析[J]. 植物学报, 2019, 54(1): 58-63.
赫 卫, 张 慧, 董延龙, 等. 辣椒种质资源形态学性状相关性、主成分与聚类分析[J]. 北方园艺, 2018(4): 9-17.
白 羽, 丁海麦, 石松利. 濒危植物蒙古扁桃SRAP反应体系优化[J]. 江苏农业科学, 2019, 47(3): 46-48.
童 俊, 毛 静, 董艳芳, 等. 鸢尾属部分种质资源遗传多样性的SRAP分析[J]. 湖北农业科学, 2019, 58(4): 88-92.
林榕燕, 叶秀仙, 钟淮钦, 等. 基于SRAP分子标记的石斛兰种质资源遗传多样性分析[J]. 福建农业学报, 2018, 33(5): 469-473.
钟淮钦, 林榕燕, 黄敏玲, 等. 杂交兰种质资源遗传多样性的SRAP分析[J]. 福建农业学报, 2016, 31(11): 1193-1197.
牛 田, 张 林, 王厚新, 等. 利用SRAP标记分析春兰种质资源遗传多样性[J]. 农学学报, 2014, 4(8): 53-58.
马红勃, 赖鋆英, 许旭明, 等. 基于SRAP标记的大花蕙兰种质资源遗传多样性分析[J]. 植物遗传资源学报, 2011, 12(4): 551-556.
孙彩云, 张明永, 叶秀粦, 等. 中国兰属植物种间及品种间亲缘关系的RAPD分析[J]. 园艺学报, 2005, 32(6): 1121- 1124.
唐源江, 曹雯静, 吴坤林. 基于SRAP标记的国兰种质资源遗传多样性分析及分子身份证构建[J]. 中国农业科学, 2015, 48(9): 1795-1806.
文 李, 叶庆生, 王小菁, 等. 利用RAPD技术分析兰属(Cymbidium)品种间的亲缘关系[J]. 应用与环境生物学报, 2001(1): 29-32.
