模拟盐渍化对甜瓜种子萌发和幼苗生理特性的影响
2020-06-19张贝贝樊佳茹王景荣韩晓云袁慧敏GefuWANG-Pruski张志忠
张贝贝 樊佳茹 王景荣 韩晓云 袁慧敏 Gefu WANG-Pruski 张志忠
摘 要:為了解盐渍化对甜瓜种子萌发的影响,本研究以甜瓜品种‘新银辉为材料,采用NaCl和NaHCO3单独处理和复合处理模拟盐渍化,观测不同处理下甜瓜种子萌发情况以及生理生化指标的变化。结果表明:NaCl、NaHCO3、NaCl和NaHCO3复合处理模拟的盐渍化几乎都对甜瓜种子萌发产生了抑制作用,胁迫浓度越高,抑制作用越明显;仅低浓度(50 mmol/L)的NaCl表现出一定的促进作用。NaCl和NaHCO3复合处理后甜瓜种子萌发过程中超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性随着处理时间增加,呈升降升的趋势;过氧化物酶(POD)活性先上升后下降;脯氨酸(Pro)含量持续上升;可溶性糖含量持续下降;丙二醛(MDA)含量始终显著高于蒸馏水对照;淀粉含量随着处理时间增加呈下降的趋势,α-淀粉酶活性和β-淀粉酶活性均呈先下降、后上升的趋势。模拟盐渍化明显抑制甜瓜种子的萌发和幼苗生长,保护酶活性、淀粉代谢在应对胁迫中起到了明显作用,研究结果有助于为甜瓜耐盐机制和设施栽培提供有益的参考。
关键词:甜瓜;盐渍化;种子萌发;保护酶;淀粉代谢
中图分类号:S652 文献标识码:A
Effects of Simulated Salinization on Seed Germination and Physiological Characteristics of Muskmelon Seedlings
ZHANG Beibei1, FAN Jiaru1, WANG Jingrong1, HAN Xiaoyun1, YUAN Huimin1, Gefu WANG-PRUSKI1,2*, ZHANG Zhizhong1*
1. Joint FAFU-Dalhousie Lab / College of Horticulture, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China;
2. Faculty of Agriculture, Dalhousie University, Truro, Nova Scotia B2N 5E3, Canada
Abstract: Using muskmelon cultivar ‘Xinyinhui as the material, the effects of salinization on the germination of muskmelon seeds were observed after treated by NaCl and NaHCO3 alone and combined. At the same time, some physiological and biochemical indexes related to saline-alkali stress were measured. The results showed that the simulated salinization of NaCl, NaHCO3, NaCl and NaHCO3 could inhibit seed germination. The inhibition increased with the increase of stress concentration and the extension of stress time. Only low concentration (50 mmol/L) of NaCl showed a certain promoting effect. The activities of superoxide dismutase (SOD) and catalase (CAT) first increased, then decreased, and then turned to an upward trend during the germination of muskmelon seeds treated with NaCl and NaHCO3. Peroxidase (POD) activity increased first and then decreased. Proline (Pro) content continued to rise, while soluble sugar content continued to decline. Malondialdehyde (MDA) content was always significantly higher than that of the control group treated with distilled water. Starch content decreased with the extension of treatment time. The activity of α-amylase and β-amylase decreased first and then increased. Generally speaking, simulated salinization significantly inhibited the seed germination and seedling growth of muskmelon, and protective enzymes and starch metabolism significantly participated in the response to salt-alkali stress. The results would help to reveal the response mechanism of muskmelon seeds to salinization stress during germination, and provide theoretical and practical references for facility seedling raising and plant cultivation in saline-alkali environment.
Keywords: muskmelon; salinization; seed germination; protective enzyme; starch metabolism
DOI: 10.3969/j.issn.1000-2561.2020.05.010
土壤盐渍化是由于土壤底层或地下水的盐分上升到地表,水分蒸发导致盐分在表层不断累积所致,又称为盐碱化。目前全球约有8.31亿hm2盐渍化土地,约占陆地总面积的10%,是威胁全世界农业生产的主要非生物胁迫之一[1]。近年来,我国盐渍化土壤总面积约为3.6×107 hm2,占全国可利用土地的4.88%,严重影响农业生产和粮食安全[2-3],并且因地下水超采、海水倒灌、化肥过量使用等问题有逐年加重的趋势。温室大棚等农业设施由于长期覆盖薄膜,阻碍了自然降水的冲淋,使得盐渍化问题在设施栽培中尤为突出,已成为影响设施园艺可持续发展的主要问题之一。盐渍化對植物的不利影响包括土壤盐分浓度过高产生的渗透胁迫、氧化应激、离子毒害等,同时盐渍化土壤的pH升高往往会对植物造成进一步的伤害[4]。生长在盐碱土环境中的植物在能量和物质代谢方面会受到明显阻碍,植物的养分吸收困难,尤其对植株早期生长的影响最为明显,盐碱胁迫对植物种子萌发、根长、株高、果实发育、果实品质等具有显著影响[5]。
甜瓜(Cucumis melo L.)是葫芦科(Cucur bitaceae)甜瓜属(Cucumis)一年生蔓性草本植物,为世界广泛栽培的重要园艺植物[6]。我国是甜瓜种植面积和消费量最大的国家,2016年甜瓜栽培面积为48.19万hm2,产量1635万t[7]。目前甜瓜设施栽培和基地化栽培在我国非常普遍,由于常年连作、过量施肥、设施封闭环境等因素的影响,栽培中土壤盐渍化问题日趋严重[8],已成为制约我国甜瓜产业可持续发展的重要问题[9]。盐渍化会影响种子的发芽速度、活力指数、发芽指数等,也会抑制幼苗的株高、根系生长、叶面积等[10-12],目前在园艺作物中相关研究主要集中在番茄[13]、黄瓜[14]和西瓜[15]。一般认为甜瓜具有中等程度的耐盐性[16],因此关于甜瓜盐碱胁迫的研究往往被忽视。随着这一问题日趋严重,甜瓜盐碱胁迫的研究开始逐步受到重视[9]。本研究选用甜瓜品种‘新银辉作为研究材料,该品种丰产性和商品性状表现优异,目前已成为福建等地的主栽品种之一,深受瓜农欢迎[17],研究其抗盐碱能力有助于充分发挥其品种特性,进一步扩大栽培范围,提高栽培效益。本研究采用盐渍化土壤的代表性成分NaCl、NaHCO3单独处理,以及复合处理模拟土壤盐渍化,探讨盐渍化对甜瓜种子萌发、幼苗生长的影响及其生理特性基础,研究结果将有助于揭示甜瓜种子萌发过程中对盐渍化胁迫的应答机制,为设施育苗和盐碱环境植物栽培提供理论参考和实践参考。
1 材料与方法
1.1 材料
甜瓜品种:‘新银辉,种子购于福建省农嘉种业股份有限公司。
1.2 方法
1.2.1 单盐胁迫和盐碱复合胁迫处理浓度设置 实验分别设置不同浓度的NaCl、NaHCO3进行单盐胁迫处理,NaCl和NaHCO3混合溶液进行模拟盐渍化胁迫处理。NaCl浓度设置为0(CK)、50、100、150、200、250 mmol/L;NaHCO3浓度设置为0(CK)、30、60、90、120 mmol/L。NaCl和NaHCO3混合溶液处理浓度设置为CK:0 mmol/L NaCl+0 mmol/L NaHCO3;A:25 mmol/L NaCl+ 12.5 mmol/L NaHCO3;B:50 mmol/L NaCl+ 25 mmol/L NaHCO3;C:100 mmol/L NaCl+ 50 mmol/L NaHCO3。
1.2.2 不同盐碱胁迫处理对甜瓜种子萌发的影响 挑选均匀饱满的甜瓜种子,10%的H2O2浸种消毒10 min,无菌蒸馏水冲洗数次,转移入垫有2层滤纸的培养皿(90 mm)中,30粒/皿,每个培养皿中加不同浓度的处理液4 mL(可保证充分浸透滤纸),无菌蒸馏水处理作对照,处理液、滤纸和培养皿均做无菌处理后使用。培养皿盖好置于28 ℃黑暗条件下进行发芽培养,每24 h观察一次,统计发芽种子数目,并测定主根长、下胚轴长和鲜重等形态学指标。3 d更换1次新的处理液和滤纸,第7天时计算各处理种子的发芽率、发芽指数、发芽活力。种子发芽标准以种子露白长度达到种子长度的一半为准。发芽率=第7天全部发芽的种子数/供试种子数×100%;发芽势= n/N×100%(n为发芽势3 d内的正常发芽粒数,N为播种种子总数);发芽指数(GI)=∑Gt/Dt(Gt为第t天种子发芽数,Dt为对应的种子发芽的天数);活力指数(VI)=S×Σ(Gt/Dt)(S为第7天每株平均鲜重,Σ(Gt/Dt)为第7天的发芽指数)。
1.2.3 NaCl和NaHCO3复合处理对甜瓜种子萌发及部分生理生化指标的影响 在上述实验基础上选取50 mmol/L NaCl+25 mmol/L NaHCO3混合溶液处理甜瓜种子,分别在处理后0、12、24、36、48、60、72 h取样,每次取样0.1 g,液氮速冻后于?80 ℃保存,供后续生理生化指标测定。主要测定指标包括超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、过氧化物酶(POD)、丙二醛(MDA)、脯氨酸(Pro)、可溶性糖、淀粉含量、α-淀粉酶活性、β-淀粉酶活性,均采用苏州科铭生物技术有限公司相关试剂盒测定,具体方法参考试剂盒说明书。
1.3 数据处理
采用WPS和Excel进行数据统计和整理,采用SPSS 22.0软件进行差异分析,采用GraphPad Prism 8完成统计分析和绘图。本研究所有测定指标均设置3次重复。
2 结果与分析
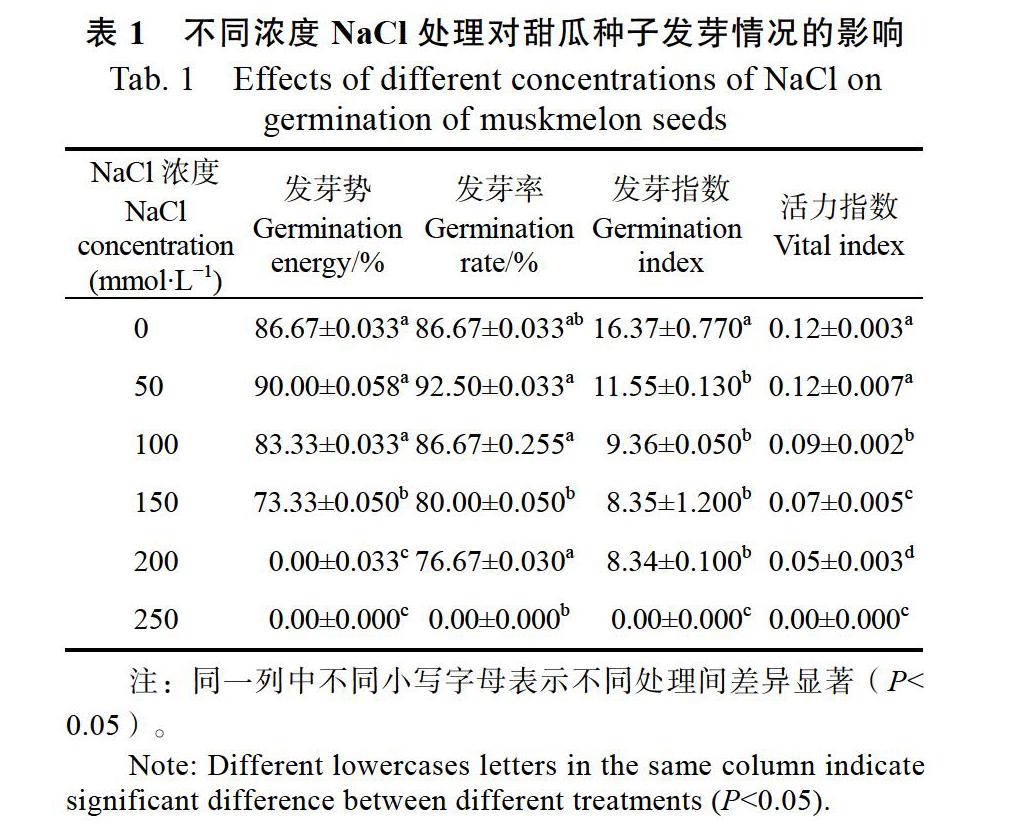
2.1 不同浓度NaCl处理对甜瓜种子萌发的影响
由表1可以看出50 mmol/L NaCl溶液处理的种子发芽率92.5%高于对照的发芽率86.67%,发芽势(90.00%)也高于对照组(86.67%)。50 mmol/L的NaCl溶液在发芽率和发芽势上与对照不存在显著差异,并且能够促进种子萌发。高浓度的NaCl溶液抑制了种子萌发和幼苗生长,甚至导致种子不能萌发。当NaCl溶液浓度250 mmol/L时,已经完全抑制了种子萌发。种子的活力指数在不同处理间差异显著(P<0.05)。
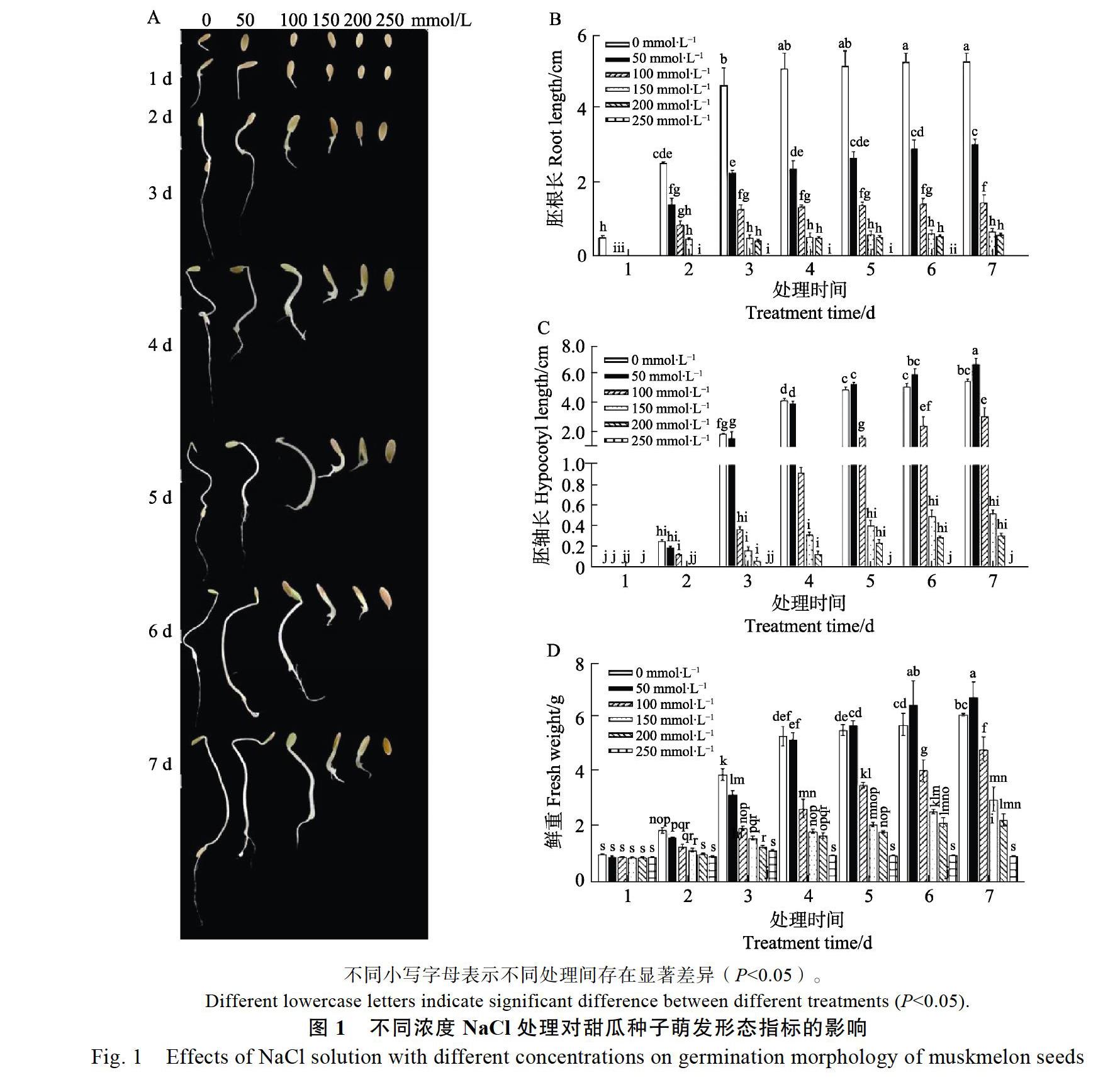
不同浓度的NaCl溶液对种子萌发的形态学影响如图1所示,在NaCl溶液为50 mmol/L时,种子处理的第7天,胚轴长度和鲜重大于对照,根长小于对照,并存在显著性差异。其余处理浓度的各项观测值均低于对照,显然较高浓度的NaCl抑制了种子萌发,在处理浓度达到或超過150 mmol/L时,种子出现只萌发不生长,甚至不能萌发的现象。
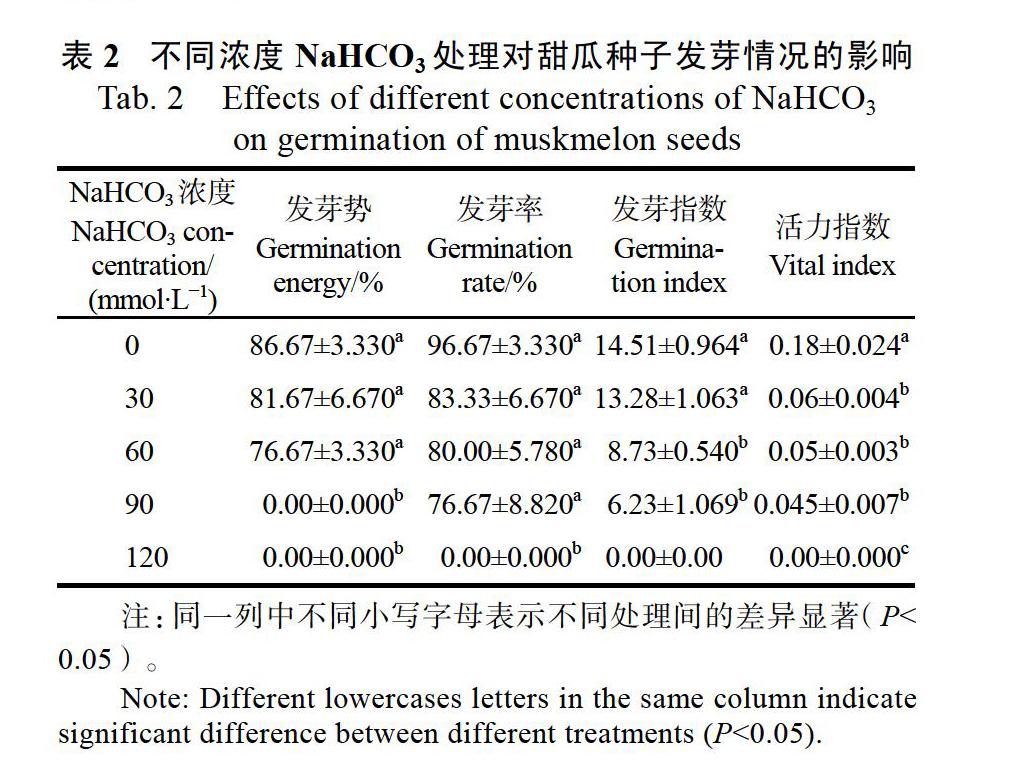
2.2 不同浓度NaHCO3处理对甜瓜种子萌发的影响
不同浓度NaHCO3胁迫处理后甜瓜种子的发芽率、发芽势、发芽指数均随处理浓度的增加而降低(表2)。当NaHCO3浓度达到90 mmol/L时,处理前3 d没有种子萌发;浓度为120 mmol/L时7 d内未发现种子萌发。NaHCO3胁迫对甜瓜种子萌发具有明显的抑制作用,即使在较低的处理浓度下也表现出一定程度抑制;但除种子活力指标外,低处理浓度和对照间不存在显著差异。种子活力可以作为衡量不同浓度NaHCO3胁迫效果的指标(表2)。
不同浓度的NaHCO3溶液对种子萌发形态学的影响如图2所示,在NaHCO3处理浓度为120 mmol/L时,甜瓜种子彻底不能萌发;处理浓度为90 mmol/L时,种子虽可以萌发但后续没有明显的生长量。所有NaHCO3处理浓度的各项观测值均低于对照,处理组发芽率低,胚轴长、胚根长、鲜重等形态指标也均低于对照。总体而言NaHCO3对甜瓜种子的萌发具有强烈的抑制作用,且明显高于同浓度NaCl的胁迫。
2.3 NaCl和NaHCO3复合处理对甜瓜种子萌发的影响
NaCl和NaHCO3复合处理后甜瓜种子萌发情况、胚根长、胚轴长、鲜重等指标随着处理浓度的增加而下降,大多与对照存在显著差异,且随着胁迫时间增加抑制作用逐步增强(表3)。C处理下,7 d内未发现种子萌发。A处理和B处理下,幼苗的发芽势与对照组之间没有显著差异,但发芽指数和活力指数与对照存在显著差异。A处理下,发芽率与对照差异不明显,而B处理下,发芽率与对照存在显著差异。总体而言,本研究中各种浓度组合的NaCl和NaHCO3复合处理均抑制了甜瓜种子的正常萌发和后续生长。
2.4 NaCl和NaHCO3复合处理对甜瓜种子萌发过程中保护酶和淀粉代谢的影响。
B处理后甜瓜种子萌发过程中,SOD活性在处理的0~12 h上升了14.22%,随后开始下降,在36~60 h出现大幅度上升,但在处理的第72小时又下降到最小值70.21 U/g。处理的24 h后,SOD活性与对照表现出显著差异(图3A)。POD活性先上升后下降,在处理的24 h后与对照差异明显,48 h后POD活性达到最大值(图3B)。CAT活性在0~36 h一直上升,在36 h后达到最大值,为1942.47 nmol/(min·g),在48 h后先大幅度下降然后又开始上升(图3C)。
B处理下甜瓜种子萌发过程中的MDA(丙二醛)含量呈先上升后下降的趋势(图4A)。在0~ 12 h,MDA(丙二醛)含量大幅度上升了510.53%,在48 h上升达到最大32.25 nmol/g,48 h后小幅度下降。NaCl和NaHCO3混合溶液处理诱导甜瓜种子MDA的大量积累。种子可溶性糖含量随着处理时间增加而下降(图4C)。在48、60、72 h下降幅度减慢,与对照间差异显著。脯氨酸的含量随着处理时间的增加呈上升趋势,在72 h达到最大值,较0 h上升了246.77%,与对照存在显著差异(图4B)。
甜瓜种子萌发过程中的淀粉含量随NaCl和NaHCO3复合处理时间增加呈下降趋势(图5C),处理的72 h较0 h下降了67.42%,但此时与对照间的差异不显著。α-淀粉酶活性和β-淀粉酶活性都呈先下降后上升的趋势(图5A,图5B)。其中,α-淀粉酶活性在24 h时下降到最小值2.16 mg/(g?min),随后一直上升与对照的差异达到显著水平。β-淀粉酶活性在0~12 h下降,36 h后出现小幅度上升,48 h后基本保持稳定,且和对照的差异不显著。
3 讨论
盐胁迫会抑制植物种子萌发,同时会影响植物蛋白质合成、能量代谢、光合作用效率,从而造成养分吸收困难;严重的盐胁迫会终止植物光合作用,破坏细胞膜透性和渗透势平衡,最终导致植物死亡[18-21]。盐碱土中的盐分含量复杂,但目前关于甜瓜盐胁迫研究多为单盐胁迫,混合胁迫的相关研究较少。在本研究中,采用中性盐NaCl、碱性盐NaHCO3及两者复合溶液模拟盐胁迫,研究盐胁迫对甜瓜种子的发芽和生理特性的影响。
本研究中,在用50 mmol/L NaCl溶液处理一周后,甜瓜幼苗的胚轴长和鲜重都大于对照组,说明低浓度NaCl溶液(50 mmol/L)对种子的萌发具有一定的促进作用。100、150、200、250 mmol/L的NaCl溶液对甜瓜种子萌发和幼苗生长都有抑制作用,且随着浓度的提高和处理时间的增加而增加,这与张玉鑫[22]、杨宏伟等[23]的研究结果一致。NaHCO3溶液和NaCl、NaHCO3复合处理的甜瓜种子的发芽率、发芽势、发芽指数、活力指数,幼苗的胚根长、胚轴长、鲜重均随浓度增加呈下降的趋势,盐渍化明显抑制甜瓜种子的萌发,且影响程度与盐胁迫程度相关。
SOD、CAT、POD等抗氧化酶能保护膜结构,清除植物在胁迫环境下积累的活性氧,维持活性氧代谢平衡,从而增强植物抵抗逆境胁迫的能力[24-26]。植物在盐和干旱胁迫下,各种抗氧化酶同时或不同时地发挥作用来缓解氧化伤害。本研究结果表明SOD活性随着胁迫时间延长呈先上升、后下降、再上升、再下降的趋势。CAT和POD活性随着处理时间的增加呈升降升的趋势。SOD可以去除超氧阴离子,CAT是清除H2O2的主要酶之一[27]。SOD是清除活性氧的第一道防线[28]。在抗氧化酶体系中,SOD将毒性较强的O2转化为毒性较轻的H2O2,H2O2可被CAT和POD催化生成H2O和其他产物[29]。本研究中,短期盐胁迫诱导了SOD和CAT活性的上升,随着胁迫时间增加,抑制了SOD和CAT的活性。胁迫48 h后SOD和CAT的活性受到严重抑制,但此时POD的活性上升,在维持活性氧动态平衡起主要作用。这与董靖等[30]的研究结果一致。但也有研究表明,在盐胁迫下,随着胁迫浓度增加和时间的延长,SOD、CAT、POD的活性呈持续上升的趋势[31-32],这与本研究结果不同,原因可能是不同的植物对盐胁迫的响应机制不同,因此在保护酶清除活性氧时表现有所差异,最终导致SOD、CAT、POD的活性变化不同。
MDA含量可以作为盐胁迫对植物细胞膜透性影响的指标之一。在本研究中,甜瓜种子的MDA含量在处理的前12 h大幅度上升,在48 h上升到最大值,说明在处理的前48 h,盐胁迫导致了甜瓜种子膜脂过氧化加剧,随着SOD和CAT活性的增加,种子清除活性氧能力加强,膜脂过氧化程度逐步降低,这与朱金方等[33]的研究结果一致。盐胁迫下,植物会积累大量的游离脯氨酸和可溶性小分子物质,用以维持细胞正常的渗透压,减轻水分过度损失对细胞造成的伤害,为盐胁迫下植物体内水分的正常供应提供保障[34]。脯氨酸和可溶性糖是这类物质的代表,在植物抵抗逆境胁迫中具有重要作用,但其含量变化在不同的研究中差异较大。在本研究中,从48 h开始,处理组的脯氨酸含量高于清水对照组,说明48 h盐胁迫作用显著。随着处理时间的增加,脯氨酸含量不断增加。脯氨酸含量的增加是受到盐胁迫的表现,这与黄相玲等[35]、刘爱荣等[36]的研究结果一致。
种子在抵抗盐胁迫的过程中,可溶性糖作为光合产物、呼吸底物、植物的碳骨架和能量来源[37],种子可以消耗大量可溶性糖来维持生理正常机能[38],从而使可溶性糖含量显著降低。可溶性糖是细胞内重要的有机渗透调节物质,其含量的增加有利于提高植物的抗盐性。本研究中,随着盐胁迫时间增加甜瓜种子可溶性糖含量呈下降趋势。这与冰叶日中花和沙拐枣等盐生植物的相关研究结果一致[39-40]。也有研究表明,在受到胁迫时,可溶性糖含量呈持续上升的趋势[41-42]。高茜等[43]在盐胁迫对红砂种子的研究中发现,在盐胁迫下,红砂种子的可溶性糖含量呈先上升后下降的趋势。以上这些研究结果与本研究结果不同。本研究中可溶性糖含量下降的原因可能是甜瓜种子的可溶性糖对复合盐胁迫反应敏感。关于植物可溶性糖含量在盐胁迫下的变化还有待进一步的研究。
种子萌发初期贮藏淀粉开始水解,为早期幼苗形態建成和生长发育提供主要的物质和能量来源[44]。本研究中淀粉含量与对照差异不明显,盐胁迫对种子萌发过程中淀粉含量影响不大。但种子萌发前期,α-淀粉酶和β-淀粉酶的活性都低于对照,并呈现下降趋势,盐胁迫抑制了种子的α-淀粉酶和β-淀粉酶活性,这可能是淀粉含量变化不明显的原因。
参考文献
Fahad S, Hussain S, Matloob A, et al. Phytohormones and plant responses to salinity stress: a review[J]. Plant Growth Regulation, 2015, 75(2): 391-404.
Li J, Pu L, Han M, et al. Soil salinization research in China: advances and prospects[J]. Journal of Geographical Sciences, 2014, 24(5): 943-960.
Liang W, Ma X, Wan P, et al. Plant salt-tolerance mechanism: a review[J]. Biochemical and Biophysical Research Communications, 2018, 495(1): 286-291.
王佺珍, 刘 倩, 高娅妮, 等. 植物对盐碱胁迫的响应机制研究进展[J]. 生态学报, 2017, 37(16): 5565-5577.
Liang W, Cui W, Ma X, et al. Function of wheat Ta-UnP gene in enhancing salt tolerance in transgenic Arabidopsis and rice[J]. Biochemical and Biophysical Research Communications, 2014, 450(1): 794-801.
高青海, 郭远远, 吴 燕, 等. 盐胁迫下外源褪黑素和Ca2+对甜瓜幼苗的缓解效应[J]. 应用生态学报, 2017, 28(6): 1925-1931.
中华人民共和国农业部. 中国农业统计资料(2016)[M]. 北京: 中国农业出版社, 2017.
吴旭东, 黄忠阳, 李伟明, 等. 设施蔬菜次生盐渍化防控效果浅析[J]. 蔬菜, 2019(5): 58-61.
高玉红, 闫生辉, 邓黎黎. 不同盐胁迫对甜瓜幼苗根系和地上部生长发育的影响[J]. 江苏农业科学, 2019, 47(3): 120-123.
Zhang H, Zhang G, Lü X, et al. Salt tolerance during seed germination and early seedling stages of 12 halophytes[J]. Plant and Soil, 2015, 388(1-2): 229-241.
Koyro H W, Eisa S S. Effect of salinity on composition, viability and germination of seeds of Chenopodium quinoa Willd[J]. Plant and Soil, 2008, 302(1-2): 79-90.
Patel A D, Jadeja H, Pandey A N. Effect of salinization of soil on growth, water status and nutrient accumulation in seedlings of Acacia auriculiformis (Fabaceae)[J]. Journal of Plant Nutrition, 2010, 33(6): 914-932.
刘庆华, 雷逢进, 刘秀丽, 等. NaCl胁迫对山西主栽番茄品种种子萌发的影响[J]. 北方园艺, 2018(17): 59-63.
沈季雪, 蒋景龙. 不同浓度NaCl处理对6种黄瓜种子萌发的影响[J]. 江苏农业科学, 2017, 45(7): 111-115.
刘 鑫, 史庆华, 王硕硕, 等. 盐胁迫对不同西瓜品种幼苗生长和生理指标的影响[J]. 山东农业科学, 2018, 50(1): 55-59.
徐存东, 张 锐, 王荣荣, 等. 基于主成分分析的土壤盐渍化特征研究——以甘肃景泰川电力提灌灌区为例[J]. 中国农村水利水电, 2018(8): 9-14.
纪翠红, 熊太兰, 陈 安, 等. 新银辉甜瓜早春小拱棚栽培技术[J]. 中国西瓜甜瓜, 2004(6): 37-38.
Zhang Z, Li H, Qiao S, et al. Effect of salinity on seed germination, seedling growth, and physiological characteristics of Perilla frutescens[J]. Plant Biosystems, 2012, 146(2): 245-251.
韩志平, 张海霞, 刘 冲, 等. NaCl胁迫对黄花菜生长和生理特性的影响[J]. 西北植物学报, 2018, 38(9): 1700- 1706.
王旭明, 赵夏夏, 周鸿凯, 等. NaCl胁迫对不同耐盐性水稻某些生理特性和光合特性的影响[J]. 热带作物学报, 2019, 40(5): 882-890.
路 斌, 侯月敏, 李欣洋, 等. 野皂莢对NaCl胁迫的生理响应及耐盐性[J]. 应用生态学报, 2015, 26(11): 3293-3299.
张玉鑫. NaCl胁迫对甜瓜种子萌发及幼苗生理生化特性的影响[D]. 兰州: 甘肃农业大学, 2005.
杨宏伟, 刘文瑜, 沈宝云, 等. NaCl胁迫对藜麦种子萌发和幼苗生理特性的影响[J]. 草业学报, 2017, 26(8): 146- 153.
刘文瑜, 杨发荣, 黄 杰, 等. NaCl胁迫对藜麦幼苗生长和抗氧化酶活性的影响[J]. 西北植物学报, 2017, 37(9): 1797-1804.
周 艳, 刘慧英, 王 松, 等. 外源GSH对盐胁迫下番茄幼苗生长及抗逆生理指标的影响[J]. 西北植物学报, 2016, 36(3): 515-520.
常青山, 张利霞, 杨 伟, 等. 外源NO对NaCl胁迫下夏枯草幼苗抗氧化能力及光合特性的影响[J]. 草业学报, 2016, 25(7): 121-130.
Wang M, Zhao X, Xiao Z, et al. A wheat superoxide dismutase gene TaSOD2 enhances salt resistance through modulating redox homeostasis by promoting NADPH oxidase activity[J]. Plant Molecular Biology, 2016, 91(1-2): 115-130.
Alscher R G , Erturk N, Heath L S. Role of superoxide dismutases (SODs) in controlling oxidative stress in plants[J]. Journal of Experimental Botany, 2002, 53(372): 1331-1341.
朱鹏锦, 庞新华, 梁 春, 等. 低温胁迫对甘蔗幼苗活性氧代谢和抗氧化酶的影响[J]. 作物杂志, 2018(4): 131-137.
董 靖, 李红丽, 董 智, 等. H2S对NaCl胁迫下草木樨幼苗生理指标及抗氧化酶活性的影响[J]. 草业科学, 2018, 35(10): 2430-2437.
周 静, 徐 强, 张 婷. NaCl胁迫对不同品种辣椒幼苗生理生化特性的影响[J]. 西北农林科技大学学报(自然科学版), 2015, 43(2): 120-125
李亚萍, 苏 剑, 周发明, 等. 干旱和盐胁迫对金花菜种子萌发及幼苗抗氧化保护酶活性的影响[J]. 草学, 2019(3): 24-35.
朱金方, 刘京涛, 陆兆华, 等. 盐胁迫对中国柽柳幼苗生理特性的影响[J]. 生态学报, 2015, 35(15): 5140-5146.
Mi?i? D, ?iler B, ?ivkovi? J N, et al. Contribution of inorganic cations and organic compounds to osmotic adjustment in root cultures of two Centaurium species differing in tolerance to salt stress[J]. Plant Cell, Tissue and Organ Culture (PCTOC), 2012, 108(3): 389-400.
黄相玲, 林妃妃, 张明月, 等. 盐胁迫对小叶榄仁幼苗生长和渗透调节物质含量的影响[J]. 南方农业学报, 2018, 49(7): 1364-1369.
劉爱荣, 张远兵, 钟泽华, 等. 盐胁迫对彩叶草生长和渗透调节物质积累的影响[J]. 草业学报, 2013, 22(2): 211- 218.
周 妍. 盐胁迫对大豆种子萌发、离子平衡及可溶性糖含量影响的研究[D]. 长春: 东北师范大学, 2014.
赵可夫, 范 海. 盐胁迫下真盐生植物与泌盐植物的渗透调节物质及其贡献的比较研究[J]. 应用与环境生物学报, 2000(2): 99-105.
Atzori G, de Vos V C, van Rijsselberghe M, et al. Effects of increased seawater salinity irrigation on growth and quality of the edible halophyte Mesembryanthemum crystallinum L. under field conditions[J]. Agricultural Water Management, 2017, 187: 37-46.
王文银, 高小刚, 牟 静, 等. 盐胁迫对沙拐枣光合生理特性的影响[J]. 西北植物学报, 2017, 37(9): 1805-1812.
江绪文, 李贺勤, 王建华. 盐胁迫下黄芩种子萌发及幼苗对外源抗坏血酸的生理响应[J]. 植物生理学报, 2015, 51(2): 166-170.
李小安. 低温胁迫对不同扁蓿豆种子内游离脯氨酸和可溶性糖含量的影响[J]. 青海科技, 2011, 18(2): 40-42.
高 茜, 李 毅, 苏世平, 等. 盐胁迫对红砂(Reaumuria soongorica)种子吸胀过程中生理特性的影响[J]. 中国沙漠, 2014, 34(1): 83-87.
王 琳, 段璋玲. Hg2+胁迫对小麦幼苗生长及其淀粉酶等同工酶活性的影响[J]. 河南农业科学, 2010(11): 9-13.
