酒渣鼻患者鼻部皮肤蠕形螨寄生对局部微生态的影响
2020-06-18钟彩梅何思华赵伟峰钟建能周美凤邓裕华
钟彩梅 何思华 赵伟峰 钟建能 周美凤 邓裕华
1广东省佛山市顺德区慢性病防治中心皮肤科528399;2南方医科大学公共卫生学院预防医学实验教学中心,广州510515
蠕形螨(Demodex spp.)常寄生于皮脂腺分泌旺盛的皮肤组织[1],毛囊蠕形螨(D.folliculorum)较为常见,常寄生在脸颊、鼻唇沟等处[2]及皮脂腺漏斗处的角质层或其碎片中,可引起红斑、脱屑等症状;皮脂腺蠕形螨(D.brevis)则多存在于皮脂腺腺体和导管中,躯干常见,容易导致脓疱、丘疹等[3]。人体皮肤表面含有大量的微生物,微生物之间相互影响、制约,与人体免疫系统共同构建一道天然的防御屏障[4]。蠕形螨是否致病与多种因素相关,酒渣鼻是目前所知的与蠕形螨密切相关的一种皮肤疾病[5]。目前,蠕形螨引起皮肤炎症的发病机制尚不明确。作为病原微生物的载体,蠕形螨在皮肤表面活动,可携带一些病原体,如葡萄球菌、链球菌,通过细菌超抗原或直接刺激人体免疫系统产生炎症反应而发挥致病作用[6]。我们选择酒渣鼻患者为研究对象,采集鼻部皮肤的微生物样品,通过宏基因组测序和生物信息学分析,探讨蠕形螨的寄生对局部皮肤微生态的影响。
对象与方法
一、研究对象
2017 年5 月至2019 年6 月于佛山市顺德区慢性病防治中心皮肤科就诊的酒渣鼻患者。纳入标准:①符合酒渣鼻的诊断标准[7];②患者签署知情同意书;③入组前2 ~3 周内没有局部外用过抗生素、维A 酸类药物及性激素、糖皮质激素等药物治疗;④非妊娠期及哺乳期;⑤无高血脂、肝肾功能异常、痤疮、接触性皮炎等疾病。招募面部健康志愿者为健康对照,纳入标准:①面部无炎症性表现(即红、肿、热、痛等);②签署知情同意书;③无吸烟史,入组前2 ~3 周内脸部未使用过抗生素、维A 酸类药物及糖皮质激素类药物等;④非妊娠期及哺乳期;⑤无高血脂、肝肾功能异常等系统性疾病。本研究经佛山市顺德区慢性病防治中心伦理委员会批准。
纳入酒渣鼻患者与健康对照各14例。酒渣鼻患者男5例,女9例,年龄(29.79±2.53)岁。健康对照组男7 例,女7 例,年龄(31.21±1.33)岁,两组年龄、性别差异无统计学意义(P >0.05)。
依据酒渣鼻的诊断标准[7],进一步将疾病组分为红斑期(早期)和丘疹脓疱期(中期)。早期8例,男3例,女5例;中期6例,男2例,女4例。
二、鼻部皮肤微生物样品采集
采集受试者鼻部皮肤微生物时,夹住MF 滤膜(型号REF:HAWP01300,直径0.45 μm,美国Merck Millipore 公司)紧贴鼻唇沟和鼻翼皮肤表面来回摩擦5 ~10次。将MF滤膜放入含有1 μl蛋白酶K和300 μl组织和细胞裂解液(DNA、RNA 纯化试剂盒,英国Epicentre 公司)的EP 管中。取样过程注意无菌操作。样品保存于-80 ℃冰箱待用。两组另设3 管阴性对照,分别为未接触皮肤的MF 滤膜、1 μl蛋白酶K、300 μl组织和细胞裂解液的EP管。
三、DNA提取及宏基因组测序
皮肤微生物DNA 的提取按DNA、RNA 纯化试剂盒(英国Epicentre 公司)说明书操作。通过超声碎裂仪(比利时Diagenode公司)将总量约100 ng 的DNA碎裂成长度为300 ~400 bp的DNA片段;通过DNA 文库纯化试剂盒(美国Kapa Biosystems 公司)构建DNA 测序文库。使用HiSeq 2500 测序仪(美国Illumina 公司)对DNA 文库进行双端测序,保存测序的原始数据并进行数据转换。测序由中山大学中山眼科中心魏来教授课题组完成。
四、数据分析
1. 微生物数据:使用质量控制软件(FastQC、Cutadapt、Fastx、PrinSeq)对各样本数据进行质控分析,在得到的高质量数据中去除人的数据,得到不含宿主数据的高质量微生物数据。
2. 微生物相对含量:采用序列比对软件HiSAT2(v2.0.1)在通用微生物数据库中比对该高质量微生物数据,对成功匹配的微生物基因组进行物种注释。采用Bedtools(v2.19.1)软件计算蠕形螨基因组覆盖度,统计出现蠕形螨基因组片段的样品总数占所有样品数的百分比,即蠕形螨基因组片段出现率。采用ROC分析基因组覆盖度与基因组片段出现率的推荐截点。当蠕形螨的覆盖率>3%和出现概率>2%时,可认为提取到蠕形螨DNA。
由于蠕形螨基因组的大小与其它微生物,如细菌、真菌,基因组的大小存在明显差异,故采用微生物reads 数占总微生物reads 数的百分比反映微生物的相对含量。基于各微生物构成比,分析蠕形螨与细菌、真菌等其他微生物群落的相关性。
3.皮肤微生物群落的多样性:采用Mothur软件计算Shannon 指数(Shannon index)以评估微生物α多样性,衡量微生物种类多样性。采用R 软件(v3.4.3)分析基于菌种相对丰度的主成分分析(principal component analysis,PCA),以PC1 的数值评估β 多样性,间接反映组间物种相对丰度的差异。
4.酒渣鼻患者与健康对照组鼻部皮肤微生物群落的代谢途径:通过微生物京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)重建代谢途径,通过HMP Unified Metabolic Analysis Network(HUMAnN2)软件分析各种代谢途径占微生物总体的代谢途径的相对丰度,并以此反映代谢途径的活跃程度。
五、统计学分析
采用SPSS 17.0 软件处理,计量资料符合正态分布,采用±s 表示及两独立样本t 检验。采用R软件(v3.4.3,www.r-project.org)进行Pearson 相关性分析,|r|0 ~0.09为无相关性,0.1 ~<0.3为弱相关,0.3 ~<0.5 为中等相关,0.5 ~<1.0 为强相关。P <0.05为差异有统计学意义。
结 果
一、鼻部皮肤微生物数据
健康组单样本总测序reads 数目为(42.2 ~67.2)M,其中大部分数据来源于宿主人,每个样品可获得(3.2 ~13.4)M 高质量微生物reads,占总测序reads 数目的7.6%~19.9%。酒渣鼻组单样本总测序reads数目为(28.1 ~70.4)M,大部分数据亦来源于宿主人,每个样品可获得(2.4 ~9.5)M高质量微生物reads,占总测序reads 数目的8.5% ~13.5%。两组的6 个阴性对照的样品数据均为重复、无效或低质量的数据,且未获得足够可用于分析的微生物数据,未做统计。
二、鼻部皮肤含有蠕形螨基因组片段数据
蠕形螨基因组中共531 个基因组片段,其中509 个基因组片段的出现概率为2.7% ~100%,覆盖度为0.07%~96.31%(图1)。结合ROC 曲线(图2),满足覆盖率>3%和出现概率>2%的基因组片段共15个(表1)。酒渣鼻组蠕形螨reads数构成比为1.647% ± 0.389%,健康组为0.448% ± 0.089%,酒渣鼻组高于健康对照组(t=2.92,P=0.007)。见图3。
总体相关性分析结果显示,蠕形螨与细菌的reads 数构成比呈负相关(r=-0.95,P <0.001),与真菌和古生菌呈正相关(r = 0.76、0.94,均P <0.001),而与病毒不相关(r = 0.31,P = 0.456),见图4。

图1 标本检测出的蠕形螨基因组片段的出现概率与覆盖度 检测到531 个蠕形螨基因组基因组片段,其中509 个片段的出现概率为2.7%~100%,覆盖度为0.07%~96.31% 图2 采用ROC曲线分析蠕形螨基因组DNA片段的出现概率和覆盖度 图中数字分别表示推荐截点(括号外)、敏感度和特异度(括号内),曲线下面积(AUC)越大,推荐截点的可信度越高

表1 覆盖率>3%且出现概率>2%的蠕形螨基因组片段

图3 宏基因组测序分析标本中蠕形螨的相对含量 酒渣鼻组高于健康组(P <0.05)
三、鼻部蠕形螨与皮肤细菌和真菌群落间的相对关系
酒渣鼻组鼻部皮肤的细菌群落Shannon 指数(0.91 ± 0.17)显著高于健康组(0.47 ± 0.12,t =2.17,P=0.041),两组间α 多样性差异有统计学意义。PCA 分析显示,两组间鼻部皮肤细菌相对丰度的主成分为痤疮丙酸杆菌(Propionibacterium acnes,P. acnes),酒渣鼻组相对丰度(78.13%±5.16%)低于健康组(91.58% ± 2.05%,t =2.42,P=0.023)。细菌群落β 多样性酒渣鼻组PC1为0.141±0.391,健康组为-0.787±0.087,两组差异亦有统计学意义(t = 2.32,P = 0.029)(图5)。通过相关性分析发现,蠕形螨与大部分细菌,如表皮葡萄球菌、金黄色葡萄球菌和绿脓假单胞菌(出现概率>66.7%)呈中等或强正相关(均P <0.05),仅与一种细菌P. acnes 呈中等负相关(r =-0.49,P =0.010)。见图6、7。
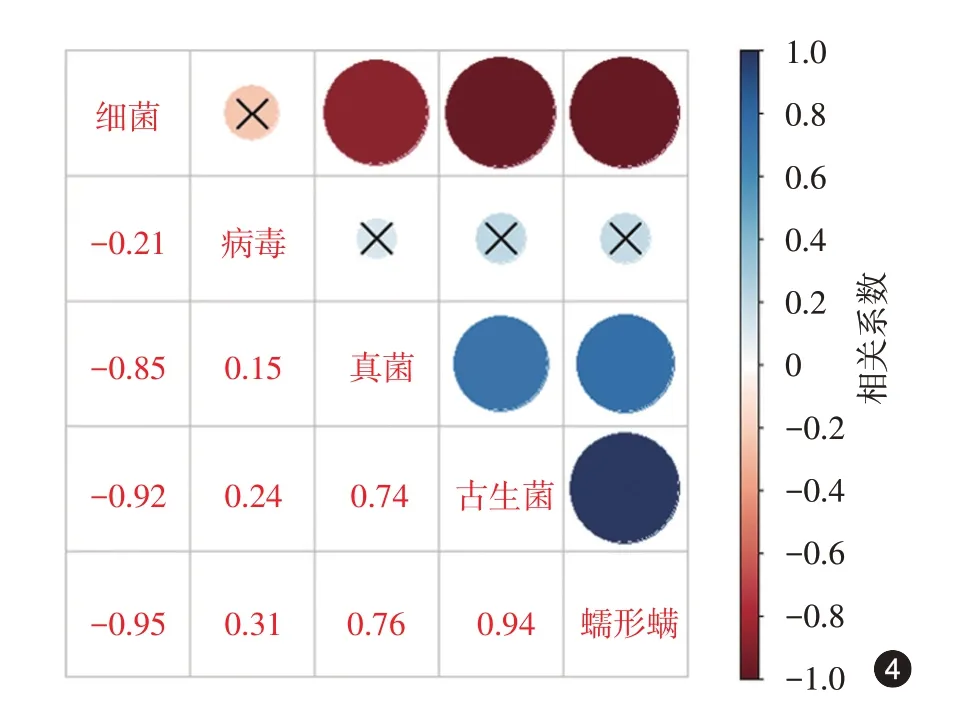
图4 酒渣鼻患者鼻部皮肤各种微生物之间总体相关性分析图中数字为Pearson 相关系数,以各微生物构成比计算,圆形颜色深度表示相关系数大小。×表示相关性无统计学意义,P >0.05
酒渣鼻组鼻部皮肤的真菌群落Shannon 指数(1.261±0.045)高于健康对照组(0.549±0.071,t=8.48,P <0.001),两组间α 多样性差异有统计学意义。PCA分析显示,酒渣鼻组和健康组间鼻部皮肤真菌的主成分分析无显著差异,其中主要以真菌球形马拉色菌(Malassezia globosa)为主,该菌在酒渣鼻组相对丰度(84.84% ± 1.27%)与健康对照组(83.16% ± 1.82%)间差异无统计学意义(t = 1.35,P=0.172)。真菌群落的β 多样性酒渣鼻组PC1为-0.160 ± 0.325,健康组为0.136 ± 0.184,两组差异无统计学意义(t=0.82,P=0.416)(图5)。相关性分析结果示,相对含量低的真菌和大部分含量较高的真菌相对丰度与蠕形螨相对含量无相关性或呈弱中负相关(均P <0.05,),只有球形马拉色菌、黄曲霉菌(Aspergillus flavus)和链孢霉菌(Neurospora crassa)与蠕形螨呈中度或强正相关(r=0.39、0.43、0.51,均P <0.05)。见图6。这3 种真菌的相对丰度差异有统计学意义(F=14.88,P <0.001),球形马拉色菌最高(图7)。球形马拉色菌相对丰度与蠕形螨相对含量呈中等正相关(r =0.39,P=0.04,图8)。
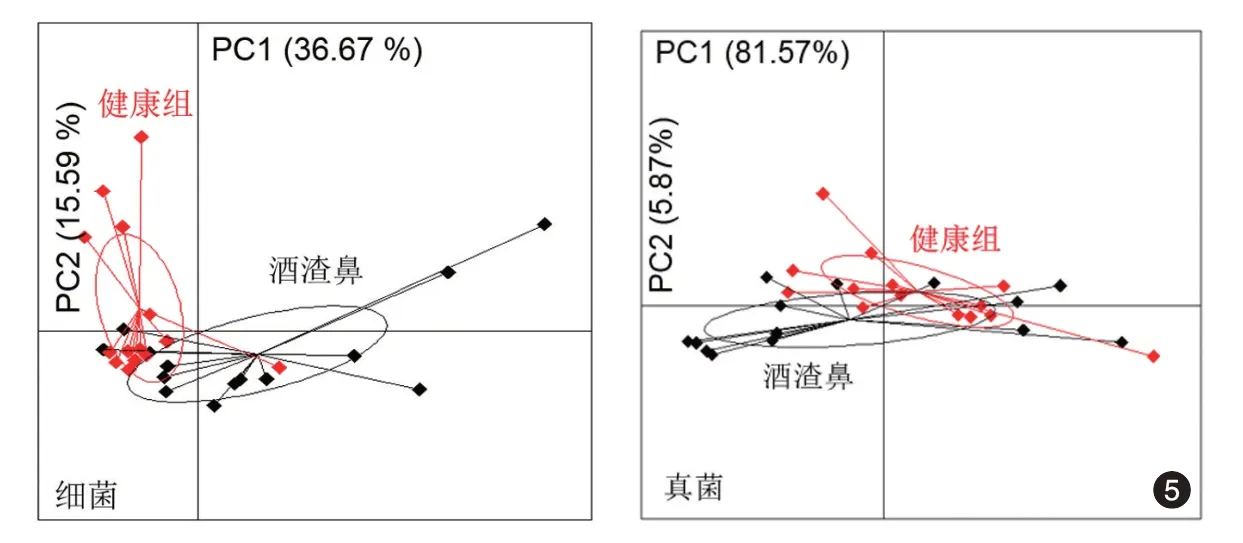
图5 主成分分析法比较健康组和酒渣鼻组群落的种类及其相对丰度差异红色椭圆表示健康对照组,黑色椭圆表示酒渣鼻组,两椭圆重叠部分越多表示差异越小
四、酒渣鼻组与健康对照组间鼻部皮肤微生物群落的代谢途径存在差异
通过比较、分析微生物群落的代谢途径,结果示,酒渣鼻组微生物群落的部分代谢途径相对丰度(0.000 16%±0.000 017%)低于健康组(0.000 27%±0.000 022%,t = 15.11,P <0.001),其中27 个代谢途径丰度差异明显(酒渣鼻组:0.000 23% ±0.000 008%,健康组:0.000 34% ± 0.000 011%,t =7.66,P <0.001),主要表现在DNA 核苷酸、蛋白氨基酸、叶酸和辅酶A的生物合成减弱。见图9。
五、早中期酒渣鼻患者鼻部蠕形螨与细菌和真菌群落结构的关系
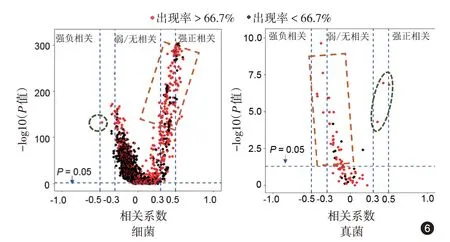
图6 蠕形螨相对含量和各种细菌、真菌相对丰度之间的相关性 6A:橙色方形虚线框内为多数出现率较高的细菌,与蠕形螨相对含量呈中等或强正相关,仅痤疮丙酸杆菌(绿色圆形虚线框)与之呈中等负相关;6B:相对含量低的真菌和大部分含量较高的真菌与蠕形螨相对含量呈弱、中负相关(橙色方形虚线框)或无相关性,只有球形马拉色菌、黄曲霉和链孢霉(绿色椭圆形虚线框)与蠕形螨呈中度或强正相关
中期酒渣鼻患者蠕形螨相对含量(3.080% ±0.427%)高于早期患者(0.573%±0.099%,t=6.56,P <0.001)。尽管如此,早期患者的细菌和真菌群落Shannon 指数(0.665±0.225、1.288±0.073)与中期患者(0.831 ± 0.269、1.225 ± 0.041)差异均无统计学意义(t=0.76、0.68,均P >0.05),细菌和真菌群落的α 多样性均未受病情影响,PCA 分析显示,早中期患者细菌、真菌β多样性差异有统计学意义(t=2.23、2.41,均P <0.05,图10)。中期患者微生物群落代谢途径的相对丰度亦显著低于早期(t =5.78,P <0.001,图11)。
讨 论
蠕形螨具有严格的宿主特异性,寄生在人体皮肤的有2种,毛囊蠕形螨和皮脂腺蠕形螨。我们将测序数据比对到毛囊蠕形螨基因组上,得到满足碱基覆盖率>3%和出现概率>2%的基因组片段15 个,因此可以认为我们在鼻部皮肤上提取到了蠕形螨DNA,它们可能来源于蠕形螨基因组DNA或其代谢产物、外泌体DNA。由于两种蠕形螨的亲缘关系较近[1],故本研究中所得到的蠕形螨数据应考虑为两种蠕形螨数据的总和。
人体皮肤表面含有大量的微生物,研究显示每平方米可达1×1011个微生物[8-9],微生物之间相互影响、制约,维持着皮肤的健康。本研究分析了蠕形螨与细菌、真菌、古生菌相对含量的相关性发现,皮肤细菌与蠕形螨呈负相关,而真菌、古生菌与其呈正相关,提示微生物之间可能存在相互影响,相互制约。由于古生菌是皮肤正常菌群[10],虽然也与蠕形螨呈正相关,但目前未有该菌与蠕形螨相互影响、相互促进的研究,我们亦不甚了解这两者间的内在关系。
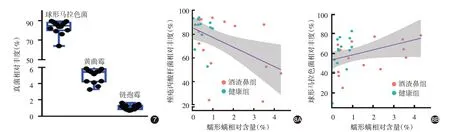
图7 3种与蠕形螨正相关的真菌在鼻部皮肤上的相对丰度 球形马拉色菌相对丰度最高 图8 蠕形螨相对含量与菌种相对丰度的相关性 8A:与痤疮丙酸杆菌相对丰度呈负相关;8B:与球形马拉色菌相对丰度呈正相关
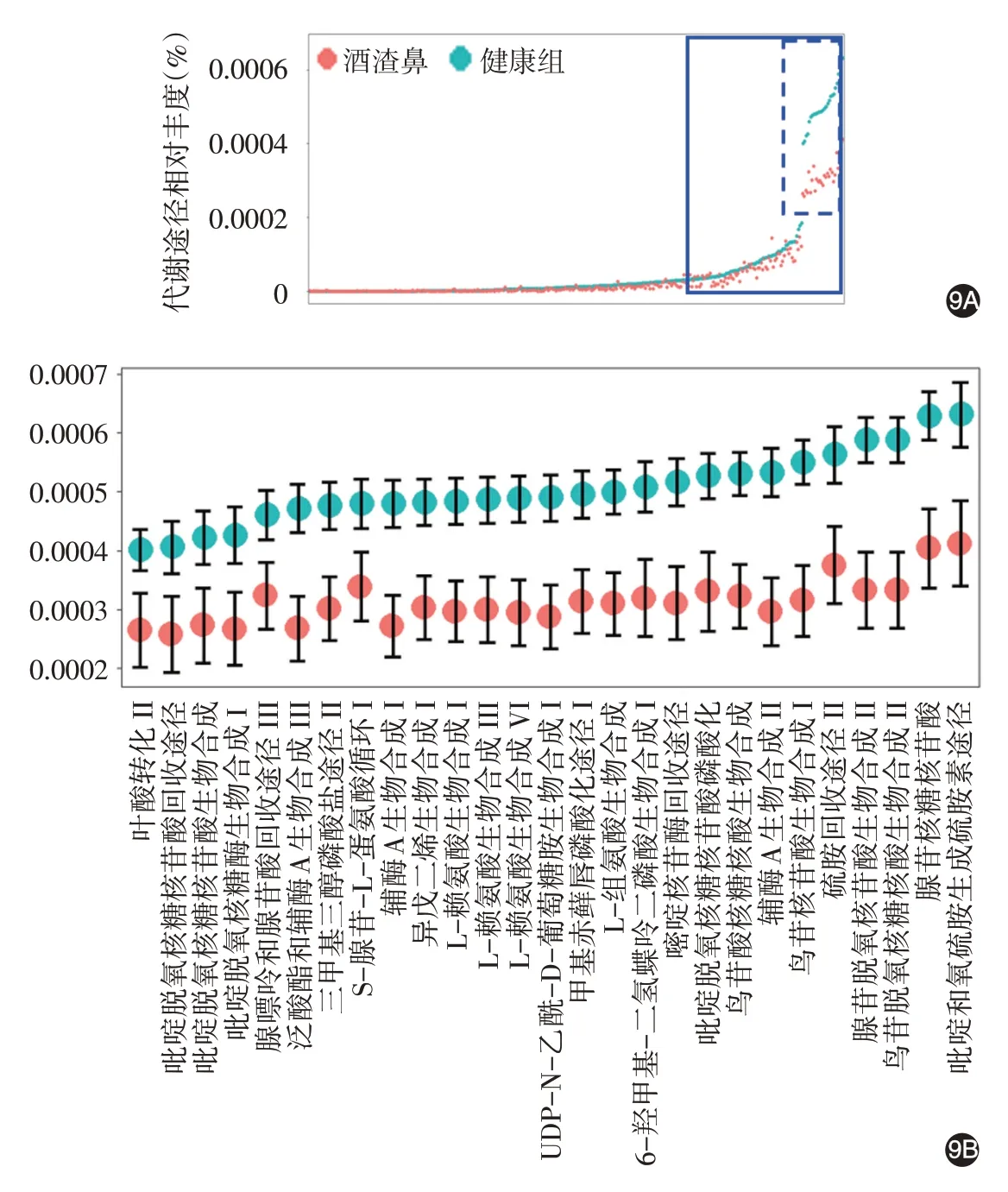
图9 酒渣鼻组与健康对照组皮肤微生物群落代谢途径的差异 9A:实线框内的代谢途径,酒渣鼻组代谢途径的活跃程度明显低于健康对照组;9B:为9A中虚线框部分,27个代谢途径丰度差异明显

图10 主成分分析法比较早期和中期酒渣鼻组细菌、真菌群落的种类及其相对丰度差异 红色椭圆表示健康组,黑色椭圆表示酒渣鼻组,两椭圆重叠部分越多表示差异越小

图11 早、中期酒渣鼻患者微生物群落代谢途径的差异 中期患者微生物群落代谢途径的相对丰度低于早期
我们对比了酒渣鼻患者与健康对照间鼻部皮肤微生态结构,发现酒渣鼻患者皮肤组织的细菌α多样性增加,β多样性也发生了改变,提示不仅细菌的种类发生了改变,其含量也发生了改变。数据显示,大部分细菌含量与蠕形螨呈中度或强正相关,仅与P. acnes 呈负相关。P. acnes 是皮肤中最主要的且含量最多的一种细菌,如发生疾病或者受到外界因素的影响,其在皮肤表面的含量也可能最容易受到影响。P. acnes 的相对丰度随蠕形螨的含量增多而减少,提示P.acnes可能对皮肤蠕形螨的寄生产生一定的抑制作用。P. acnes 可产生丙酸,调节皮肤表面的酸碱度,影响蠕形螨的生存[11-12]。此外,P.acnes 也可竞争性地消耗皮脂中的脂肪酸,使蠕形螨不能获取足够的脂肪酸而生长受到一定的抑制。酒渣鼻患者与健康对照皮肤组织间真菌的α 多样性改变,β 多样性无差异,提示真菌的种类发生了改变。皮肤上大部分真菌的含量和蠕形螨不相关,虽有少数几种与蠕形螨呈负相关关系,但其平均相对丰度低于1%,因此尚不能确定是否能抑制蠕形螨寄生。鼻部皮肤的主要真菌为球形马拉色菌,其含量与蠕形螨呈正相关,提示球形马拉色菌可能对蠕形螨的寄生有促进作用。球形马拉色菌是一种嗜脂性真菌,依赖皮质中的磷脂、脂肪酸[13],产生的一些代谢产物可能给蠕形螨提供了所需的食物来源。尽管如此,P.acnes和球形马拉色菌与蠕形螨之间的相互关系需要进一步研究。
皮肤疾病的发生和发展能在一定程度上破坏局部皮肤组织的微生态结构[14-15],已有研究证实,酒渣鼻的病情与蠕形螨密切相关[5]。故我们还初步探讨了不同严重程度的酒渣鼻与蠕形螨的关系,及蠕形螨与皮肤微生物群落之间的相互关系。结果显示,随着酒渣鼻病情加重,蠕形螨的相对丰度也随之增加,但皮肤细菌和真菌的种类未发生显著改变,一方面可能由于酒渣鼻组再分期后样本量较少,另一方面可能由于疾病早期和中期的分界不明显,在临床判断过程中分类有误所致。然而从PCA结果显示,细菌和真菌的相对丰度发生了变化,疾病中期微生物代谢途径亦显著低于早期,这表明酒渣鼻病情对鼻部皮肤微生态存在一定程度的影响。但由于我们收集的病例无晚期酒渣鼻患者,蠕形螨在其鼻部皮肤的含量、微生物群落结构及其代谢途径的变化尚需进一步研究。
综上所述,我们认为酒渣鼻的发生发展与蠕形螨的寄生和皮肤局部微生态的改变有关。但蠕形螨的寄生,是疾病破坏了皮肤微生物群落的结果,还是作为原因,破坏了皮肤微生物群落致使皮肤炎症的发生还不明确。本研究仅从健康与疾病的角度探讨了蠕形螨的寄生对皮肤微生态结构的影响,并没有探讨健康皮肤人群中蠕形螨的寄生是如何影响正常皮肤微生态环境的;同时,本文的研究对象仅限于酒渣鼻患者,且病例数较少。因此,进一步收集更多的皮肤微生物样品分析不同年龄阶段、不同疾病条件下蠕形螨与皮肤微生物之间的相互关系是我们下一步的研究方向。
志谢 中山大学中山眼科中心魏来教授提供实验平台及高通量测序平台
利益冲突 所有作者均声明不存在利益冲突
