侗族传统发酵酸肉中乳酸菌的筛选、发酵特性及安全性分析
2020-06-17高熳熳焦新雅张志胜饶伟丽程书梅
高熳熳,焦新雅,张志胜,淑 英,饶伟丽,程书梅
(河北农业大学食品科技学院,河北保定 071001)
发酵肉制品是以各类畜禽肉为原料,采用微生物发酵技术,原料肉经特定的微生物作用,产酸使pH下降,并经过低温失水使产品的AW降低,从而延长产品贮藏期的一大类肉制品[1-2]。近年来,发酵肉制品因其具有独特的感官性质和丰富的营养价值,并且有利于消化吸收,货架期较长等优点,越来越受广大人民的欢迎。但由于其生产周期长,工业化生产的规模受到限制,价格昂贵,不能满足日益增长的市场需求[3]。因此,筛选用于发酵肉制品的乳酸菌株,对于缩短发酵肉制品生产周期,实现商业化具有重要意义。
侗族是中国少数民族之一,其制作的传统发酵酸肉营养丰富,风味独特,保存期长[4-5]。而乳酸菌在其自然发酵过程中发挥了重要作用,一方面它能将原料中的碳水化合物分解为乳酸,使产品的pH下降,有效抑制杂菌的生长[6-8];另一方面,它赋予了产品特有的风味、色泽和质地,因此其常被筛选出来用作肉品发酵剂[9]。例如章德法等人在侗族酸肉中筛选出两株戊糖片球菌,一株德氏乳杆菌和一株米酒乳杆菌[10];董竞等人在侗族酸肉中筛选出两株肉葡萄球菌[4]。而从侗族酸肉中筛选出香肠乳杆菌较为少见。
乳酸菌是益生菌中应用最为广泛的菌种之一。大量文献证明,使用乳酸菌进行发酵是可行的,安全的。但也有少量研究结果表明能够从心内膜炎患者[11-12]、败血症[13-14]、肝脓肿[15-16]和尿路感染病人体内分离出乳酸菌,因此对新筛选出的可作为益生菌的乳酸菌进行安全性的评价是必要的,尤其是对于食品用的菌株[17]。
在益生菌的安全性评价中,一个非常重要的方面就是耐药性,研究认为乳酸菌中绝大多数的抗生素耐药性是一种非转移特性,然而与结合质粒和转座子相关的耐药性因子有可能引起耐药性在肠道菌群之间相互转移。因此,对于食品用乳酸菌进行质粒检测可有效减低菌株作为耐药性基因贮存宿主的风险;溶血现象的发生可能是由于溶血性细菌引起的,乳酸菌有可能是潜在的溶血性细菌,导致败血症的发生。
本试验从侗族传统发酵酸肉中分离纯化得到乳酸菌菌株,并从中选出适合发酵肉类生产的优良菌种,进行细胞形态学观察以及16S rRNA遗传学鉴定,对其发酵特性和生长特性以及其安全性进行评估,以期为新型健康发酵肉制品的研究和开发提供优质菌种资源[18]。
1 材料与方法
1.1 材料与仪器
侗族传统发酵酸肉 保定大卖园超市(河北农业大学店);31516KC4细菌基因组DNA提取试剂盒 美国AXYGEN公司;RR001EX Taq酶、BK6501AdNTP、AB5401A10×EX Taq Buffer 大连TaKaRa公司;引物 生工生物工程上海(股份)有限公司;DL2000 Marker 北京博迈德生物技术有限公司;头孢噻肟(Cefotaxime)、头孢氨苄(Cephalexin)、氨卡西林(Ampicillin)、卡那霉素(Kanamycin)、庆大霉素(Gentamycin)、新霉素(Neomycin)、链霉素(Streptomycin)、四环素(Tetracycline)、红霉素(Erythromycin)、万古霉素(Vancomycin)、环丙沙星(Ciprofloxacin)、左氧氟沙星(Evofloxacin)、阿莫西林(Amoxicillin) 深圳康泰生物制品股份有限公司;血平板 广东环凯生物科技有限公司;质粒提取试剂盒(Easy Pure Plasmid Miniprep Kit) 北京全式金生物技术有限公司。
SW-CJ-1FD洁净工作台 苏州安泰空气技术有限公司;LD5-2A低速离心机 北京京立离心机有限公司;FA2204B电子天平 上海天美天平仪器有限公司;1-15PK高速离心机 德国西格玛公司;XZQ-X300数显振荡培养箱 常州中捷实验仪器制造有限公司;Nikon YS100显微镜 尼康映像仪器销售(中国)有限公司;JY04S-3C凝胶成像仪、JY300C电泳系统 北京君意东方电泳设备有限公司;MG96+PCR仪 杭州朗基科学仪器有限公司;625-0020 3730XL 测序仪 Applied Biosystems。
1.2 实验方法
1.2.1 培养基配制 MRS培养基、产粘性培养基、耐盐性试验培养基、耐硝性试验培养基、产H2S培养基、葡萄糖产气培养基、氨基酸脱羧酶培养基、硝酸盐还原培养基、产氨培养基、乳酸纸层析试剂、石蕊牛乳培养基、V-P反应培养基参考文献[18-21]进行配制。
1.2.2 样品处理 在无菌条件下取侗族酸肉样品25 g,切碎,加入到225 mL的无菌生理盐水中,振荡均匀备用。取1.0 mL加至到9.0 mL无菌生理盐水中进行梯度稀释。
1.2.3 乳酸菌的分离 选取合适的稀释度,涂布于含3% CaCO3的MRS固体培养基上,凝固后置于37 ℃培养。挑取产生碳酸钙溶解圈的单菌落反复划线,直至获得纯的菌株。对纯菌株进行革兰氏染色、菌体形态观察、过氧化氢酶活性测定,凡是革兰氏染色阳性、过氧化氢酶试验阴性的菌株初步确定为乳酸菌[22-23]。
1.2.4 优良乳酸菌的筛选 对分离得到的乳酸菌按照以下方法进行筛选:产黏性试验、耐盐性试验、耐硝性试验、产H2S试验、发酵葡萄糖产气试验、氨基酸脱羧酶试验、硝酸盐还原能力试验、产氨试验、乳酸的纸层析分析、石蕊牛乳试验、V-P试验、产酸性试验、抑菌试验、蛋白酶活性检测和脂肪酶活性检测参考湛剑龙等[24-27]。
1.2.5 乳酸菌的鉴定
1.2.5.1 形态特征观察 将纯化好的菌株利用平板划线的方法接种于MRS培养基平板上,在37 ℃条件下恒温培养,观察并记录菌株的菌落形态。对菌株进行革兰氏染色,在光学显微镜下油镜观察并记录待测菌株的菌体形态特征[28]。
1.2.5.2 生化鉴定 将分离得到的菌株于MRS液体培养基中活化后,按照《常见细菌系统鉴定手册》[29]和《伯杰细菌鉴定手册》[30]等文献上的试验方法接入生化鉴定管,18~72 h后观察记录现象。
1.2.5.3 分子生物学鉴定 DNA的提取:分别用细菌基因组DNA提取试剂盒对分离纯化的细菌进行提取,提取步骤按试剂盒说明书进行。PCR扩增及测序:PCR反应体系(50 μL):10×Ex Taq buffer 5.0 μL,2.5 mmol/L dNTP Mix 4.0 μL,10p Primer 1 2.0 μL,10p Primer 22.0 μL,5u Ex Taq 0.5 μL,Template 2.0 μL,ddH2O 36.5 μL;反应条件:94 ℃预变性3 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸90 s(24次循环)。PCR扩增产物使用1%琼脂糖凝胶电泳检测,120 V,20 min,恒压对PCR产物进行电泳,并在凝胶成像系统下观察,并照相分析。将PCR产物送生工生物工程(上海)股份有限公司进行纯化和测序。
序列分析:测序结果在NCBI利用Blast做相似性比对分析;另外,用ContigExpress软件对序列进行拼接及人工校正,生成Fasta格式文件,利用Mega 7软件按照Neighbor-Joining法聚类构建系统发育树。对得到的菌株进行16S rRNA分子鉴定,鉴定委托生工生物工程(上海)有限公司完成。
1.2.6 菌株产酸能力和生长曲线的测定 将分离菌株活化后接种于MRS液体培养基中,以空白培养基作对照,每隔2 h用分光光度计测定600 nm波长下各菌株菌液的OD值,并用酸度计测定pH。其OD值大小表示菌株的生长情况,pH可反应出菌株的产酸能力。
1.2.7 菌株安全性分析
1.2.7.1 抗生素敏感性试验 本实验采用药敏纸片(直径6.0 mm)琼脂扩散法[31],使用涡旋混匀器混匀实验菌液,各取100 μL菌液涂布于MRS固体培养基上,待菌液被培养基完全吸收后,将药敏纸片放于培养基上,静置15 min后,倒置放于37 ℃培养箱中培养20 h,测量并记录各药敏纸片的抑菌圈直径大小。结果判定参照《CLSI 抗菌药物敏感性试验标准》。
1.2.7.2 质粒提取 参照质粒提取试剂盒使用说明[32]。
1.2.7.3 溶血试验 将活化好的实验菌液划线于血平板培养基上,倒置放于37 ℃培养箱中培养24 h,观察是否出现溶血现象[33]。
1.2.8 三株菌的拮抗试验 将S26菌株在MRS固体培养基上划一直线接菌,待长出菌落后,沿菌落边缘(不接触)从垂直方向接S42,37 ℃条件下培养24 h,观察S26对于S42的抑制效果。同理,检测S26对S53的抑制效果[34]。
1.3 数据处理
每个实验重复3次,取平均值。采用Excel 2017软件进行绘图和数据处理,SPSS 19.0软件进行差异显著性分析。
2 结果与分析
2.1 乳酸菌的初步分离纯化
采用CaCO3-MRS固体培养基进行乳酸菌的初步筛选,挑取具有明显溶钙圈的菌落进行反复纯化,在经革兰染色以及过氧化氢酶活性测定后,得到G+、过氧化氢酶试验阴性的疑似乳酸菌共54株,分别命名为S1~S54。
2.2 优良乳酸菌株的筛选结果
对初筛得到的54株乳酸菌按照以下标准进行复筛:能够耐受6%的NaCl和150 mg/kg NaNO2、不产粘液、发酵葡萄糖不产气、不产H2S、不产氨、不具有氨基酸脱羧酶活性,产酸速度快,发酵碳水化合物产物主要为乳酸,能抑制大肠杆菌和金黄色葡萄球菌[26]等,其结果见表1。

表1 乳酸菌主要发酵特性阳性菌数Table 1 Number of positive fermentation characteristics of lactic acid bacteria
由表1可知,绝大部分菌株能耐受高浓度的NaCl和亚硝酸盐;只有一株菌产粘液(1.85%);大部分能使牛奶酸凝(88%);54株乳酸菌都产酸,发酵葡萄糖不产气,不生成H2S;大部分菌株不会发生氨基酸脱羧反应(52%);多数菌株V-P反应阳性(74%);大约一半菌株可抑制大肠杆菌和金黄色葡萄球菌的生长。最终结果表明,菌株S26、S42、S53能够满足所有筛选条件,且产酸性能较好,可以作为肉品发酵的备选菌株。
2.3 乳酸菌菌株鉴定
2.3.1 形态学特征 从侗族传统发酵酸肉中分离得到符合发酵条件的三株乳酸菌。其菌落形态和经革兰氏染色后的显微形态详见表2和图1。

表2 三株菌的形态学特征Table 2 Morphological characteristics of three strains

图1 菌株S26、S42、S53革兰氏染色显微形态Fig.1 Gram staining micromorphology of strains S26,S42,S53
由表2和图1可知,菌株S26为长杆菌,革兰氏阳性,菌落呈乳黄色,扁平状,菌落较小;菌株S42为短杆菌,革兰氏阳性,菌落为乳白色,表面光滑,边缘整齐;菌株S53为球形,菌落为乳白色,表面凸起,边缘圆整。
2.3.2 生理生化结果 表3为三株菌的生理生化鉴定结果,结合三株菌的形态特征,根据文献[30-31],可初步鉴定S26为香肠乳杆菌,S42为植物乳杆菌,S53为乳酸片球菌。
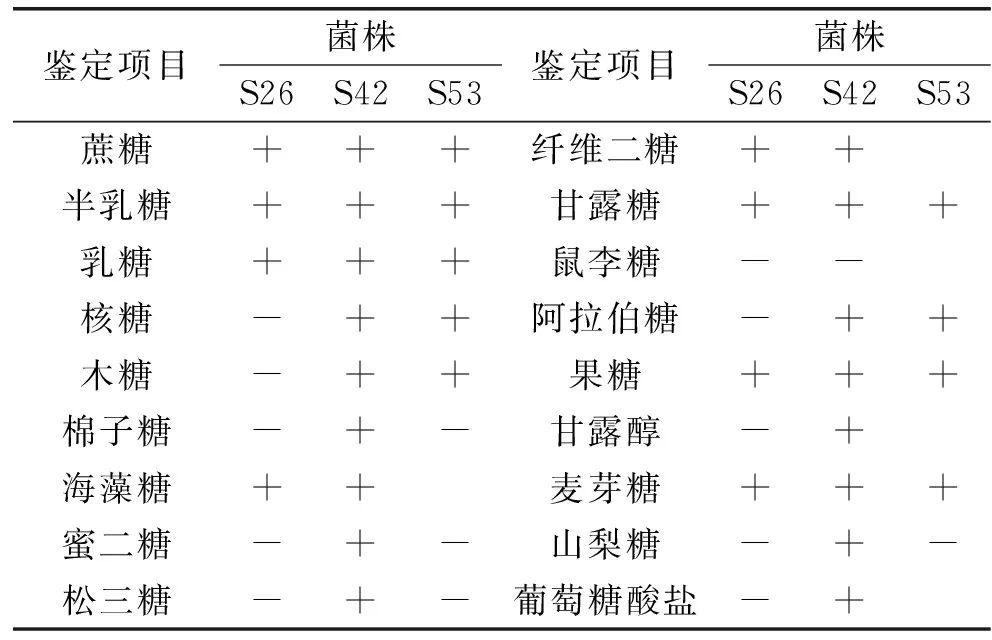
表3 生理生化鉴定结果Table 3 Physiological and biochemical identification results
2.3.3 乳酸菌菌株的16S rRNA序列测定及系统进化树的构建 对提取菌株的总DNA进行PCR扩增,扩增出3条大小约为1500 bp的特异性条带。然后将获得的特异性片段纯化后进行测序,并将测序结果用BLAST软件在GenBank中进行序列同源性比对,将GenBank中与菌株序列同源性高于98%的几株菌株进行BLAST分析,构建系统发育树。结果如图2~图5所示,S26为香肠乳杆菌(Lactobacillusfarciminis),S42为植物乳杆菌(Lactobacillusplantarum),S53为乳酸片球菌(Pediococcuslactis)。
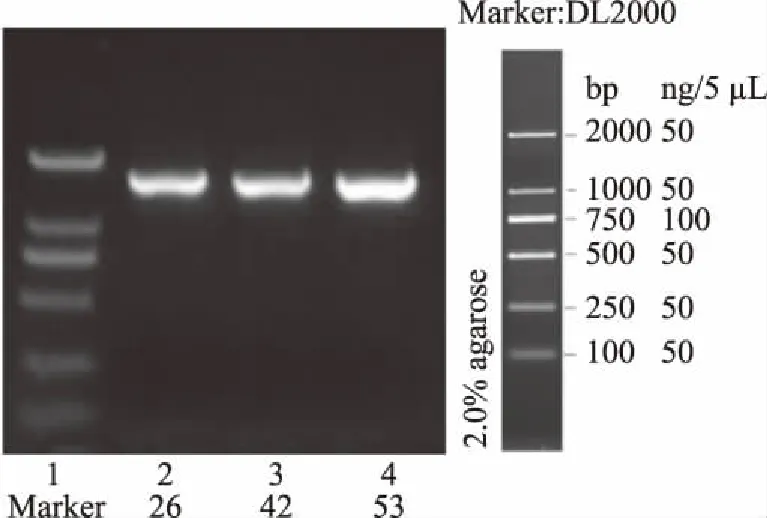
图2 菌株的16S rRNA PCR扩增产物电泳条带Fig.2 16S rRNA PCR amplification productelectrophoresis band of the strain注:1:Marker标记物;2~4:分别为菌株S26,S42,S53。

图3 菌株S26系统进化树Fig.3 Phylogenetic tree of strain S26
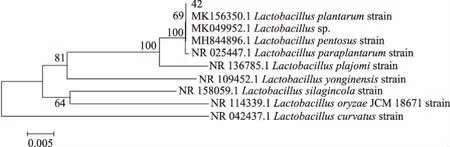
图4 菌株S42系统进化树Fig.4 Phylogenetic tree of strain S42

图5 菌株S53系统进化树Fig.5 Phylogenetic tree of strain S53
2.4 菌株产酸能力和生长曲线的测定
将3株菌活化后接入到MRS培养基中,每间隔2 h取少量菌悬液,适当稀释后测定其OD值,同时测定其pH的变化规律,再分别绘制三株菌的生长曲线及pH变化曲线,图6、图7和图8分别为香肠乳杆菌S26、植物乳杆菌S42、乳酸片球菌S53的生长曲线及pH变化曲线。
由图6、图7和图8可知,3株菌的生长延滞期均为0~3 h,此时菌种处于适应阶段,生长缓慢;而香肠乳杆菌S26的对数生长期为3~10 h,植物乳杆菌S42的对数生长期为3~12 h,乳酸片球菌S53的对数生长期为3~16 h,此时菌种增殖较快;对于稳定期,香肠乳杆菌S26在10 h后菌种进入稳定时期,植物乳杆菌S42在12 h后菌种进入稳定时期,乳酸片球菌S53在16 h后菌种进入稳定时期,此时OD值缓慢增长至最大并保持稳定状态。三株菌的pH均在对数生长期内由5.7迅速下降至3.5左右,进入稳定期后变化不大。
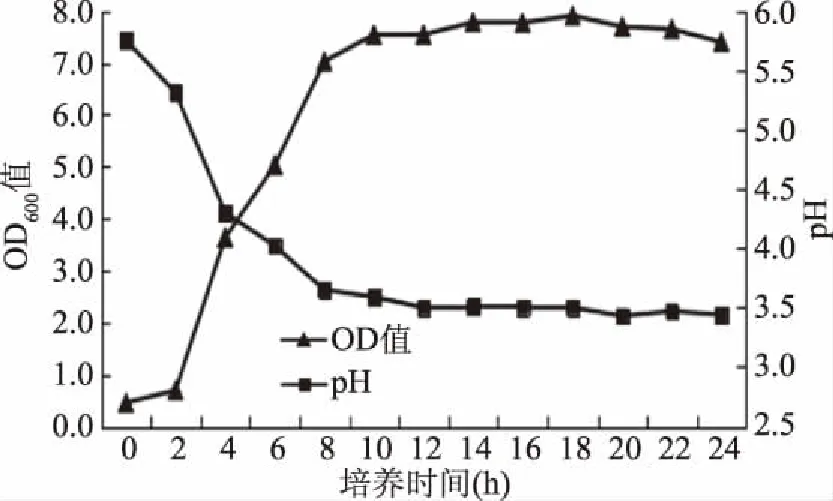
图6 香肠乳杆菌S26生长曲线及pH变化曲线Fig.6 Lactobacillus farciminis S26 growth curve and pH curve
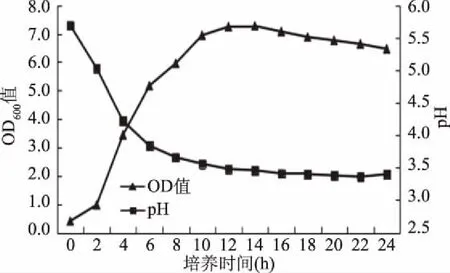
图7 植物乳杆菌S42生长曲线及pH变化曲线Fig.7 Lactobacillus plantarum S42 growth curve and pH curve
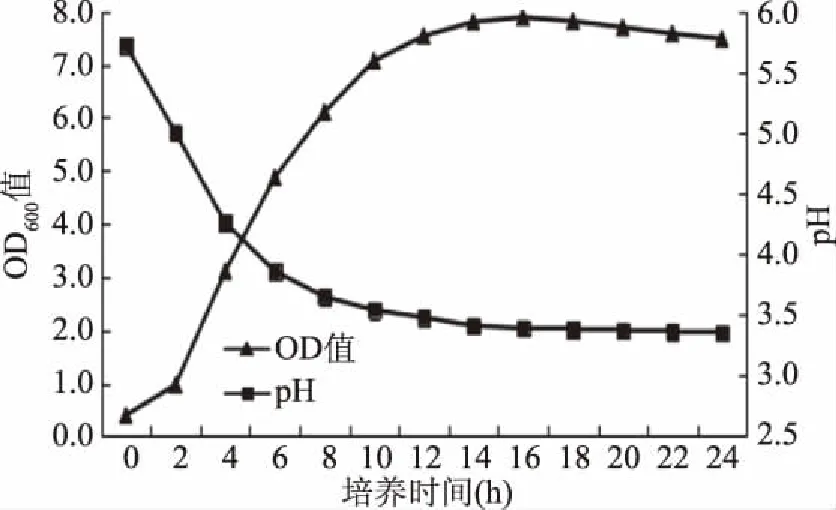
图8 乳酸片球菌S53生长曲线及pH变化曲线Fig.8 Growth curve and pH curve of Pediococcus lactis S53
2.5 菌株的安全性分析
2.5.1 抗生素敏感性试验 采用药敏片法检测从酸肉中分离到的三株乳酸菌对13种抗生素的敏感性。被测菌株对抗生素的敏感性检测结果如表4所示,香肠乳杆菌S26对这几类抗生素均表现出敏感性;植物乳杆菌S42对糖肽类抗生素中的万古霉素表现为耐药,对其他类抗生素均有敏感性;乳酸片球菌S53对氨基糖苷类中的卡那霉素和喹诺酮类中的环丙沙星表现为耐药,对其他抗生素均有敏感性。

表4 乳酸菌对13种抗生素的敏感性检测结果Table 4 Sensitivity test results of lacticacid bacteria against 13 antibiotics
2.5.2 质粒提取 通过琼脂糖凝胶电泳对S26、S42和S53做质粒检测,同时以含有质粒的菌株(pET-22b)作对照,结果如图9所示,对照菌株所在泳道出现荧光条带,而被测菌株所在泳道均未出现荧光条带,可认定3株菌不含有质粒。
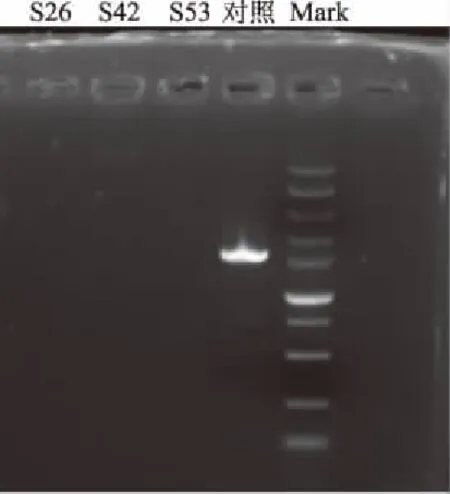
图9 质粒提取试验结果Fig.9 Plasmid extraction test results
2.5.3 溶血现象 溶血性是体外对菌株进行安全性检测的重要指标之一。根据溶血特征可将溶血性分为两类:α溶血,特点是菌落周围有草绿色溶血圈,对人致病力差;β溶血,其特点是菌落周围出现透明溶血圈,对人体致病力强[35]。若无溶血性,则没有溶血圈出现。由图10可知,S26、S42和S53均无溶血现象产生,说明3株菌均不具有溶血性。
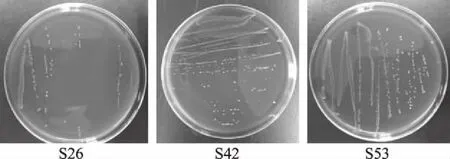
图10 S26、S42和S53溶血试验结果Fig.10 S26,S42 and S53 hemolysis test results
2.6 菌株之间的拮抗试验
通过平板划线可以比较菌株之间是否具有拮抗性,从而判断菌株是否可以混合使用,由表5可知,S26、S42和S53之间均无拮抗性,可用来复配发酵。
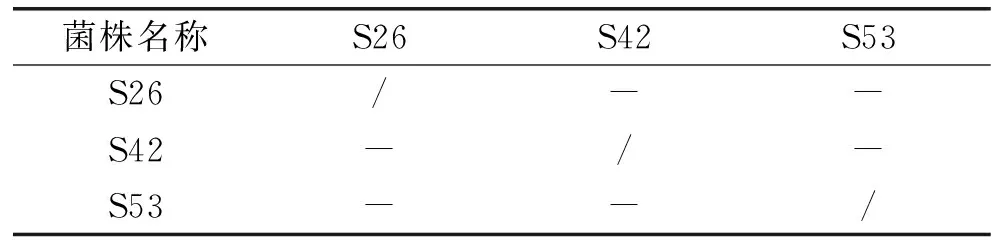
表5 株菌拮抗效果比较Table 5 Comparison of antagonistic effects of strains
注:+代表拮抗,-代表不拮抗,/表示同种菌株不需要进行拮抗性测试。
3 结论
从传统侗族酸肉中筛选出能够产生明显透明钙圈、革兰氏阳性、过氧化氢酶阴性的54株菌株,按照肉类发酵剂的筛选标准进一步筛选得到3株发酵性能较好的菌株,并对其进行分析鉴定,确定S26为香肠乳杆菌,S42为植物乳杆菌,S53为乳酸片球菌;对这3株菌的生长特性和产酸能力进行研究,发现这3株菌生长状况良好,在12 h左右均能到达稳定期,并且其产酸速度快,24 h内可以将pH降到3.5左右;同时对这3株菌进行了安全性方面的评估,发现其对大多数抗生素无耐药性,无质粒,也无溶血现象,安全性良好。这一研究结果将为肉制品以及功能性食品的研制等方面提供菌种资源。
本研究从传统发酵肉制品中筛选出三株肉品发酵剂,其中香肠乳杆菌在肉品发酵剂方面未见报道;对这3株菌的具体功能方面应在今后进行更深一步的研究;此外,对这3株菌的发酵性能还应实际应用到肉制品发酵中进行进一步探究。
