具有遗传相关性的玉米品种内生细菌的分离与多样性研究
2020-06-17杨福珍武纤雨张如养徐田军赵久然
杨福珍, 武纤雨, 张如养, 李 苗, 徐田军, 刘 洋,, 赵久然,
(1.北京科技大学 化学与生物工程学院, 北京 100083; 2.北京市农林科学院 玉米研究中心, 北京 100097)
玉米又称苞谷、苞米,是世界上广泛栽培的农作物,也是我国重要的粮食作物,种植面积为全国粮食作物种植面积的三分之一[1]。玉米产量高、用途广,在粮食、饲料、工业、医药原料等方面均具有较高的经济价值。提高玉米生产数量和质量,对改善人民生活、发展国家经济及提升国际市场竞争力具有十分重要的意义[2]。影响玉米产量的原因有很多,新品种的培育占35%[3]。中国各玉米产区地质不同,杂交玉米具有优质、高产、抗病等特性,能够保障我国粮食生产安全及农业增收[4]。
内生细菌是植物微生态系统中必不可少的组成部分,生活于植物组织内,与宿主形成了紧密的共生关系。有益内生细菌在植物生物防治、耐受抗病及促进生长中起到重要作用[5-6]。已有研究证实,内生细菌广泛存在于植物的多种器官中,包括根、茎、叶、种子、花和果实等[7]。植物内生细菌种类多,其中优势菌属为芽孢杆菌属、肠杆菌属、假单胞菌属等[8-11]。同时,随着研究方法持续更新,内生细菌新种的发现不断丰富着细菌资源[12-14]。
植物内生细菌可以寄生于不同的宿主植物,随着植物微生态研究的不断发展与深入,目前,已有上百种植物的微生态被研究[15],包括水稻、小麦、棉花、高粱、甜菜、玉米等[16-18]。有益内生细菌在植物生长发育过程中扮演着重要的角色。近年来,有关植物内生细菌的研究报道逐渐增多[19],玉米内生细菌的研究也越来越受重视。在实验材料方面,有关玉米内生细菌的研究多集中于根、茎、叶[20-21],玉米种子内生细菌则很少有研究[22]。影响内生细菌多样性的原因有很多,相对于同种玉米不同发育时期的研究[23],不同种类玉米的研究则很少。本实验选用具有遗传相关性的玉米种子为实验材料,通过传统培养方法研究玉米种子内生细菌群落多样性,以此来获取丰富的玉米种子内生细菌资源;同时解析不同宿主内生细菌之间的联系与差异,并且探寻内生细菌在杂交玉米世代之间的纵向传递规律。
1 材料与方法
1.1 材料与试剂
1.1.1玉米种子的采集
实验样品为玉米杂交品种(京科665、京科968、MC738、京农科728)及其亲本(京725、京92、京724、京2416、MC01),种子样品由北京市农林科学院玉米研究中心自主培育。供试玉米材料品种遗传关系见图1。样品于2019年采自于海南省三亚市南滨农场北京市农林科学院玉米研究中心南繁基地(北纬18.35774333340131度,东经109.18169975280762度,中国南方),4 ℃保存。
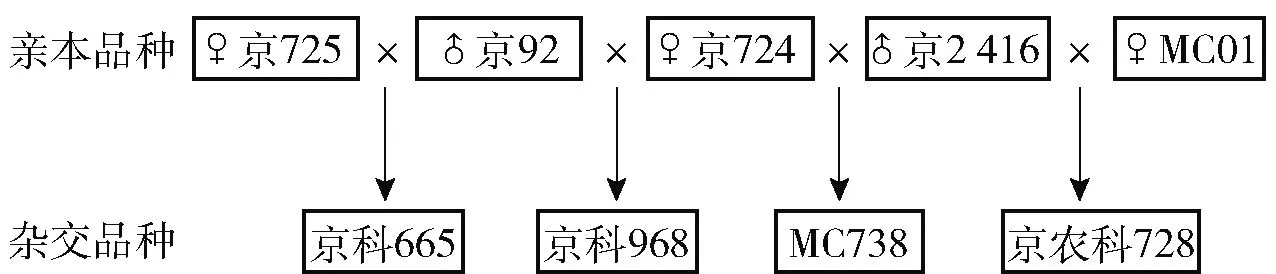
图1 9种玉米样品间遗传相关性Fig.1 Genetic relationships among nine maize samples
1.1.2培养基及试剂
LB、TSA、R2A成品培养基,北京陆桥公司; PCR相关试剂,TIANGEN公司,PCR引物由北京诺赛生物公司合成。
1.2 实验方法
1.2.1样品表面灭菌
先将玉米种子用无菌水清洗4~5次,之后首先用体积分数为70%的乙醇溶液浸泡3 min,再用氯离子质量浓度为250 mg/L的次氯酸钠溶液浸泡5 min,然后用体积分数为70%的乙醇浸泡30 s,最后用无菌水淋洗5~7次,在无菌滤纸无菌条件下晾干[24];同时取最后一次淋洗水120 μL涂于LB固体平板上,28 ℃恒温培养72 h,检测玉米种子表面灭菌效果[25]。表面灭菌彻底的种子用于后续实验。
1.2.2内生细菌的分离与纯化
玉米内生细菌群落多样性研究采用传统分离培养技术。取适量表面灭菌的玉米种子用无菌研钵研磨成粉末,在超净工作台取2 g的玉米种子粉末样品于50 mL离心管,加20 mL无菌水。采用梯度稀释法制备稀释倍数为1×10-1到1×10-4的系列稀释液。分别取稀释梯度为10-3和10-4的玉米种子稀释样品100 μL 涂布于 LB、TSA、R2A平板上,每个处理组设置3个平行,30 ℃培养3 d后根据平板上菌落的形态(表面光泽度、透明度、大小、颜色、形状、边缘整齐度等)随机挑取具有代表性的单菌落[26],纯化后4 ℃保存备用。
1.2.3内生细菌的16S rDNA序列分析
采用破碎法粗提取细菌基因组DNA。用正向引物799F (5′-AACAGGATTAGATACCCTG-3′)和反向引物1492R (5′-GGTTACCTTGT-TACGACTT- 3′)扩增细菌16S rDNA。PCR反应体系(50 μL): DNA 模板1 μL、PCR Mix 25 μL、引物799F (10 mmol/L) 2 μL、引物 1492R (10 mmol/L) 2 μL, ddH2O 20 μL。PCR反应程序:94 ℃预变性5 min; 94 ℃变性40 s,55 ℃复性40 s,72 ℃延伸45 s,30个循环后72 ℃ 延伸10 min。用1%琼脂糖凝胶电泳检测PCR扩增产物。PCR产物用DYY- 8C型DNA测序仪进行测序。将测序得到的结果在EZ biocloud中进行比对,确定与已知序列同源关系,当序列相似性达到98.65%以上时归为同一个运算的操作分类单元(operational taxonomic units,OTUs)。
2 实验结果
通过传统分离培养方法从玉米杂交品种(京科665、京科968、MC738、京农科728)及其亲本(京725、京92、京724、京2416、MC01)中分别挑取2、7、8、12、7、6、12、13、17株细菌,分别有2、4、5、7、2、1、3、3、4个代表菌株(表1~表9),将代表菌株序列信息提交到 GenBank,并获得登录号。

表1 玉米京科665种子内生细菌分布

表2 玉米京科968种子内生细菌分布
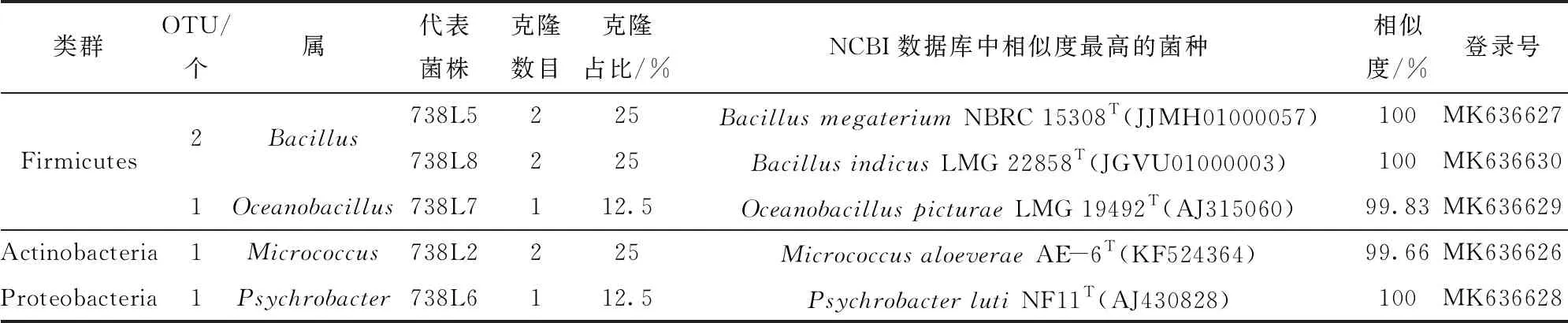
表3 玉米MC738种子内生细菌分布
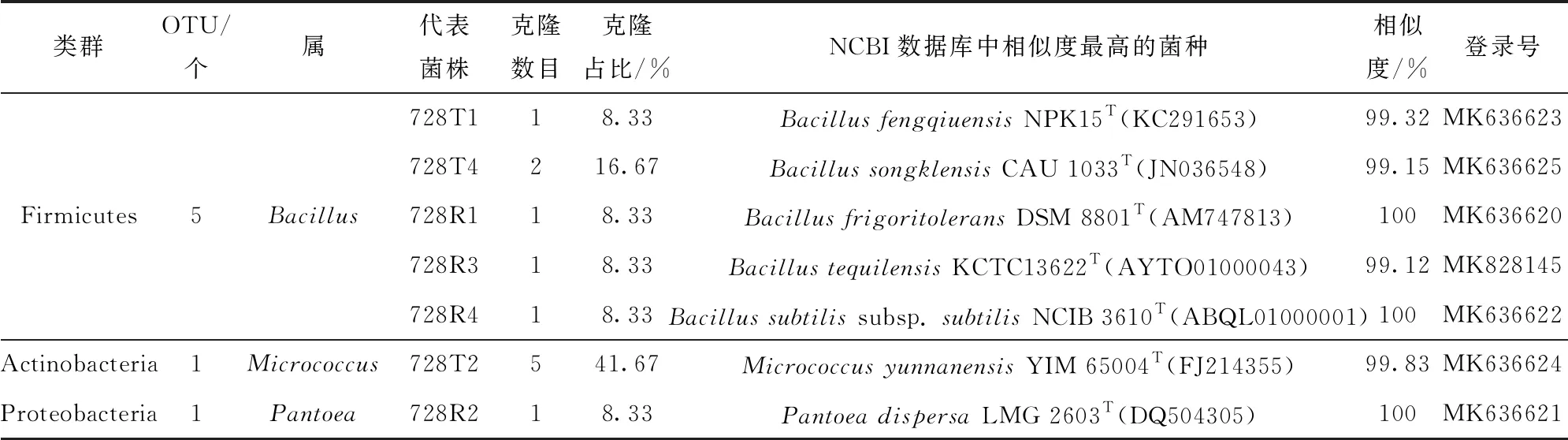
表4 玉米京农科728种子内生细菌分布

表5 玉米京725种子内生细菌分布

表6 玉米京92种子内生细菌分布

表7 玉米京724种子内生细菌分布

表8 玉米京2416种子内生细菌分布
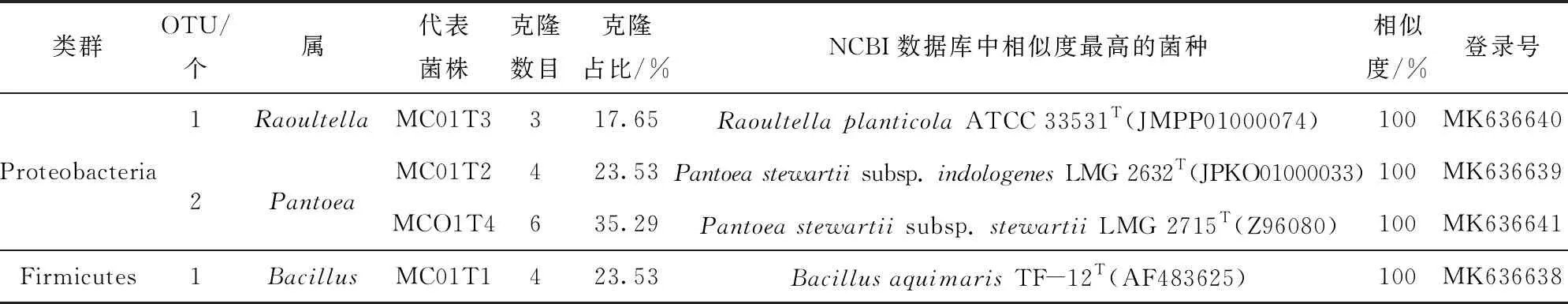
表9 玉米MC01种子内生细菌分布
由玉米京725×京92杂交而得的玉米京科665种子内生细菌分布,见表1和图2。在京科665中,内生细菌并不丰富,仅有2个OTUs,均属于Bacillus(100%),Bacillusaltitudinis41KF2bT和Bacillussubtilissubsp.subtilisNCIB 3610T是并列第一优势种。在母本京725和父本京92中,见表5、表6和图2,与其杂交后代相似,也分别仅有2和1个OTUs,均属于Bacillus(100%)。其中Bacillussubtilissubsp.subtilisNCIB 3610T为亲本与子代共有菌种,且为父本京92的第一优势种,母本京725的第二优势种。
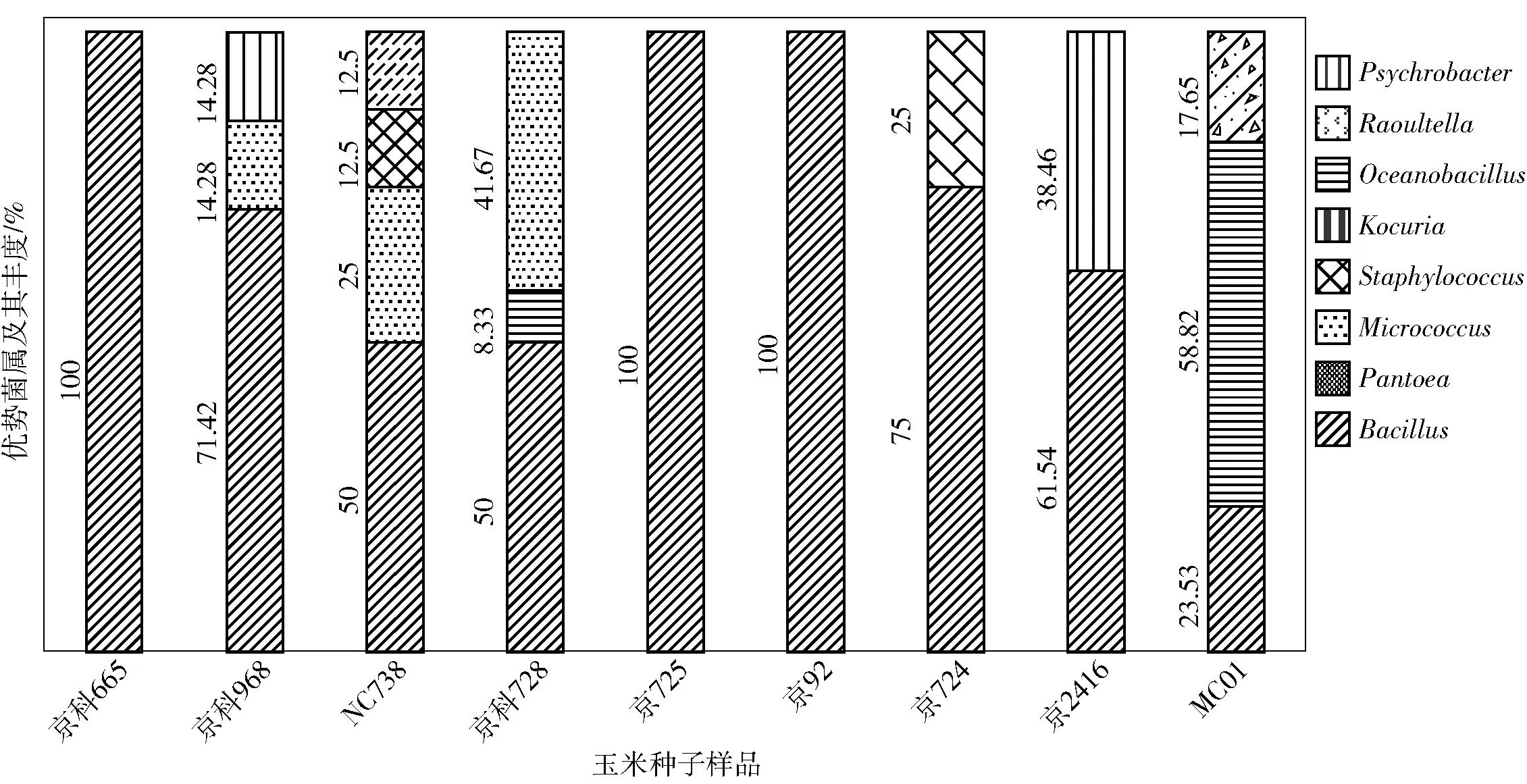
图2 9种玉米种子样品中优势菌属及其丰度分析Fig.2 Analysis of dominant genera from samples of nine maize seeds
由玉米京724×京92杂交而得的玉米京科968种子内生细菌分布,见表2和图2。在京科968中,包含有4个OTUs,分别属于Bacillus(71.42%)、Micrococcus(14.28%)和Kocuria(14.28%)。其中BacillusmarisflaviJCM 11544T为第一优势种,BacillusfrigoritoleransDSM 8801T、MicrococcusyunnanensisYIM 65004T和KocuriaroseaDSM 20447T并列为第二优势种。在母本京724中,见表7和图2,包含有3个OTUs,分别属于Bacillus(75%)和Staphylococcus(25%)。第一优势种为Bacillusaltitudinis41KF2bT,第二优势种为Staphylococcusequorumsubsp.equorumATCC 43958T,第三优势种为BacillusparamycoidesNH24A2T。京科968内生细菌中虽未包含有与亲本中相同的菌种,但与其父本母本的第一优势菌属都是Bacillus。
由玉米京724×京2416杂交而得的玉米MC738种子内生细菌分布,见表3和图2。在MC738中,内生细菌较亲本更丰富一些,包含有5个OTUs,分别属于Bacillus(50%)、Micrococcus(25%)、Oceanobacillus(12.5%)和Psychrobacter(12.5%)。BacillusmegateriumNBRC 15308T、BacillusindicusLMG 22858T和MicrococcusaloeveraeAE- 6T并列为第一优势种,OceanobacilluspicturaeLMG 19492T和PsychrobacterlutiNF11T并列为第二优势种。在父本京2416中,见表8和图2,包含有3个OTUs,分别属于Bacillus(61.54%)和Kocuria(38.46%)。KocuriaroseaDSM 20447T(X87756)为第一优势种,BacillusmegateriumNBRC 15308T和Bacillussubtilissubsp.subtilisNCIB 3610T为第二优势种。MC738与其父本京2416存在相同的优势菌种,即MC738的第一优势种BacillusmegateriumNBRC 15308T也是京2416的第二优势种。
由玉米MC01×京2416杂交而得的玉米京农科728种子内生细菌分布,见表4和图2。在京农科728中,包含有7个OTUs,分别属于Bacillus(50%)、Micrococcus(41.67%)和Pantoea(8.33%)。MicrococcusyunnanensisYIM 65004T是第一优势种,BacillussongklensisCAU 1033T是第二优势种,Bacillussubtilissubsp.subtilisNCIB 3610T、BacillusfengqiuensisNPK15T(KC291653)、BacillusfrigoritoleransDSM 8801T、BacillustequilensisKCTC 13622T和PantoeadispersaLMG 2603T并列为第三优势种。在母本MC01中,见表9和图2,包含有4个OTUs,分别属于Pantoea(58.82%)、Bacillus(23.53%)和Raoultella(17.65%)。其中Pantoeastewartiisubsp.stewartiiLMG 2715T(Z96080)为第一优势种,Pantoeastewartiisubsp.indologenesLMG 2632T和BacillusaquimarisTF- 12T并列为第二优势种,RaoultellaplanticolaATCC 33531T为第三优势菌。京农科728与其父本京2416存在相同的优势菌种,即京农科728的第三优势种Bacillussubtilissubsp.subtilisNCIB 3610T也是京2416的第二优势种。
杂交玉米京科665和京科968有共同的父本(京92),但母本不同。京科968内生细菌群落比京科665丰富,见图2,Bacillus均是二者的第一优势菌属,同时也是共同父本京92的第一优势菌属。杂交玉米京科968和MC738有共同母本(京724),但父本不同。MC738内生细菌群落相对京科968更为丰富,见图2,Bacillus和Micrococcus是二者所共有的优势菌属,并且Bacillus也是共同母本京724的第一优势菌属。杂交玉米MC738和京农科728有共同父本(京2416),但母本不同。MC738与京农科728内生细菌群落都比较丰富,见图2,Bacillus和Micrococcus同时是二者的第一优势菌属和第二优势菌属,并且Bacillus也是共同父本京2416的第一优势菌属。虽然各品种杂交玉米的内生细菌群落在数量和种类上有所差异,但是优势菌属均存在于其亲本中,并且均为Bacillus。
3 分析与讨论
种子是种子植物的繁殖体系,对延续物种起着重要作用。中国是农业大国,种子作为农业生产中最基本、最重要的生产资料,市场对于单产高、抗性好的种子需求越来越明显[27]。种子微生物是指生活于种子内或者是种子际的各种微生物的统称。随着与植物相关的微生物越来越受到重视,但相对根、茎等器官,与种子相联合微生物虽具有普遍性和多样性,但研究则较少[28]。集中于玉米种子微生物,特别是内生细菌的研究,相对于水稻、大麦则更少[29]。本研究以具有遗传相关性的玉米种子为研究对象,以传统培养的方法对玉米种子内生细菌群落进行研究,旨在探索玉米种子亲子代之间内生细菌群落的相关性。
研究结果表明,玉米内生菌在亲子代之间在遗传上具有一定的相关性,同时具有相同亲本的杂交玉米之间也有一定的相关性。亲本与其子代在内生菌代表菌株数目上相近,且存在相同的优势菌种。如子代京科665、亲本京725和京92分别有2、2、1个OTUs,Bacillussubtilissubsp.subtilisNCIB 3610T是三者的共同优势菌种。子代MC738、亲本京724和京2416分别有5、3、3个OTUs,BacillusmegateriumNBRC 15308T是MC738与其父本京2416的共同优势菌种。来自共同亲本的子代之间存在共同优势菌属。如具有共同父本京92的杂交玉米京科665和京科968,Bacillus是二者的共同优势菌属。具有共同母本京724的杂交玉米京科968和MC738,Bacillus和Micrococcus是二者的共同优势菌属。具有共同父本京2416的杂交玉米MC738和京农科728,Bacillus和Micrococcus是二者的共同优势菌属。因此,具有遗传相关性的玉米种子亲子代之间、不同子代之间的内生细菌群落多样性存在有优势菌种或优势菌属的相似性。多种因素会对植物内生细菌群落多样性造成影响。Yang等[30]在研究牡丹内生细菌在不同组织和不同品种中的多样性时发现,Pseudomonas和Enterobacteriaceae在根样品中普遍存在,而叶样品中的优势属为Succinivibrio和Acinetobacter。而且不同牡丹品种之间内生细菌丰度不同。在生姜中也含有多种内生细菌,随着宿主的生长,内生细菌的数量和类型在不断减少,即在生姜幼苗期时,内生细菌种类最多,密度最大,根茎增大期时种类最少,密度最小[31]。
种子作为植物重要的繁殖器官,是多种有益细菌和病原菌的载体[32]。很多原因对种子内生细菌多样性产生一定的影响。在水稻种子中,同一水稻品种成熟期相比于灌浆期菌群种类较丰富,种子内生细菌的组成与其发育时期有一定的关系[33]。Mundt等[34]通过传统培养方法对多种植物种子的内生细菌进行分离培养, 实验表明在相同的培养条件下, 从甜椒、萝卜、黑麦、苜蓿可分离到46种细菌,但含羞草、黄桑种子则很难分离到细菌。可能是因为不同种子的外在形态和内部结构对种子内生细菌群落造成影响。刘媛等[35]在探究棕榈科植物种子内生细菌群落及其物种差异时发现不同的物种各级内生细菌分类阶层总数不同,群落组成随物种不同而异。
本研究中的玉米种子主要内生菌属(Bacillus、Micrococcus、Kocuria、Oceanobacillus、Psychrobacter、Pantoea、Staphylococcus和Raoultella),也广泛分布于玉米的根、茎、叶等器官部位中,有一些属于植物有益细菌,具有多种生物学作用。Bacillus能产生挥发性物质HCN,能有效抑制玉米大斑病菌、水稻纹枯病菌等多种病原菌菌丝的生长,具有明显的抑菌抗病性[36]。Micrococcusluteus能够表达海藻糖磷酸酶和磷脂酶D从而增加植物的耐盐性和耐旱性[37]。红树根中的Psychrobacter能够分解纤维素和脂肪,也具有抗真菌病原体的活性,是潜在的医药抗生素来源[38]。利用微生物来减少土壤中的重金属污染可以促进植物生长。分离自植物根部的Kocuriasp.CRB15可以定殖于植物幼苗,使得幼苗在Cu2+处理后也能正常生长,增强植物耐受重金属的能力。同时也具有高效的溶磷能力,产IAA的能力,促进植株的生长[39]。Raoultellasp.通过离子交换摄取土壤中的Cd2+,修复重金属污染的土壤,形成有利于植株生长的环境。同时还会产生吲哚乙酸、溶解磷酸盐,使植株能够摄取更充足的营养[40]。植物有益细菌作为植物微生态系统重要组成,在植物生长发育过程中抑制有害病菌、增强耐受性等方面均发挥着重要的作用。
4 结 论
研究玉米种子内生细菌与其宿主相关性,对玉米育种及农业发展有重要参考意义。本研究用传统分离培养方法研究杂交玉米种子及其亲本的内生细菌群落多样性,结果表明具有遗传相关性的玉米亲子代、不同子代之间的内生细菌群落存在有优势菌种或优势菌属的相似性。亲本与其子代在内生菌代表菌株数目上相近,且存在相同的优势菌种。来自共同亲本的子代之间存在共同优势菌属。但目前的研究还局限于内生细菌的群落多样性,后续研究可以进一步探寻内生细菌在玉米中横向及纵向的传递规律。
