酸法提取火龙果果皮中果胶
2020-06-15余杰王晓红刘丽邵文丽代丽娜姚娜
余杰 王晓红 刘丽 邵文丽 代丽娜 姚娜

摘 要:以新鲜火龙果果皮为原料,用酸水解法提取果胶,通过单因素实验,确定果胶提取的最佳适宜条件,并分析了果胶酯化度.实验表明,提取果胶最佳适宜条件为:提取酸为硫酸,浸提时间140min,料液比1:10(g/mL),提取温度95℃,提取pH值3.5.该工艺条件下果胶的得率为2.6%,酯化度为28.34%,为低酯果胶.
关键词:火龙果果皮;果胶;酸法
中图分类号:TS209 文献标识码:A 文章编号:1673-260X(2020)05-0024-03
火龙果[1]又名红龙果、青龙果、玉龙果等,被誉为“水果之王”,是近年来在我国新兴的一种果用栽培品种,具有相当可观的产量,但火龙果果皮被大量遗弃,造成了资源浪费.果胶是细胞壁的主要成分,主要存在于植物的茎和果实中,果胶是膳食纤维的主要成分,被广泛应用于食品[2]、化妆品[3]、医药工业等[4],在食品中可用作胶凝剂、悬浮剂、增稠剂,果胶还具有降低血糖、降胆固醇、防紫外线辐射、重金属离子吸附、通便和抗癌等作用.火龙果皮中果胶[5,6]的含量较高,通过实验方法将果胶提取出来,可以使火龙果的应用价值更大化.本文以白肉红皮火龙果皮为原料通过酸水解提取法[7]进行果胶的提取.
1 实验材料与方法
1.1 材料与仪器
1.1.1 材料
成熟的白肉火龙果果皮.
1.1.2 实验试剂
氨水、酚酞、95%乙醇、浓盐酸、氢氧化钠、浓硫酸、异丙醇、硝酸银,所用试剂均为分析纯.
1.1.3 实验仪器
PHS-25型pH计(江苏省金坛市金祥龙电子有限公司)、SY-601型超级恒温水浴锅(天津欧诺仪器仪表有限公司)、JJ224BC电子分析天平(上海花潮电器有限公司)、HG101-2A电热鼓风干燥箱(南京红龙仪器设备厂).
2 实验方法
2.1 工艺流程
原料预处理→酸水解提取→脱色→沉淀→过滤→酒精反复洗涤→纱布过滤→烘干(滤液进行浓缩处理,回收乙醇)→产品.
2.2 提取方法
将火龙果皮用清水反复冲洗.把洗净的果皮切碎,并放到烧杯250ml中,加入蒸馏水,其液面要没过果皮上表面.用恒温电热套(设置温度为90℃)加热并保持温度5~10min,使果皮中的酶失活,然后过滤,得到果皮.称取50g果皮放入大烧杯中,加入酸并把溶液的pH值调3到4之间,在实验所需温度的恒温水浴箱中放置,待时间达到实验所需时间,用双层纱布进行趁热过滤得到滤液.为了脱除果皮的颜色和异味,可在滤液中加入适量的活性炭,在70℃的温度下恒温10min,趁热过滤,冷却至室温,将pH值用稀氨水调到4,在搅拌情况下加入95%的乙醇.加入1.3倍的乙醇溶液,直至乙醇浓度达到50%~60%,其浓度可以用酒精计测量.测定完成后静置10min.用纱布多次折叠后代替滤网进行过滤,除去固体杂质.滤液用95%的乙醇进行三次洗涤,回收所有液体.滤液中的乙醇可以用蒸馏的方式回收.把浓缩后的粘稠状液体放到干燥箱(设置温度为70℃)中干燥2h,既得果胶产品,计算得率.
2.3 果胶酯化度的测定
实验选用碱液滴定法[8]测定果胶的酯化度.具体的测定步骤为:第一步在电子天平上称量0.5000g烘干后的果胶置于50mL干净、干燥的烧杯中,加入15mL(5mL浓盐酸溶于100mL60%的异丙醇后混合的)溶液,充分搅拌15分钟,然后移入干燥的长颈漏斗中进行过滤,用混合后的溶液洗涤5次,大概每次20mL,接着再用60%的异丙醇洗涤,滤液中加入硝酸银溶液检测其是否有氯化物,不出现白色絮状物时停止洗涤;再用60%的异丙醇洗涤,异丙醇大约为20mL,洗涤完将溶液移至100℃的电热鼓风干燥箱中烘干90分钟,冷却并且称重.第二步称取冷却后的物质大约0.05g于250mL的锥形瓶中,量取2mL95%的无水乙醇加入,再加入100mL无二氧化碳的水(以防止二氧化碳与碱液反应,影响滴定的结果,会使结果偏大),为使样品能够全部溶解,要将瓶塞塞紧并且不停地振荡锥形瓶.在样品溶液中滴加酚酞指示剂2滴,然后用氢氧化钠标准溶液开始滴定,标准溶液的摩尔浓度为0.02mol/L,滴定至溶液变成微红色时即可,记录下氢氧化钠所使用的量(记为V1),即是果胶溶液的原始滴定度.在样品中继续加入摩尔浓度为0.5mol/L,20mL标准的氢氧化钠溶液,强烈震荡15分钟,再加入等摩尔浓度盐酸的标准溶液(0.5mol/L),此时溶液呈现为红色,剧烈振摇,使反应能充分进行,振动后溶液变成无色,再加入酚酞指示剂3滴.接着再用标准的氢氧化钠溶液滴定,摩尔浓度仍为0.02mol/L,滴定至溶液变为浅粉色并在30秒内不变色时为止,记录氢氧化钠溶液的用量(记为V2),V2是皂化滴定度.
果胶的计算方法:
果胶酯化度(%)=V2/(V1+V2)×100%
在上式中,V1为果胶的原始滴定度(mL);V2为果胶溶液的皂化滴定度(mL).
3 结果与讨论
3.1 酸种类对果胶得率的影响
在酸性环境条件下,可以有效提高果胶的得率.本实验选用工业中常见的浓度为0.05mol/L的三种无机酸,分别是盐酸、硫酸、醋酸.提取结果见表1.
由表1可知:在酸浓度相同的情况下,以硫酸为提取酸的火龙果皮果胶得率要高于其他两种酸,其得率为1.94%.所以選择硫酸作为提取酸.
3.2 提取温度对果胶得率的影响
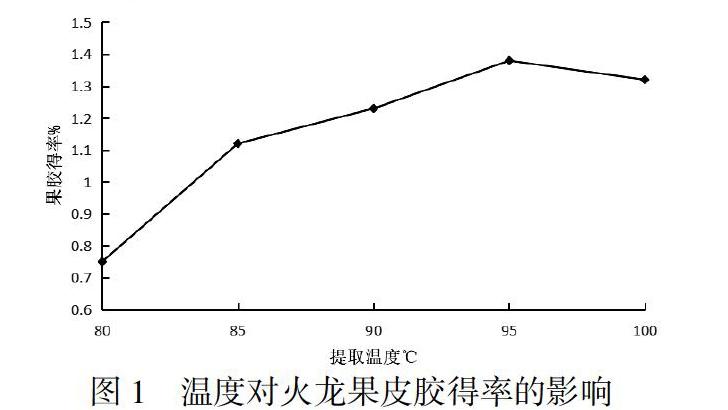
以硫酸为提取果胶所用酸,料液比为1:6,pH为4,提取时间为90min,提取温度分别设置为75℃、80℃、85℃、90℃、95℃、100℃,经过滤、沉淀、洗涤、烘干后得到果胶产品.对得到的果胶产品进行称重,计算火龙果皮果胶得率.结果见图2.
由图1可以看出,果胶得率随着温度的升高而不断增加,但当温度升高到95℃以后,得率缓慢降低.其原因可是果胶在95℃以后上的高温状态下易发生水解,所以果胶得率降低.所以最佳提取温度为95℃.
3.3 料液比对果胶得率的影响
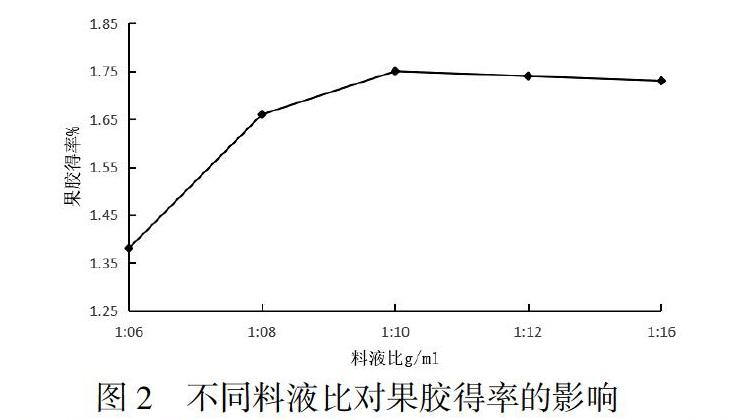
以硫酸为提取果胶所用酸,pH为4,提取时间为90min,提取温度为95℃,料液比分别为1:6、1:8、1:10、1:12、1:14,经过滤、沉淀、洗涤、烘干后得到果胶产品.对得到的果胶产品进行称重,计算火龙果皮果胶得率.结果见图2.
由图2可知,当料液比为1:10时,火龙果皮果胶得率最高.随着料液比的增加,果胶得率呈现先增加后趋于几乎不变的趋势,可能是由于随着料液比的增加,果胶在溶液中的溶解逐渐减缓到几乎不变.
3.4 提取时间对果胶得率的影响
以硫酸为提取果胶所用酸,pH为4,提取温度为95℃,料液比为1:10,提取时间分别为80min、100min、120min、140min、160min,经过滤、沉淀、洗涤、烘干后得到果胶产品.对得到的果胶产品进行称重,计算火龙果皮果胶得率.结果见图3.
由图3可知,火龙果皮果胶随着时间的增加,呈现逐步增大的趋势,但再达到140min后开始逐渐减小.其原因可能是隨着提取时间的增长,火果皮中果胶被酸分解成低分子量糖类,从而降低火龙果皮果胶得率.
3.5 浸取pH对果胶得率的影响
以硫酸为提取果胶所用酸,提取时间为140min,提取温度为95℃,料液比为1:10,pH分别为2、2.5、3、3.5、4、4.5,经过滤、沉淀、洗涤、烘干后得到果胶产品.对得到的果胶产品进行称重,计算火龙果皮果胶得率.结果见图4.
结果如图4所示.在实验pH范围内,火龙果皮果胶得率呈先升高后降低的趋势,得率最高时,pH值为3.5.
3.6 果胶酯化度的标准与计算
根据甲氧基的酯化程度,果胶通常分成两类:一类是高脂果胶,其酯化度(DE值)>50%;而另外一类是低脂果胶,其酯化度(DE值)<50%[9].实验测得,果胶溶液的原始滴定度V1为7.94mL,皂化滴定度V2为3.14mL.
果胶的酯化度(%)=V1/(V1+V2)×100%
=3.14/(7.94+3.14)×100%
=28.34%
本实验所测得的火龙果果皮中果胶的酯化度为28.34%,小于50%,属于低脂果胶.
4 结论
实验以浓度为0.05mol/L的硫酸溶液作为提取酸,红皮白肉火龙果果皮作为原材料,用酸提取其中的果胶并探索了最佳提取条件.通过探索不同提取时间、不同提取温度、不同提取料液比、不同提取pH下的提取效果,得到最佳提取条件为提取温度95℃,提取时间为140min,提取料液比为1:10,提取pH为3.5.在最佳条件下,火龙果皮果胶最佳得率为2.6%.实验所得果胶产品碾碎后为白色粉末状固体,测得酯化度为28.34%,属于低酯果胶.
——————————
参考文献:
〔1〕邓仁菊,范建新,蔡永强.国内外火龙果研究进展及产业发展现状[J].贵州农业科学,2011,39(6):188-192.
〔2〕刘新新,刘钟栋.低酯果胶的提取与制备技术研究进展[J].食品与发酵工业,2019,45(24):278-284.
〔3〕刘敬然,华霄,谭婧,等.超高甲氧基果胶在食品乳液中的应用[J].食品安全质量检测学报,2019,10(02):277-283.
〔4〕赵姗.果胶钙微球的制备及其在固定化肝肿瘤细胞中的应用[D].大连理工大学,2018.
〔5〕但德苗,余侠,胡珊珊,等.超声波辅助法提取火龙果果皮多糖工艺优化及其抗氧化活性研究[J].农产品加工,2018(12):32-36.
〔6〕岳珍珍,邢颖,岳艳霞,等.火龙果果皮加工利用现状[J].现代食品,2019(07):17-19,22.
〔7〕王鸿飞,李和生,谢果凰,等.桔皮中果胶提取技术的实验分析[J].农业机械学报,2005,36(3):82-85.
〔8〕应珊珊.火龙果皮中果胶提取及改性研究[D].浙江大学,2014.20-22.
〔9〕李梦.果胶酯化度的测定及凝胶流变性与分子结构关系研究[D].暨南大学,2017.17-19.
