不同利用方式红壤反硝化势和气态产物排放特征①
2020-06-15NANANGZulkarnaen张金波
NANANG Zulkarnaen,程 谊,2,3,张金波,3,4*
(1 南京师范大学地理科学学院,南京 210023;2 江苏省地理环境演化国家重点实验室培育建设点,南京 210023;3 江苏省地理信息资源开发与利用协同创新中心,南京 210023;4 南京师范大学虚拟地理环境教育部重点实验室,南京 210023)
土壤反硝化作用通常是指微生物在厌氧或微量氧气环境下的NO呼吸过程,该过程中反硝化微生物将NO、NO、NO 或N2O 作为电子受体,并将其还原为NO、NO、N2O 或N2。反硝化过程是氮素循环的重要环节,是活性氮转化为惰性氮(N2)离开土壤、水体等系统回到大气的最主要的过程[1]。从生态学角度考虑,反硝化作用是平衡生态系统活性氮输入的重要机制。从环境保护的角度讲,反硝化过程对于移除水体中NO–3,保护水体环境具有重要的作用[1]。然而,在农田生态系统,反硝化过程是肥料氮损失的重要途径,据估算,全球氮肥反硝化损失约占氮肥总用量的12% ~ 30%[2]。但是,由于反硝化速率及其产物比例的时空变异非常大,导致不同学者估算的全球氮素反硝化损失量有巨大的差异(83 ~ 390 Tg/a)[3]。另外,反硝化过程的中间产物N2O 是一种重要的温室气体,N2O 还参与大气中许多光化学反应,破坏大气O3层。土壤硝化-反硝化过程释放的N2O 是全球N2O 的重要来源。因此,反硝化作用和气态产物比例及其影响因素一直是国内外学者研究的热点领域。
凡是能影响到土壤反硝化微生物生存和活性的因素均会影响土壤反硝化作用及其气态产物比例。其中,作为土壤微生物的主要能源和电子供体,土壤有机质是影响反硝化作用的重要因素,一般认为,土壤有机质越高,反硝化势越大[4];而且有机碳的形态也会影响土壤反硝化势,研究表明与总有机碳含量相比,易矿化碳与反硝化势的关系更为密切,土壤反硝化作用明显地受到嫌气易矿化态碳量的限制[5]。一些学者认为,土壤有机碳的空间差异是导致反硝化作用巨大的空间变异性的重要因素之一[6]。土壤有机碳可以促进反硝化中间产物 N2O 产生,也可以促进 N2O还原。通常 N2O 排放量随土壤有机碳含量增加而增加,而N2/N2O 也随之增加[7]。作为反硝化的底物,NO也是影响土壤反硝化作用的因素,通常反硝化速率随 NO含量的增加而增加,但是当 NO含量增加到较高的水平后,反硝化速率会趋于稳定。有研究报道当土壤 NO含量达到 25 ~ 100 mg/kg 时,反硝化势与土壤 NO含量无关[8]。高浓度 NO或 NO会抑制 N2O 还原为 N2,N2/N2O 降低[7]。土壤 pH 会影响微生物活性,同时还会影响碳的有效性,进而影响反硝化作用,在一定范围内,反硝化速率随 pH 的升高而升高[9-10]。通常认为 N2O 还原酶对酸性条件比较敏感,因此酸性土壤有利于 N2O 产生[7],N2/N2O 随 pH 升高而升高[11]。土地利用方式会显著影响土壤有机碳含量及组成、土壤 pH、微生物性质等土壤性质,进而可能影响反硝化作用[12]。土地利用方式的变化会直接影响有机物质的输入输出平衡,引起土壤有机碳含量的显著变化[13]。不同的种植制度、管理方式对土壤 pH 有明显的影响。例如种植茶树、竹子通常会降低土壤 pH,而种植水稻会提高土壤 pH;另外,施用石灰也会明显提高土壤 pH。这些理化性质的变化可能会进一步影响反硝化功能微生物[1,12]。反硝化速率的测定方法主要有乙炔抑制法和15N 标记方法;根据测定的是气态产物还是反硝化底物不同,又可分为气体产物产生速率测定法和底物消失速率测定法[1,3,12,14]。乙炔抑制法具有成本低、操作相对简单便捷等优点,被广泛应用于反硝化速率及其气态产物的时空变化及其影响因素研究[3]。目前为止,对陆地系统反硝化速率及其气态产物组成的评估主要是基于乙炔抑制法提供的大量数据。
红壤区是中国重要的粮食、经济作物生产区,在农业生产上占有重要地位。高强度的土地利用和农业管理措施强烈地影响土壤理化性质,影响土壤微生物数量和活性,进而会影响土壤氮素循环过程,其中也包括土壤反硝化过程,从而对农业生产、生态环境等带来一系列的影响。研究不同利用方式红壤反硝化势和气态产物排放特征,阐明其影响因素,对于制定合理的利用规划和农业管理措施,减少氮素的负面环境影响具有重要的意义。为此,本研究在江西鹰潭选取林地、竹林、茶园、旱地农田 4 种利用方式的红壤作为研究对象,采用实验室培养试验方法,对不同土地利用方式下的红壤反硝化作用进行研究,以期明确:①土地利用方式对红壤反硝化势的影响及其作用机理;②反硝化气态产物 N2O 和 N2的排放及其影响因素。
1 材料与方法
1.1 研究区概况
供试土样采自我国典型的红壤区江西省鹰潭市。研究区年平均降雨量为1 785 mm (30 a 均值),年平均温度为18.4 °C(30 a 均值)。自然植被以马尾松(Pinus massoniana Lamb)、栎木(Quercus Mongolia)和杉木(Cunninghamia lanceolata(Lamb.)Hook.)为主。目前主要利用方式为林地、茶园、竹林、旱地和稻田等。化肥大量施用于稻田、旱地和茶园上,旱地有施用石灰改良酸性土壤的传统[3]。选取林地、茶园、竹林和旱地4 种利用方式,每种利用方式选取不同的3个地点作为3 次重复,共计12 个采样地点。于2017年10 月,在每一个地点随机选取5 个点,采集0 ~20 cm 土层土样,然后充分混合作为一个样品。所有样品过2 mm 筛,分成3 份,1 份风干,用于测定土壤理化性质,1 份放于 -80 °C 冰箱中保存,用于提取DNA 测定土壤微生物性质,1 份放于4 °C 冰箱中保存,用于测定反硝化势和气态产物排放速率。
1.2 厌氧培养试验
本研究采用厌氧(淹水、培养瓶顶空充氮气)、土壤中加入KNO3、25 °C 恒温条件培养方法,测定反硝化势和气态产物N2O 和N2排放速率。每个土壤样品称取10 份保鲜土样,每份20 g(干土重),分别装入250 ml 三角瓶中,用带气体采样口的硅橡胶塞密封。设置加乙炔和不加乙炔2 个处理,不加乙炔处理用于测定N2O 的排放速率,加乙炔和不加乙炔处理的差值用于计算N2的排放速率,每个处理5 次重复。具体培养方法:在培养开始前,加乙炔处理的培养瓶内先加入10% 的乙炔,好氧状态下预培养24 h,以确保乙炔在土壤孔隙结构中充分扩散,充分发挥抑制效果,不加乙炔处理同样预培养24 h。预培养结束后,所有处理按水︰土为1︰1 加入蒸馏水,然后加入50 mg/kg 的KNO3,马上塞紧硅橡胶塞,连接到抽真空装置上,进行抽真空-充入高纯氮气操作,重复3 次,每次10 min。之后,马上用20 ml 注射器从加乙炔处理培养瓶中取出一定量的气体,马上加入相同体积的乙炔,使培养瓶内乙炔的浓度达到10%。随后将所有培养瓶置于摇床上震荡15 min (25℃,250 r/min),再置于25 ℃ 恒温培养箱内培养6 h后,采集气体样品,测定N2O 和CO2浓度。采样前先用20 ml 注射器反复抽提培养瓶中气体,使其充分混合,然后采集三角瓶上部空间气体20 ml,用气相色谱仪(Agilent 7890)测定N2O 和CO2浓度。分别在培养开始的6、24、48、72 h 采集气体样品,每次采样前均进行如上所述的抽真空-充氮气-加乙炔-振荡操作,并培养6 h。
1.3 样品分析方法
土壤 pH 用 DMP-2 mV/pH 计 (Quark Ltd,Nanjing, China)测定,土:水为1:5(m/V);土壤有机碳的测定用重铬酸钾容量法;土壤全氮的测定用半微量开氏法。
土壤DNA 的提取及反硝化功能基因丰度的检测参照Yu 等[12]的方法:称取0.5 g 置于 -80 ℃ 冰箱中保存的供试土壤,用FastDNA SPIN DNA 提取试剂盒(MP Biomedicals), 按说明书上的步骤进行土壤总DNA的提取。用于定量反硝化功能基因nirK,nirS,nosZ的引物,如表1 所示。定量PCR 的扩增条件为95 ℃ 预变性2 min,95 ℃ 变性10 s,58 ℃ 退火20 s,72 ℃延伸20 s,循环40 次。每个样品设置3个测量重复,阴性对照以ddH2O 代替模板DNA。扩增产生的溶解曲线和琼脂糖凝胶电泳分析用于检测扩增反应的特异性。
1.4 数据处理和统计方法
反硝化过程中,N2O 和N2产生速率采用以下公式计算:
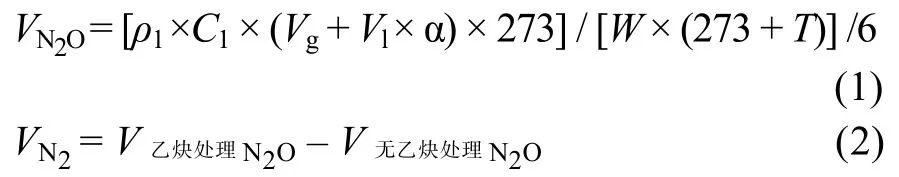
式中:VN2O为N2O 产生速率(μg/(kg·h));V乙炔处理N2O和V无乙炔处理N2O分别为加乙炔处理和未加乙炔处理的N2O 产生速率(μg/(kg·h));ρ1为标准状态下N2O-N 的浓度(1.25 g/L);C1为N2O 气体浓度(10–9L/L);Vg是培养瓶上部有效空间体积(ml);Vl为液体体积(ml);α为Bunsen 校正系数,25 °C 时为0.549;W为烘干土重(kg);T为测定气体时的温度,25 °C。累积产生量为相邻2 次测定的气体产生速率的平均值与测定时间间隔乘积的累加值。
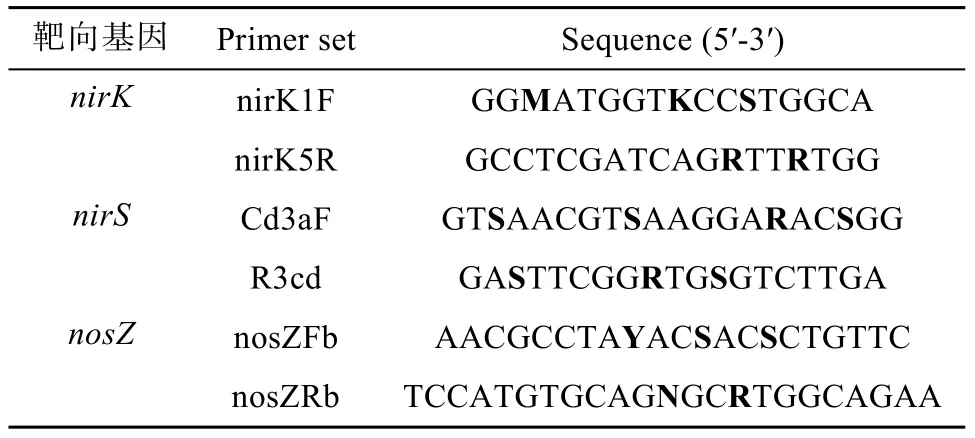
表1 定量PCR 的引物序列Table 1 Primers used for real-time PCR
在反硝化研究中,土壤反硝化势通常有两种表征方法:①用培养过程中NO–3-N 减少量表征;②用培养过程中气态产物的产生量表征。许多研究表明,NO–3-N 加入土壤后,在极短的时间(几小时,甚至是几十分钟)内会大量地被土壤固定[14],这部分NO–3-N减少量并没有发生反硝化,使用NO–3-N 减少量表征土壤反硝化势存在过高估算反硝化势的问题,因此,本研究采用气态产物的产生总量表征土壤反硝化势。文中用反硝化势来表示土壤反硝化作用强度,是文献中对在淹水、厌氧、密闭条件下土壤中加入NO–3-N 而不加有机碳所得到的反硝化强度的专指[15]。本文中反硝化势(N,μg/(kg·h)) 为N2O 和N2产生速率之和。
1.5 数据分析
采用SPSS 统计软件中的Pearson’s rank 方法和逐步回归方法分析反硝化势、N2O 和N2排放速率、N2/N2O 与土壤性质的关系。采用方差分析比较不同利用方式土壤间反硝化势N2O 和N2排放速率、N2/N2O,以及主要土壤性质的差异显著性。
2 结果
2.1 土壤性质
供试土壤均为酸性,竹林土壤pH 最低(4.49),旱地农田土壤最高(4.84)(表2)。土壤有机碳含量为9.46 ~30.47 g/kg,其中茶园土壤有机碳含量最高 (30.47 g/kg),旱地土壤最低 (9.46 g/kg)。土壤全氮含量 0.83~2.25 g/kg,也是茶园最高,旱地最低。林地土壤C/N最高 (21.51),旱地土壤最低 (11.48)。厌氧培养期间,林地、茶园、旱地和竹林土壤CO2累积排放量分别为C 297.4、389.2、235.1 和561.1 mg/kg,其中茶园土壤显著高于其他3 种利用方式土壤,旱地土壤CO2累积排放量最低。

表2 供试土壤理化性质Table 2 Physicochemical properties of soils under different land use types
2.2 nirS、nirK 和nosZ 基因丰度
林地、茶园、旱地和竹林土壤nirS基因丰度分别为5.50×106、5.86×106、5.57×106和5.85×106copies/g,不同利用方式间没有显著的差异(图1)。林地、茶园、旱地和竹林土壤nirK基因丰度分别为6.51× 106、6.79×106、6.46×106和7.05×106copies/g,其中竹林土壤nirK基因丰度显著高于其他3 种利用方式,其次是茶园土壤,林地和旱地最低。旱地土壤nosZ基因丰度最低(6.57×106copies/g),显著低于其他3 种利用方式土壤(图1)。nirS基因丰度与CO2累积排放量呈正相关关系(P=0.05);nirK基因丰度与土壤总有机碳(P<0.05)和CO2累积排放量(P<0.01)呈显著的正相关关系;nosZ基因丰度也与土壤总有机碳(P<0.05)和CO2累积排放量(P<0.05)呈显著的正相关关系。逐步回归分析结果表明,土壤CO2累积排放量和有机碳含量分别可以解释不同利用方式土壤nirK基因丰度变化的 75% (P<0.001)和nosZ基因丰度变化的55%(P<0.01)。
2.3 N2O 和N2 排放速率
不同利用方式土壤N2O 和N2排放速率差异明显(图2)。在培养期间,林地、茶园、竹林土壤的N2O排放速率均逐渐升高,在72 h 达到峰值,而旱地土壤N2O 排放速率变化不大。整个培养期间,林地、茶园、旱地和竹林土壤N2O 平均排放速率分别为N 25.89、43.20、1.38 和51.75 µg/(kg·h) (图2)。旱地土壤N2O 平均排放速率显著低于竹林和茶园土壤,与林地差异不显著;竹林土壤N2O 平均排放速率最高,但是与林地和茶园差异不显著。N2O 平均排放速率与土壤有机碳(P<0.05)和厌氧培养期间土壤CO2累积排放量(P<0.01)呈显著的正相关关系;N2O 平均排放速率随土壤pH 的升高呈显著的指数递减趋势(P<0.01)(图3)。N2O 平均排放速率与测定的反硝化功能基因丰度没有显著的相关性。逐步回归分析结果表明,土壤CO2累积排放量是造成不同利用方式红壤N2O 平均排放速率差异的主要原因,可以解释N2O 平均排放速率变化的58% (P<0.01)。
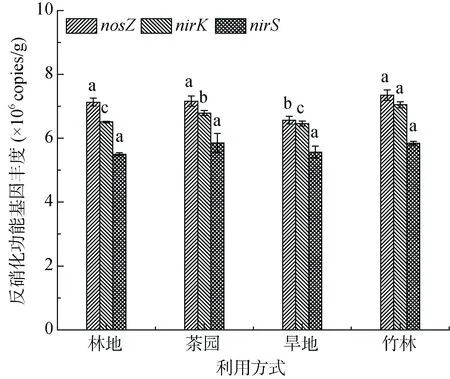
图1 不同利用方式土壤nirS、nirK 和nosZ 基因丰度Fig. 1 Abundances of nirS, nirK and nosZ genes in soils under different land use types
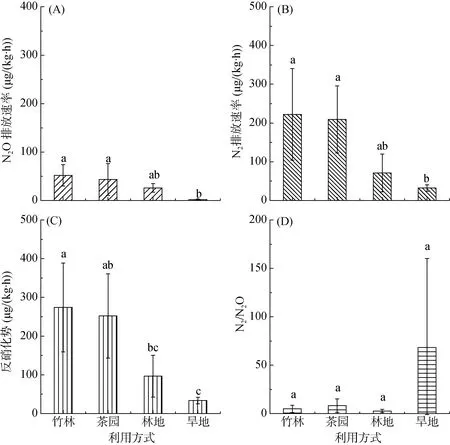
图2 不同利用方式土壤N2O(A)、N2(B)排放速率,反硝化势(C)和N2/N2O(D)Fig. 2 Emission rates of N2O (A) and N2 (B), denitrification potential (C) and N2/N2O (D) ratios in soils under different land use types
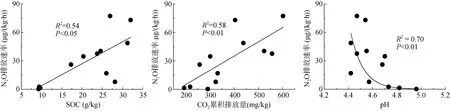
图3 N2O 平均排放速率与土壤有机碳、厌氧培养期间土壤CO2 累积排放量、土壤pH 的关系Fig. 3 Relationships between average N2O emission rate and SOC, soil CO2 cumulative emission during anaerobic culture, soil pH
不同利用方式土壤N2排放速率随着培养时间明显增加,特别是在30 h 后,竹林和茶园土壤N2排放速率急剧增加。整个培养期间,林地、茶园、旱地和竹林土壤N2平均排放速率分别为N 70.81、209.05、32.17 和222.18 µg/(kg·h) (图2)。与N2O 平均排放速率相似,旱地土壤N2平均排放速率显著低于竹林和茶园土壤,与林地差异不显著;竹林土壤N2平均排放速率最高,但是与林地和茶园差异不显著。N2平均排放速率与土壤有机碳(P<0.05)和厌氧培养期间土壤CO2累积排放量(P<0.01)呈显著的正相关关系(图4)。N2平均排放速率与测定的反硝化功能基因丰度没有显著的相关性。逐步回归分析结果表明,土壤CO2累积排放量是造成不同利用方式红壤N2排放速率差异的主要原因,可以解释N2排放速率变化的59% (P<0.01)。
不同利用方式土壤反硝化气态产物N2/N2O 平均值为2.8 ~ 68.4(图2D)。其中,旱地土壤N2/N2O 比值最大(68.4),其次是茶园(8.3),再次是竹林(4.9),林地最小(2.8)。但是,由于空间变异极大,不同利用方式间N2/N2O 比值差异不显著。N2/N2O 与土壤pH 呈显著的正相关关系(P<0.05)。但是N2/N2O 与土壤有机碳,以及测定的反硝化功能基因丰度没有明显的相关性。
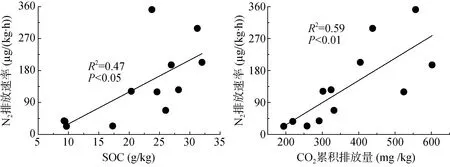
图4 N2 平均排放速率与土壤有机碳和厌氧培养期间土壤CO2 累积排放量的关系Fig. 4 Relationship between average N2 emission rate and SOC, soil CO2 cumulative emission during anaerobic culture
2.4 反硝化势
本研究采用气态产物的产生量,即N2O 和N2排放速率的和,表征土壤反硝化势。培养期间,林地、茶园、旱地和竹林土壤反硝化势分别为N 96.70、252.25、33.54 和273.11 µg/(kg·h) (图2C)。旱地土壤反硝化势显著低于竹林和茶园土壤,与林地差异不显著;竹林土壤反硝化势最大,显著高于林地,但与茶园差异不显著。反硝化势与土壤有机碳(P<0.05)、厌氧培养期间土壤CO2累积排放量(P<0.01)、nirS基因丰度(P<0.05)和nirK基因丰度(P<0.05)呈显著的正相关关系(图5)。逐步回归分析结果表明,土壤CO2累积排放量是造成不同利用方式红壤反硝化势差异的主要原因,可以解释反硝化势变化的 66%(P<0.01)。
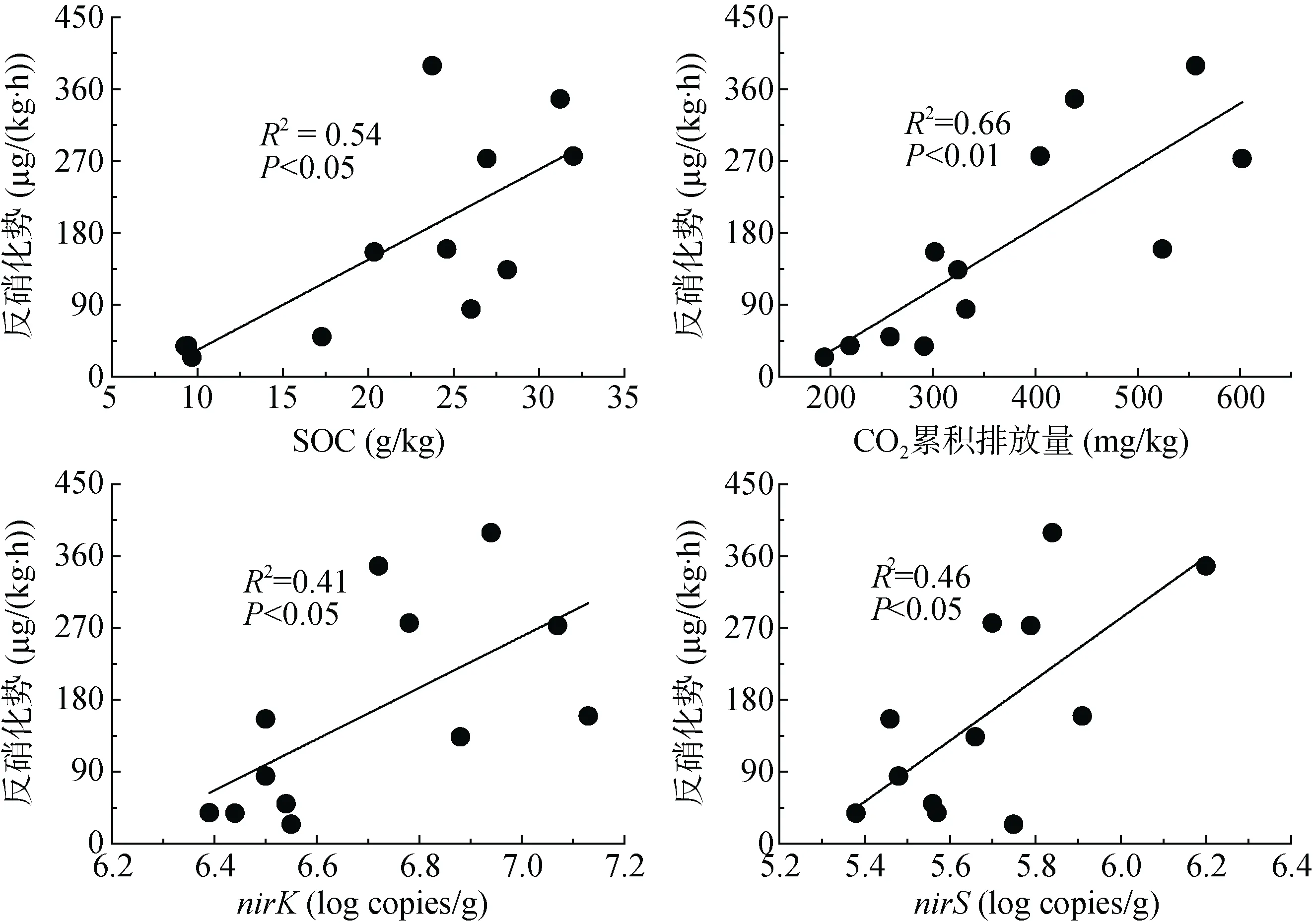
图 5 反硝化势与土壤有机碳、厌氧培养期间土壤CO2 累积排放量、nirS 和nirK 基因丰度的关系Fig. 5 Relationships between denitrification potential and SOC, soil CO2 cumulative emission during anaerobic culture, nirS and nirK gene abundances
3 讨论
本研究结果表明,在严格厌氧(淹水、培养瓶顶空充氮气)和添加NO底物的条件下,所有供试红壤N2排放速率均高于N2O,特别是在pH 较高的旱地红壤N2/N2O 高达68.4。不同利用方式红壤反硝化势、N2O 和N2排放速率存在明显的差异,其中旱地红壤反硝化势、N2O 和N2排放速率均最低,表明土壤pH的提升并没有增加旱地红壤的反硝化损失风险和N2O 排放速率。土壤有机碳,特别是易矿化有机碳含量,是影响红壤反硝化作用和N2O 和N2排放速率的主要因素,土壤pH 对气态产物中N2/N2O 有明显的影响。
3.1 土壤有机碳是控制不同利用方式红壤反硝化势、N2O 和N2 排放速率的主要因素
反硝化作用是需要获得电子的异养呼吸过程[16]。土壤有机碳矿化过程是主要的提供电子的过程,而且还能为反硝化微生物提供碳源和能源,所以土壤有机碳是影响反硝化作用的重要因素,有机碳的矿化过程是反硝化的主要驱动因子[17]。本研究中,厌氧培养期间CO2累积排放量与反硝化势存在显著正相关关系(P<0.01),其相关系数(r=0.81)高于总有机碳含量与反硝化势的相关系数(r=0.73)。这一结果说明,与总有机碳含量相比,易矿化碳与反硝化势的关系更为密切,土壤嫌气易矿化态碳量是控制红壤反硝化势的重要限制因子,土壤有机碳矿化量大,为反硝化作用提供更多的电子,并为反硝化微生物提供更多的能量和碳源。本研究中,反硝化功能基因nirS、nirK、nosZ的丰度均与培养期间CO2累积排放量呈显著的正相关关系,进一步支持了我们的结论。前人研究结果也表明,以CO2排放量表征的易矿化碳与以气态产物产生量表征的反硝化势呈显著的正相关[18-20]。本研究中,旱地红壤易矿化有机碳含量最低,所以其反硝化势也最低;竹林和茶园易矿化有机碳含量较高,其反硝化势也较高。土壤有机碳也可以促进反硝化中间产物N2O 产生,本研究结果表明,N2O 排放速率随CO2累积排放量增加而增加(P<0.01),其可以解释不同利用方式红壤N2O 排放速率变化的58% (P<0.01);同时N2平均排放速率也与土壤CO2累积排放量呈显著的正相关关系(P<0.01),可以解释不同利用方式红壤N2排放速率变化的59% (P<0.01)。土壤CO2累积排放量表征的易矿化碳是造成不同利用方式红壤N2O和 N2排放速率差异的主要原因。但是没有发现N2/N2O 与土壤有机碳之间存在显著的相关性。
3.2 土壤pH 影响不同利用方式红壤反硝化气态产物N2/N2O
本研究结果表明,N2/N2O 与土壤pH 呈显著的正相关关系(P<0.05),而且N2O 排放速率随土壤pH的升高呈显著的指数递减趋势(P<0.01)(图3)。通常认为,N2O 还原酶对酸性条件比较敏感,因此酸性土壤有利于N2O 产生,N2/N2O 随pH 升高而升高[7,11,21-22]。虽然旱地红壤反硝化势和气态产物N2O 和N2排放速率都是不同利用方式土壤中最低的,但是由于农田管理方式,如施石灰等,导致旱地红壤pH 较高,使得旱地气态产物N2/N2O 最大。Koskinen 和Keeney[9]报道在土壤pH 接近中性条件下(pH 6.9),N2是主要产物,而酸性土壤条件(pH 4.6)则有利于N2O 的排放。因此,土壤pH 可作为反硝化作用气态产物中N2/N2O的预测参数[23]。土壤pH 是影响土壤微生物群落组成的重要因素[24],其影响N2/N2O 的原因主要是酸性条件抑制N2O 还原酶活性,从而导致N2O 排放增加[21,25]。有研究报道nirK、nirS和nosZ功能基因丰度与pH 存在显著的正相关关系[22]。然而,在本研究结果没有发现nirK、nirS和nosZ功能基因丰度与pH 的关系;而逐步回归分析结果发现,土壤CO2累积排放量和有机碳含量分别是控制nirK和nosZ基因丰度的关键因素。也有研究认为N2O 还原为N2的量可能与nosZ基因的数量无关,而是与nosZ基因的活性有关[26]。所以,土壤pH 影响红壤反硝化气态产物N2/N2O 的微生物机制仍需要进一步研究。
需要指出的是,本研究使用的乙炔抑制法也存在一些缺陷,会影响反硝化势和气态产物的测定结果,主要表现在培养过程中乙炔会发生降解或作为一种碳源被微生物利用,进而导致其浓度下降,降低抑制效果;另外,乙炔在土壤空隙中扩散速率较低,扩散不完全,从而影响抑制效果,进而低估土壤反硝化势[27-28]。
4 结论
本研究结果表明,土地利用方式对红壤反硝化势、N2O 和N2排放速率有明显的影响。旱地红壤反硝化势、N2O 和N2排放速率均最低,茶园和竹林较高。土壤有机碳,特别是CO2累积排放量表征的易矿化碳是造成不同利用方式红壤反硝化势、N2O 和N2排放速率差异的主要原因。反硝化功能基因nirS、nirK、nosZ 的丰度均与CO2累积排放量呈显著的正相关关系,进一步支持了以上结论。旱地红壤N2/N2O最大,其次是茶园,再次是竹林,林地最小,土壤pH 是影响N2/N2O 的主要因素。但是土壤pH 影响红壤反硝化气态产物N2/N2O 的微生物机制仍需要进一步研究。
