刺芪参胶囊活性成分含量测定及安全性评价
2020-06-13王晓林戴鹂莹钟方丽
王晓林 - 戴鹂莹 - 邸 松 钟方丽 -
(吉林化工学院化学与制药工程学院,吉林 吉林 132022)
中药类保健食品是在中医药理论指导下以中药材为主要成分的具有保健功能的特殊食品[1]。刺芪参胶囊是由人参、黄芪、刺玫果3味中药材制成的保健食品,其中,人参具有抗氧化、增强免疫、降血糖等活性[2-4],作为新食品原料,其主要应用范围已逐渐从临床医疗扩大到保健、食品等领域[5];刺玫果含有三萜皂苷、黄酮、多糖类活性成分,具有较强的增强免疫及药食同源的开发价值[6-7],刺玫果与人参可以配伍使用[8]。黄芪对免疫系统具有良好的调节作用[9],能提高人体的活力[10]、运动性能,具有抗疲劳的作用[11-12],人参与黄芪配伍使用可提高机体免疫力[13-14]。课题组拟将人参、黄芪、刺玫果三者配伍,按《保健食品检验与评价技术规范》测定其标志性成分人参皂苷及多糖的含量,并进行急性毒性试验、三项遗传毒性试验等试验,旨在为其研究开发提供依据。
1 试验部分
1.1 试剂与仪器
刺芪参胶囊:0.4 g/粒,每粒含人参0.187 5 g、黄芪0.312 5 g、刺玫果0.375 0 g,自制;
人参皂苷Rg1、Re、Rb1对照品:纯度≥98.0%,北京马踏飞燕有限公司;
葡萄糖对照品:纯度≥98.0%,上海源叶生物有限公司;
乙腈、甲醇:HPLC级,天津市大茂化学试剂厂;
蒽酮:分析纯,上海源叶生物有限公司;
生化试剂盒:四川新健康成生物股份有限公司;
血液学试剂盒:深圳迈瑞生物医疗电子股份有限公司;
环磷酰胺:江苏盛迪医药有限公司;
1.8-二羟基蒽醌:上海晶纯试剂有限公司;
氧化型辅酶II、2-氨基芴:美国Fluka公司;
敌克松:上海金桥化工厂;
叠氮钠:ACROS公司;
水为重蒸馏水;
其他化学试剂均为分析纯;
高效液相色谱仪:Agilent-1260型,搭载DAD阵列检测器,安捷伦科技有限公司;
全自动生化分析仪:7600型,日本日立株式会社;
奥林巴斯生物显微镜:CX31型,日本Olympus Corporation公司;
紫外分光光度计:TU-1810型,北京普析通用仪器有限公司;
兽用全自动血液细胞分析仪:BC-5300Vet型,武汉盛世达医疗设备有限公司。
1.2 试验动物
SPF级昆明种小鼠、SPF级SD大鼠:动物生产许可证号为SCXK(湘)2016-0002,动物检疫时间为3~5 d,湖南斯莱克景达实验动物有限公司;
辐照灭菌清洁级大鼠饲料:生产许可证号为SCXK(京)2014-0010,北京科澳协力饲料有限公司。
1.3 试验方法
1.3.1 刺芪参胶囊中人参皂苷含量的测定 按《中国药典》2015年版一部中的方法测定。
(1) 色谱条件:以十八烷基键和硅胶为填充剂,乙腈为流动相A,水为流动相B,检测波长203 nm,流速1.0 mL/min,洗脱程序见表1。
(2) 线性关系的考察:精密称取人参皂苷Rg1、Re、Rb1对照品5.31,4.91,4.87 mg,加甲醇定容至5 mL容量瓶中,精密吸取上述混合对照品溶液0.2,0.5,1.0,2.0,3.0,6.0 mL置于10 mL容量瓶中定容,在色谱条件下进样10 μL,记录峰面积。

表1 梯度洗脱程序Table 1 Flow phase gradient elution procedure
(3) 供试品溶液配制:称取研磨混合均匀的样品2.50 g,采用氯仿用索氏提取器加热回流脱脂3 h,将氯仿液回收再利用,剩余药渣的溶剂挥干,将滤纸筒和药渣一起移至具塞锥形瓶中,精密加入50 mL正丁醇饱和溶液,密塞,放置过夜,超声处理30 min,过滤,弃去初滤液,精密量取续滤液25 mL于蒸发皿中蒸干溶剂,加适量甲醇将蒸发皿中的残渣溶解,并转移到5 mL容量瓶中,甲醇定容,得供试品溶液。
(4) 方法学考察试验:精密吸取人参皂苷Rg1、Re、Rb1的混合对照品溶液,按规定色谱条件下重复进样6次,记录峰面积,计算RSD值,考察仪器精密度。取同一批样品制备6份供试品溶液,按色谱条件进样,记录人参皂苷Rg1、Re、Rb1的峰面积,计算样品中人参皂苷的含量及RSD值,考察方法的重复性。
(5) 检出限试验:精密吸取质量浓度分别为21.24,19.64,19.48 μg/mL的人参皂苷Rg1、Re、Rb1的混合对照品溶液进行稀释,按规定色谱条件进样,以信号噪音比≥3为指标,对仪器检出限进行考察。
(6) 加标回收率试验和刺芪参胶囊中人参皂苷含量的测定:称取研磨混合均匀的样品6份(已知人参皂苷含量),精密称定,将适量的质量浓度已知的人参皂苷Rg1、Re、Rb1对照品溶液加入到6份样品中,使加入的对照品与样品质量比分别约为1∶1,制备6份供试品溶液,按色谱条件于203 nm处测定峰面积值,计算加标回收率。
1.3.2 刺芪参胶囊中多糖含量的测定 参照《保健食品功效成分检测方法》中的蒽酮—硫酸分光光度测定法。
(1) 线性关系的考察:精密称取葡萄糖对照品5.55 mg,加水定容至50 mL容量瓶中,配制葡萄糖对照品溶液,精密吸取上述对照品溶液0.2,0.4,0.6,0.8,1.0,1.2 mL于10 mL比色管中,加水至2.0 mL,制备系列葡萄糖对照品溶液,按照规定的方法显色,测定625 nm处的吸光度。
(2) 供试品溶液配制:称取研磨混合均匀的样品于100 mL容量瓶中,加水80 mL,沸水浴加热1 h,冷却,定容,过滤,取滤液50 mL,加糖化酶0.5 g于60 ℃以下水浴水解1 h,灭酶,冷却,定容至50 mL,过滤,取续滤液5.0 mL于离心管中,加入无水乙醇20 mL,混匀,于4 ℃冰箱静置4 h,离心,弃去上清液,残渣用80%乙醇洗涤,离心,残渣加水溶解并定容至25 mL容量瓶,作为供试品溶液。
(3) 方法学考察试验:精密吸取质量浓度为0.11 mg/mL的葡萄糖对照品溶液,显色,测定625 nm处的吸光度,重复测定6次,考察仪器精密度。取同一批样品制备6份供试品溶液,显色,测定625 nm处的吸光度,计算样品中多糖的平均含量和RSD值,考察方法的重复性。
(4) 加标回收率试验和刺芪参胶囊中多糖含量的测定:称取研磨混合均匀的样品6份(已知多糖含量),精密称定,将适量质量浓度已知的葡萄糖对照品溶液加入到6份样品中,使加入的对照品与样品质量比分别约为1∶1,按照供试品溶液制备方法进行制备,显色,测定625 nm处的吸光度,计算回收率。
1.3.3 大、小鼠急性经口毒性试验 采用最大耐受剂量法试验。经口灌胃给予刺芪参胶囊供试液,连续观察14 d,记录动物的中毒症状和死亡情况,试验结束后称重、处死动物、解剖检查[15]。
1.3.4 Ames试验 采用鼠伤寒沙门氏菌组氨酸缺陷型TA97a、TA98、TA100、TA102 4株标准突变型菌株进行试验,并以多氯联苯(PCB)诱导的大鼠肝微粒体酶(S-9)作为体外代谢活化系统。采用平板掺入法,在加与不加S-9的条件下进行测试,计数每皿回复突变菌落数[16]。
1.3.5 小鼠骨髓细胞微核试验 按照30 h两次灌胃法试验,每次间隔24 h。试验时高、中、低剂量组动物使用浓度为0.500,0.250,0.125 g/mL的供试液;阳性对照组动物使用浓度为2.000 mg/mL的环磷酰胺溶液。灌胃体积为20 mL/kg·BW,按照2003年版的《保健食品检验与评价技术规范》中该项试验的方法进行操作,计算微核的千分率及嗜多染红细胞与正染红细胞比值[17]。
1.3.6 小鼠精子畸形试验 高、中、低剂量组动物使用的供试液同1.3.5,设溶剂对照及环磷酰胺阳性对照组(50 mg/kg·BW),阳性对照组动物使用浓度为2.500 mg/mL的环磷酰胺溶液。各组动物灌胃体积按20 mL/kg·BW每日经口灌胃一次,连续灌胃5 d,按《保健食品检验与评价技术规范》中小鼠精子畸形试验中的规定,记录畸形类型及精子畸形率[18]。
1.3.7 大鼠长期喂养(30 d)试验
(1) 大鼠及分组:选用断乳SD大鼠80只,对照组每组20只大鼠,设3个剂量组(相当于人体推荐量的25,50,100倍)。采用喂饲法,样品各剂量组喂饲加样饲料,对照组喂饲不加样的基础饲料,连续喂养30 d。
(2) 观察指标:观察大鼠是否中毒、死亡及行为和表现。每周称1次体重和2次食物摄入量,计算每周食物利用率、总的食物利用率、总进食量及总增重。于试验结束时禁食16 h取腹主动脉血,测定血液学指标和血清生化指标;试验结束时处死大鼠,解剖,观察其内脏的变化,对其肝、肾、脾、睾丸进行称重,计算其脏体比,取肝、肾、脾、胃肠、睾丸(卵巢)作组织病理学检查[19]。
1.4 数据处理
小鼠骨髓细胞微核试验用泊松分布和卡方检验进行统计学处理,小鼠精子畸形试验采用X2检验进行统计学处理,长期喂养(30 d)试验采用SPSS统计软件对各项检测数据作单因素方差分析和(或)t检验。
2 结果与讨论
2.1 人参皂苷含量的测定
2.1.1 线性关系 由表2可知,人参皂苷Rg1、Re、Rb1分别在21.24~637.20,19.64~589.20,19.48~584.40 μg/mL呈线性关系。
2.1.2 方法学考察 结果(表3)表明,仪器精密度、方法重复性良好。

表2 线性关系考察结果Table 2 The results of linear relationship investigation
表3 方法学考察试验数据

Table 3 Methodological experimental data (n =6)%
2.1.3 检出限 试验表明,当人参皂苷Rg1、Re、Rb1对照品质量浓度分别为5.31,4.91,4.87 μg/mL时,仪器的信号噪音比为3.8~5.9,上述浓度即定为利用该仪器检测人参皂苷Rg1、Re、Rb1的检出限值。
2.1.4 加标回收率试验和刺芪参胶囊中人参皂苷含量测定 由表4可知,3批刺芪参胶囊中人参皂苷含量分别为0.283,0.279,0.274 g/100 g(以人参皂苷Rg1、Re、Rb1的三者之和计)。
2.2 多糖含量的测定
2.2.1 线性关系 以葡萄糖对照品质量的数据为横轴,测定的吸光度值为纵轴,绘制标准曲线,回归方程为y=4.558 4x-0.004 7,R2=0.999 4,说明葡萄糖质量在0.022~0.132 mg内呈线性关系。

表4 加样回收率结果Table 4 Result of recovery tests
2.2.2 方法学考察 试验表明,仪器在检测葡萄糖对照品溶液的吸光度时,其RSD为0.39%(n=6),表明该方法的仪器精密度良好;6份供试品的多糖含量分别为3.37,3.28,3.39,3.33,3.29,3.37 g/100 g,平值为3.34 g/100 g,RSD为1.37%,表明该方法的重复性良好。
2.2.3 加标回收率试验和刺芪参胶囊中多糖含量测定
由表5可知,3批刺芪参胶囊中多糖含量分别为3.12,3.29,3.38 g/100 g(以葡萄糖计)。
2.3 急性毒性试验
由表6可知,雌、雄昆明小鼠和SD雌、雄大鼠在观察期内均未出现死亡和明显中毒症状,刺芪参胶囊对大、小鼠急性经口MTD值>24.0 g/kg·BW,属于无毒级。
2.4 遗传毒性试验
2.4.1 Ames试验 由表7、8可知,刺芪参胶囊各剂量对各试验菌株在加与不加S-9代谢活化系统情况下,回复突变数均未小于自发回复突变菌落数的2倍,并且没有剂量—反应关系,而阳性对照组的平均回变菌落数均大于溶剂对照组2倍以上,呈现明显阳性,说明刺芪参胶囊未诱导4种菌株回变菌落数增加,Ames 试验结果为阴性。
2.4.2 小鼠骨髓细胞微核试验 由表9可知,刺芪参胶囊各剂量组小鼠骨髓PCE微核率与纯水对照组相比,无统计学意义(P>0.05),环磷酰胺对照组小鼠骨髓PCE微核率与纯水对照组相比,有统计学意义(P<0.01);未见刺芪参胶囊诱发小鼠骨髓嗜多染红细胞微核率增高,说明刺芪参胶囊在各剂量下未见致突变作用。
2.4.3 小鼠精子畸形试验 由表10可知,溶剂对照组昆明雄性小鼠精子畸形率为1.30%,刺芪参胶囊各剂量组精子畸形率为1.32%~1.42%,与纯水对照组相比,无统计学意义(P>0.05);环磷酰胺对照组精子畸形率为5.42%,与纯水对照组相比,有统计学意义(P<0.01),精子畸形类型主要表现以无定形为主。说明刺芪参胶囊未诱发小鼠精子畸形率增高。
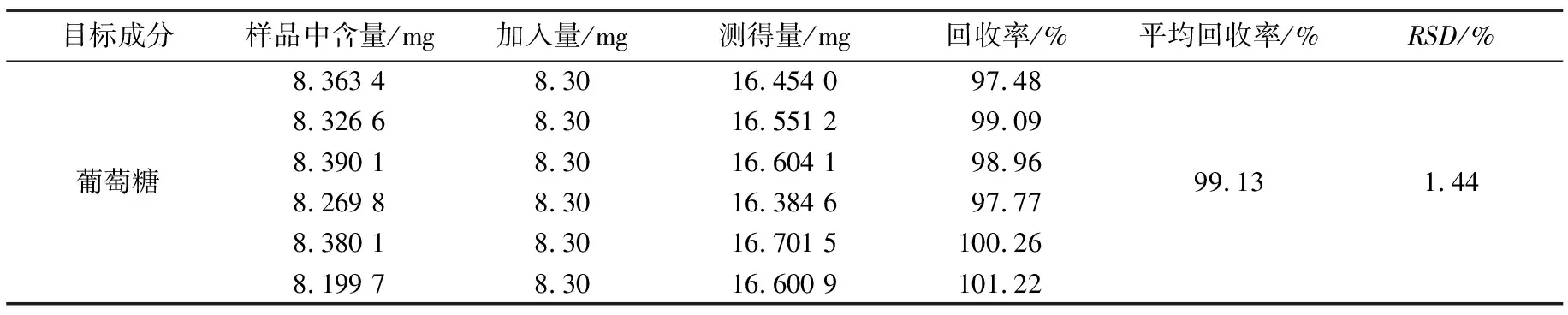
表5 加样回收率结果Table 5 Result of recovery tests
表6 急性经口毒性试验结果
Table 6 Results of acute oral toxicity test

性别剂量/(g·kg-1·BW)动物数累积死亡数MTD/(g·kg-1·BW)始重/g给予受试物第7天体重/g终重/g雌(小)24.0100>24.021.6±0.627.6±2.131.4±2.0雄(小)24.0100>24.021.6±0.834.6±2.240.0±2.4雌(大)24.0100>24.0210.0±10.9237.3±8.4245.0±7.5雄(大)24.0100>24.0211.7±7.6280.5±14.5313.2±15.6

表7 Ames试验结果Ⅰ†Table 7 Results of Ames test Ⅰ
† A为敌克松,50 μg /皿;B为叠氮钠,1.5 μg /皿;C为2-氨基芴,10 μg /皿;D为1,8二羟蒽醌,50 μg /皿。

表8 Ames试验结果Ⅱ†Table 8 Results of Ames test Ⅱ
† A为敌克松,50 μg /皿;B为叠氮钠,1.5 μg /皿;C为2-氨基芴,10 μg /皿;D为1,8二羟蒽醌,50 μg /皿。
2.5 大鼠长期喂养(30 d)试验
2.5.1 一般观察 试验表明,各剂量组雌、雄鼠在整个试验期间的活动、进食、饮水及粪便性状正常,没有发现其行为明显改变、中毒及死亡。
2.5.2 对SD大鼠体重及体重增长的影响 由表11可知,各剂量组雌、雄鼠各周体重和试验期间体重总增重与对照组相比,均无统计学意义(P>0.05)。
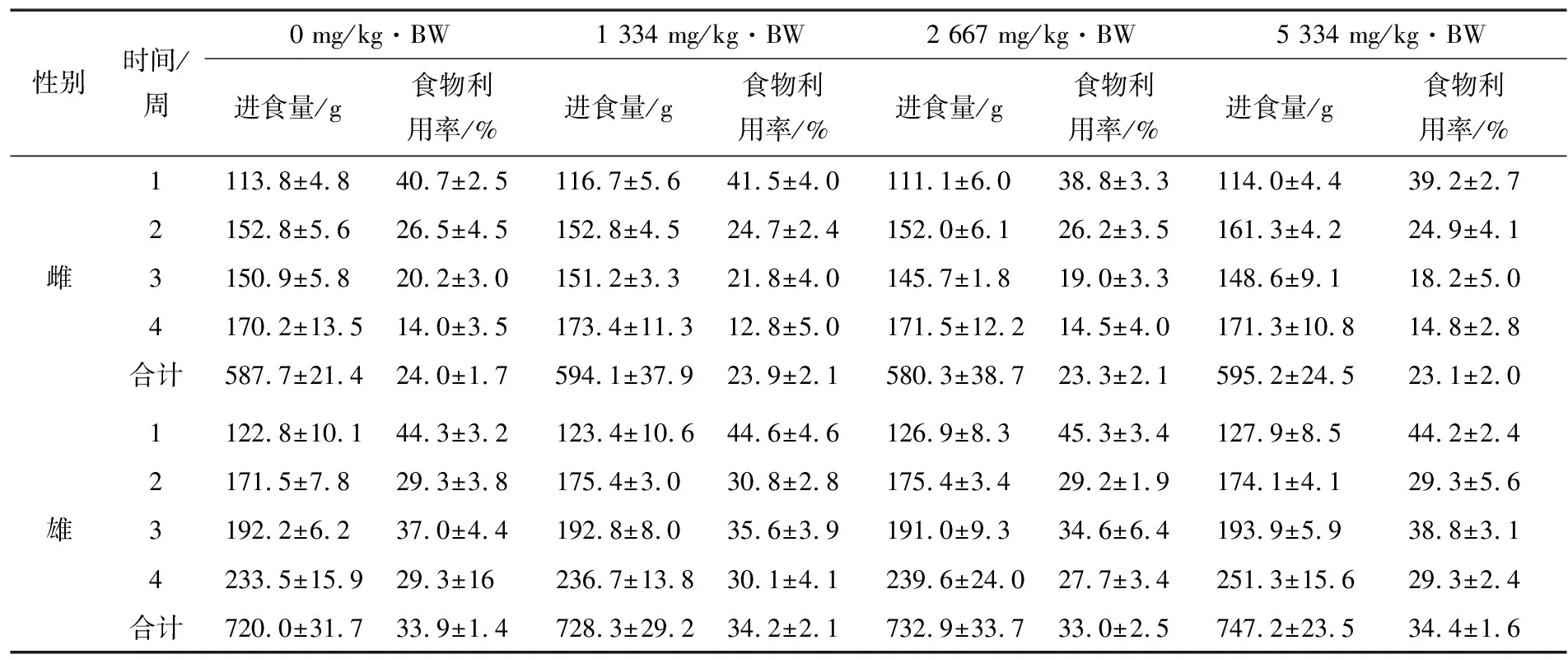
2.5.3 对SD大鼠进食及食物利用率的影响 由表12可知,各剂量组雌、雄鼠各周进食量及总进食量与对照组相比,均无统计学意义(P>0.05);各剂量组雌、雄鼠各周食物利用率及试验期间雌、雄鼠总食物利用率与对照组比较,差异均无统计学意义(P>0.05)。
2.5.4 血液学指标检查 由表13可知,各剂量组雌、雄鼠试验末期各项血液学指标与对照组相比,无统计学意义(P>0.05)。
2.5.5 血液生化指标检查 由表14可知,低剂量组雌鼠谷丙转氨酶(ALT)、谷草转氨酶(AST)、甘油三酯(TG)降低,与对照组相比,有统计学意义(P<0.01);中、高剂量组雌鼠该3项指标与对照组相比,均无统计学意义(P>0.05),故该3项指标的改变无生物学意义。各剂量组雄鼠各项生化指标和各剂量组雌鼠其他各项血液生化指标与对照组相比,均无统计学意义(P>0.05)。
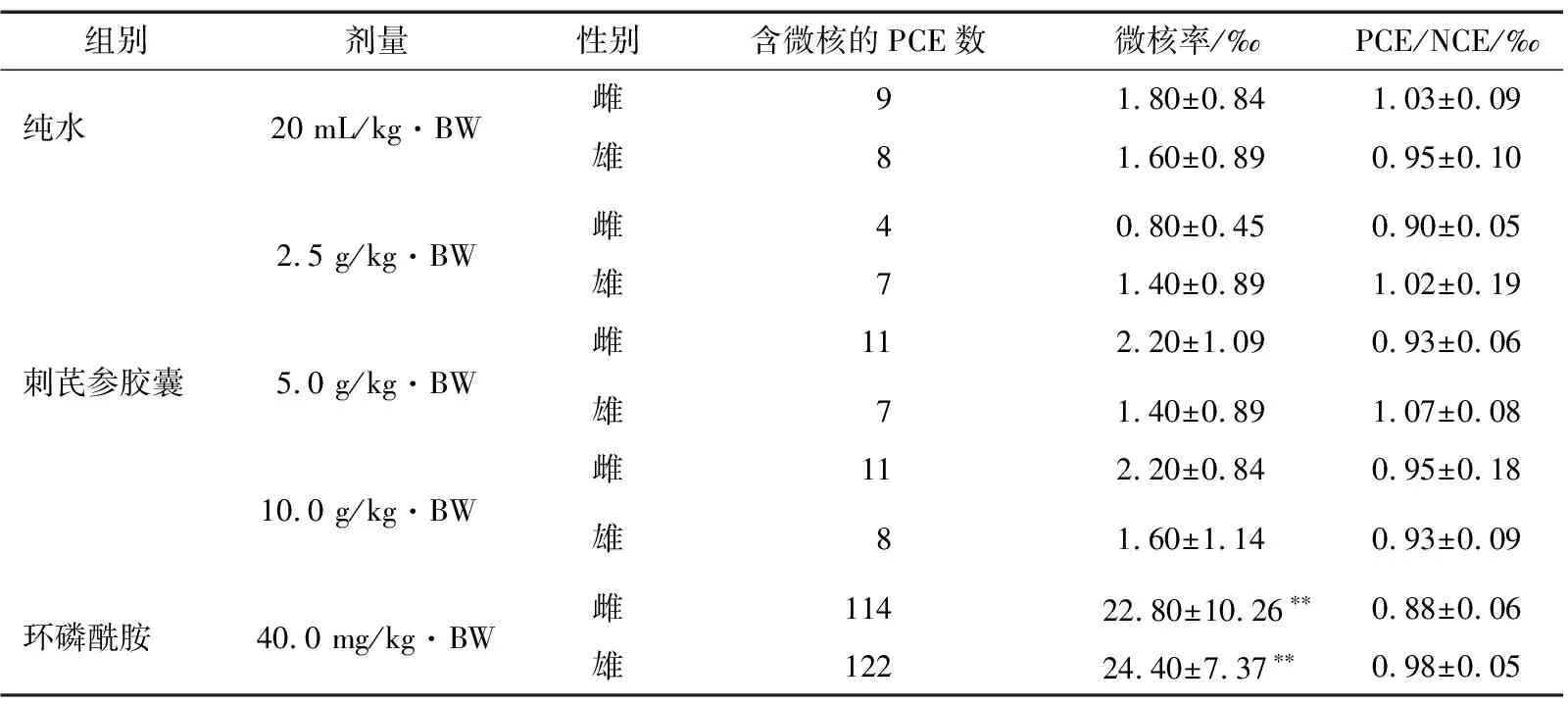
表9 小鼠骨髓嗜多染红细胞微核试验结果†Table 9 Micronucleus test of polychromatic erythrocytes in bone marrow of mice
† **与溶剂对照组相比,差异有统计学意义(P<0.01)。

表10 对小鼠精子畸形试验的影响†Table 10 The effect of Ciqishen capsules on the mouse sperm abnormality test
† **与溶剂对照组相比,差异有统计学意义(P<0.01)。

表11 刺芪参胶囊对大鼠体重的影响Table 11 The effect of Ciqishen capsules on the body weight of rats
2.5.6 脏器绝对重量和脏/体比值 由表15可知,各剂量组雌、雄鼠各项脏器重量与对照组相比均无统计学意义(P>0.05);中、高剂量组雄鼠肾脏体重比值略高于对照组,与对照组相比,有统计学意义(P<0.05),但该两项指标值在正常值范围内,故认为该两项指标的改变无生物学意义;各剂量组雌鼠各脏器系数和各剂量组雄鼠其他脏器系数与对照组相比,均无统计学意义(P>0.05)。
表12 刺芪参胶囊对大鼠各周进食量和各周食物利用率的影响
Table 12 The effect of Ciqishen capsules on the food intake and food utilization of rats each week
性别时间/周0 mg/kg·BW1 334 mg/kg·BW2 667 mg/kg·BW5 334 mg/kg·BW进食量/g食物利用率/%进食量/g食物利用率/%进食量/g食物利用率/%进食量/g食物利用率/%雌1113.8±4.840.7±2.5116.7±5.641.5±4.0111.1±6.038.8±3.3114.0±4.439.2±2.72152.8±5.626.5±4.5152.8±4.524.7±2.4152.0±6.126.2±3.5161.3±4.224.9±4.13150.9±5.820.2±3.0151.2±3.321.8±4.0145.7±1.819.0±3.3148.6±9.118.2±5.04170.2±13.514.0±3.5173.4±11.312.8±5.0171.5±12.214.5±4.0171.3±10.814.8±2.8合计587.7±21.424.0±1.7594.1±37.923.9±2.1580.3±38.723.3±2.1595.2±24.523.1±2.0雄1122.8±10.144.3±3.2123.4±10.644.6±4.6126.9±8.345.3±3.4127.9±8.544.2±2.42171.5±7.829.3±3.8175.4±3.030.8±2.8175.4±3.429.2±1.9174.1±4.129.3±5.63192.2±6.237.0±4.4192.8±8.035.6±3.9191.0±9.334.6±6.4193.9±5.938.8±3.14233.5±15.929.3±16236.7±13.830.1±4.1239.6±24.027.7±3.4251.3±15.629.3±2.4合计720.0±31.733.9±1.4728.3±29.234.2±2.1732.9±33.733.0±2.5747.2±23.534.4±1.6
表13 刺芪参胶囊对大鼠血常规的影响
Table 13 The effect of Ciqishen capsules on the blood routine of rats

剂量/(mg·kg-1·BW)RBC/(×10l2·L-1)HGB/(g·L-1)PLT/(×109·L-1)WBC/(×109·L-1)HCT/%雌雄雌雄雌雄雌雄雌雄07.53±0.438.03±0.70164.0±10.8173.7±18.2949±158996±1924.36±1.008.11±1.0847.5±3.250.0±5.41 3347.30±0.687.89±0.24157.2±12.9172.7±7.4842±104911±1213.68±1.248.83±0.9545.9±3.250.6±1.72 6677.96±0.617.51±0.57171.5±11.3165.7±9.6842±1281002±1303.76±1.197.83±2.1449.8±3.547.8±3.05 3347.62±0.647.99±0.50165.4±15.9176.5±11.4776±159889±1373.22±1.226.91±2.1548.4±4.552.0±3.4剂量/(mg·kg-1·BW)NEU/%LYM/%MON/%EOS/%BAS/%雌雄雌雄雌雄雌雄雌雄014.86±5.5311.56±4.1480.34±6.4983.40±4.263.16±1.064.17±1.381.64±0.550.86±0.410.00±0.000.01±0.031 33418.45±9.6011.71±4.1178.56±10.0482.61±4.881.94±0.874.75±1.261.05±0.630.92±0.360.00±0.000.01±0.032 66717.28±5.1611.77±2.7779.20±5.5383.83±4.042.17±1.233.19±1.451.35±0.441.20±0.380.00±0.000.01±0.035 33418.06±9.4412.39±3.0777.98±13.0883.46±3.571.63±1.773.22±1.122.26±2.530.92±0.350.07±0.220.01±0.03
表14 刺芪参胶囊对大鼠生化指标的影响†
Table 14 The effect of Ciqishen capsules on the biochemical indicators of rats

剂量/(mg·kg-1·BW)TP/ (g·L-1)ALB/(g·L-1)ALT/(U·L-1)AST/(IU·L-1)BUN/(mmol·L-1)雌雄雌雄雌雄雌雄雌雄054.7±2.153.4±2.131.5±1.030.2±1.731.3±6.732.2±8.283.2±9.787.2±11.57.48±1.284.75±0.611 33456.5±1.852.6±1.132.2±1.029.9±0.723.8±3.2∗∗36.9±9.371.2±6.1∗∗87.5±9.56.67±0.954.86±0.982 66756.3±1.953.5±1.732.3±1.030.3±0.926.6±5.834.9±7.786.0±9.584.7±10.87.32±1.045.42±0.585 33458.1±3.752.2±2.233.1±1.929.9±1.027.9±6.332.0±8.380.7±11.280.5±12.47.96±1.304.98±0.83剂量/(mg·kg-1·BW)CREA/(μmol·L-1)TG/(mmol·L-1)CHOL/(mmol·L-1)GLU/(mmol·L-1)雌雄雌雄雌雄雌雄035.4±5.725.7±3.40.47±0.100.71±0.242.30±0.202.09±0.257.12±0.766.22±0.731 33431.0±3.925.6±3.90.37±0.07∗∗0.61±0.242.42±0.482.00±0.327.58±0.847.01±0.962 66732.2±3.627.6±5.70.42±0.100.51±0.311.91±0.492.08±0.387.45±0.976.78±1.655 33433.2±6.429.8±2.60.53±0.110.54±0.212.23±0.441.82±0.248.04±0.657.78±1.83
† **与溶剂对照组相比,差异有统计学意义(P<0.01)。

表15 刺芪参胶囊对大鼠脏器重量与脏/体比的影响†Table 15 The effect of Ciqishen capsules on the organ weight and the organ / body ratio of rats
† *与溶剂对照组相比,差异有统计学意义(P<0.01)。
2.5.7 病理组织学检查 试验结束后处死动物,解剖,肉眼观察未见异常。组织病理学检查结果显示,对照组有1例雌性大鼠肝脏有轻度小灶状坏死,高剂量组有1例雄鼠肾小管变性、坏死,系动物自发病变,与刺芪参胶囊无关,对照组及高剂量组动物其余脏器未见明显病理组织学改变。
3 结论
建立了HPLC测定刺芪参胶囊中人参皂苷(以人参皂苷Rg1、Re、Rb1三者之和计)含量的方法,经测定刺芪参胶囊中人参皂苷含量为0.273 g/100 g;建立了UV测定刺芪参胶囊中多糖(以葡萄糖计)含量的方法,经测定刺芪参胶囊中多糖(以葡萄糖计)含量为3.190 g/100 g。为了科学地评价刺芪参胶囊作为保健食品的安全性,对其进行了大、小鼠的急性经口毒性试验、遗传毒性试验及大鼠30 d 喂养试验,结果表明,刺芪参胶囊对大、小鼠急性经口毒性试验结果MTD值均>24.0 g/kg·BW,属无毒性;三项遗传毒性试验结果均为阴性,表明刺芪参胶囊未见致畸变作用;刺芪参胶囊连续30 d给药没有对大鼠的血液生化指标产生影响,没有对大鼠的食物利用率、体重、进食量以及试验期间总食物利用率、增重、摄食量、主要免疫器官的脏/体比产生明显影响;动物血液学指标检查、血生化指标检查未见异常变化;未发现与刺芪参胶囊有关的病理组织学改变。综上,在试验条件下口服刺芪参胶囊无明显毒副作用。刺芪参胶囊的安全性评价按《保健食品检验与评价技术规范》(2003年)的规定进行,但该《规范》目前已失效,而新的《保健食品毒理学评价程序》仍处于征求意见阶段,待其实施后,课题组将根据相关要求对试验内容进行补充。
