卷丹百合脱毒与快繁技术研究
2020-06-13田山君牛力立田洪梅吴家丽张万萍
田山君, 裴 芸, 牛力立, 田洪梅, 吴家丽, 张万萍
(1.贵州大学农学院, 贵阳 550025; 2.安顺市农科院, 贵州 安顺 561000;3.平塘县经济作物推广站, 贵州 平塘 558300)
百合是百合科百合属多年生球根草本植物的总称。食用百合肉质鳞片含有丰富的淀粉、蛋白质、果胶等营养物质及钙、磷、铁等营养元素,因为具有极高的营养价值,成为国内外消费者喜好的蔬菜食品,具有非常广阔的栽培和市场前景[1-3]。贵州铜仁、毕节等地长期采用鳞茎、鳞片等营养体进行无性繁殖,不仅繁殖系数低、病毒积累严重,而且种球退化现象明显,影响了食用百合的品质和产量,在很大程度上制约了百合产业的发展。国内对百合组织培养技术的研究较多,但多集中在外植体的选择、培养基中植物激素配比[4-6]等方面,对百合快速扩繁过程进行全方位的研究较少。本研究以贵州铜仁地区主栽的卷丹百合为材料,研究卷丹百合组织培养的最佳消毒方法、最适外植体及最适培养基配方,以期为食用百合的规模化繁殖及开发利用提供一定的参考。
1 材料与方法
1.1 试验材料
试验所用百合于2017年4-5月采自贵州铜仁思南县,为当地主栽品种。MS为基本培养基,其他试剂NAA、6-BA、IBA等为分析纯(AR),均购自北京鼎国生物技术有限公司。
1.2 试验方法
1.2.1外植体选取
选取生长健壮、无病害的鳞茎,经热处理和催芽处理后剥离出茎尖、茎段、叶片、鳞片,清洗消毒后晾干,留取核心部分鳞片,置于光照培养箱内以26 ℃和45 ℃交替处理1个月(以下简称热处理),即白天45 ℃、夜间26 ℃,光照强度设定为1 500 lx。
1.2.2外植体消毒
待茎尖伸长2~3 cm时,将催芽培养后的百合鳞茎球剥去外层鳞片,先用75%的乙醇浸泡30 s,再用5%、10%、15% 3个浓度的次氯酸钠溶液分别处理10 min、20 min。用无菌水冲洗3~5遍,吸去表面水分,剥去百合鳞茎轴的鳞片,直至不带叶原基的茎尖生长点,接种于MS培养基上进行培养,每个处理接10瓶,每瓶接1个,10 d后统计污染率及成活率。
污染率(%)=(外植体中染菌的数量/接种的外植体总数)×100%;
成活率(%)=[1-(死亡的外植体数量+愈伤失败的外植体数量)/接种的外植体总数]×100%。
1.2.3培养基的配制及种类
基本培养基为MS,附加琼脂粉4.5 g·L-1,蔗糖30 g·L-1,pH为5.85。在不同的阶段(诱导、增殖、生根壮苗)加入不同配比的植物激素,激素浓度设计按照文献[7]、[8]的方法进行,分化增殖阶段及生根结鳞茎阶段的激素配比见表1。
表1 不同培养基种不同激素配比
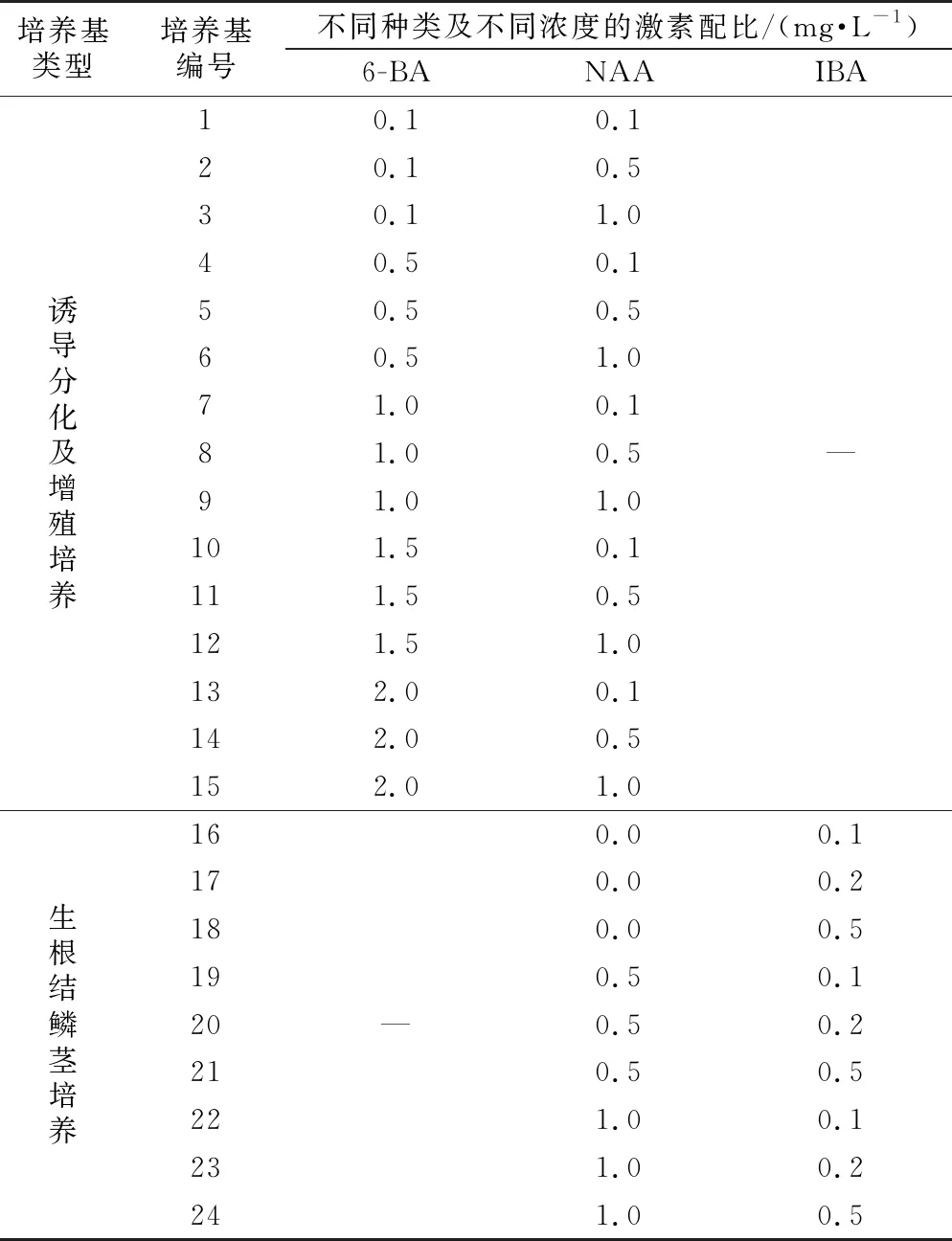
培养基类型培养基编号不同种类及不同浓度的激素配比/(mg·L-1)6-BANAAIBA诱导分化及增殖培养10.10.120.10.530.11.040.50.150.50.560.51.071.00.181.00.591.01.0101.50.1111.50.5121.51.0132.00.1142.00.5152.01.0—生根结鳞茎培养160.00.1170.00.2180.00.5190.50.120—0.50.2210.50.5221.00.1231.00.2241.00.5
1.2.4脱毒及诱导培养
1) 不同外植体筛选试验。
将已催芽的鳞茎的茎芽、茎段、叶片和鳞片分离,鳞片的1~2层为外层,3~4层为中层,5层以内为内层。流水冲洗1 h后,先用75%乙醇消毒30 s,再用10%次氯酸钠溶液消毒20 min,然后用无菌水冲洗3~5次,用无菌滤纸将表面水分吸干,接种到启动培养基(MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1)上。每种外植体接种10瓶,每瓶1株,置于培养室进行培养(温度26 ℃,光强2 000 lx,光照时间12 h·d-1),培养2周后观察污染情况,培养1月后观察外植体的成活及分化情况。
2) 不同脱毒方法比较试验。
设热处理后分别剥取0.2~0.8 mm茎尖、1~3 mm茎芽、鳞片4个不同的脱毒方法,并以不经热处理直接剥取的茎尖作为对照,均接种到启动培养基上,离体培养成活后的组织,单个观察培养、繁殖成无性系,并分留样品,寄到云南省农科院生物技术与种质资源研究所检测脱毒情况。
3) 不同激素配比对茎尖诱导的影响试验。
取消毒好的茎芽,剖取0.2~0.8 mm大小的茎尖,接种于诱导培养基(1~15号)上进行诱导培养,每种培养基接种15瓶,每瓶1个茎尖。培养温度均为23~28 ℃,光培养的光照强度为2 000~3 000 lx,光照时间为12 h·d-1。每周进行观察,30 d以后统计鳞片分化数与不定芽生长数,计算诱导率。

1.2.5继代增殖培养
将诱导分化后得到的芽、愈伤组织等分成单株或小块,分别转接到增殖培养基(1~15号)上,每个培养基接10瓶,每瓶接5株。置于培养室(温度26 ℃,光强2 000 lx,光照时间12 h·d-1)。经增殖生成的丛生芽、不定芽,再将其分割,继续反复培养、增殖、壮苗,每周观察记录有效芽数(芽高大于0.5 cm)等增殖生长情况。
1.2.6生根结鳞茎培养
将继代培养得到的无根苗和丛芽分割成单株,转接到生根结鳞茎培养基(16~24号)上,每个培养基处理接10瓶,每瓶接5株苗。置于培养室(温度26 ℃,光强2 000 lx,光照时间12 h·d-1)。每周观察记录,30 d后随机抽取2瓶统计小鳞茎增殖数及新根发生条数。

1.3 数据分析
采用Excel软件结合DPS 15.10软件进行方差分析,分析方法按Duncan新复极差法进行。
2 结果与分析
2.1 不同处理对卷丹百合外植体灭菌效果的影响
不同处理对卷丹百合外植体的表面灭菌效果影响如表2所示。次氯酸钠浓度越高、处理时间越长,外植体的污染率越低,但随着次氯酸钠浓度的升高、处理时间的延长,外植体的成活率则出现下降,以10%浓度的次氯酸钠处理20 min后的外植体成活率最高(60%)、污染率最低(40%)。
表2 不同处理对卷丹百合外植体灭菌效果的影响
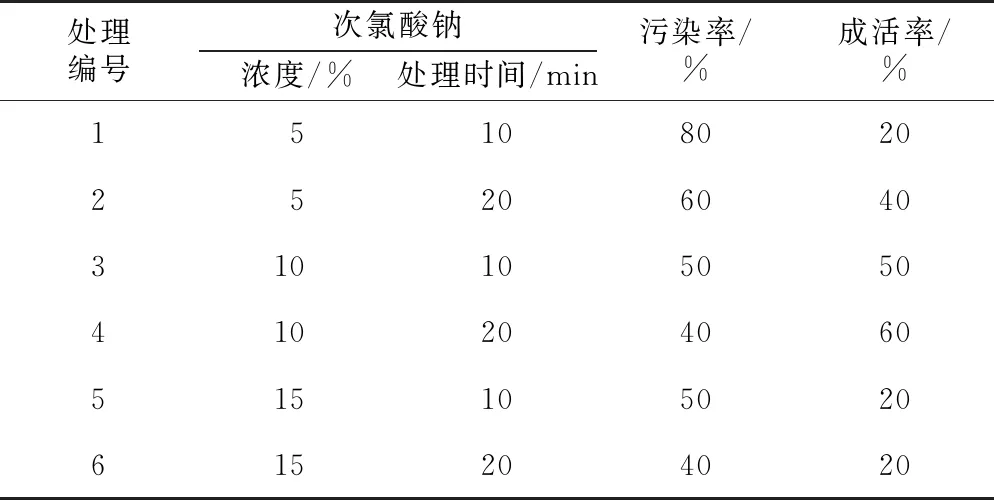
处理编号次氯酸钠浓度/%处理时间/min污染率/%成活率/%1510802025206040310105050410204060515105020615204020
2.2 不同部位外植体对扩繁效果的影响
不同部位外植体的成活及分化情况见表3。百合不同部位的外植体分化效果差异显著。在污染率方面,外层鳞片>中层鳞片>叶片、茎段>茎芽>内层鳞片,且差异均达到极显著水平。在成活率方面,内层鳞片>茎芽>茎段、叶片、中层鳞片>外层鳞片,且差异均达到极显著水平。在不定芽分化数方面,外层鳞片、茎芽>中层、内层鳞片>茎段>叶片,差异均达显著水平,需要注意的是,以茎芽、外层鳞片为外植体的不定芽分化数最高,在5.0~5.5之间,其次是中层、内层鳞片,不定芽分化数为4.67,与茎芽、外层鳞片的不定芽分化数差异显著,但未达极显著水平。
卷丹百合的茎芽(图版a)、叶片(图版b)、鳞片(图版c)和茎段(图版d)作为外植体均可以成活,但中外层鳞片污染率高,成活率也低,茎段和叶片不定芽分化数低,内层鳞片和茎芽由于有鳞片和叶片包裹不易被污染,灭菌效果较好,且成活率和不定芽分化数较高,可作为卷丹百合组培快繁外植体的最佳选择。但作为外植体,茎芽数量相对鳞片较少,如果种球不多,需大量扩繁时,内层鳞片则是卷丹百合组培快繁外植体的最佳选择,成活率可达70%,不定芽分化数为4.67。
表3 不同外植体灭菌处理效果
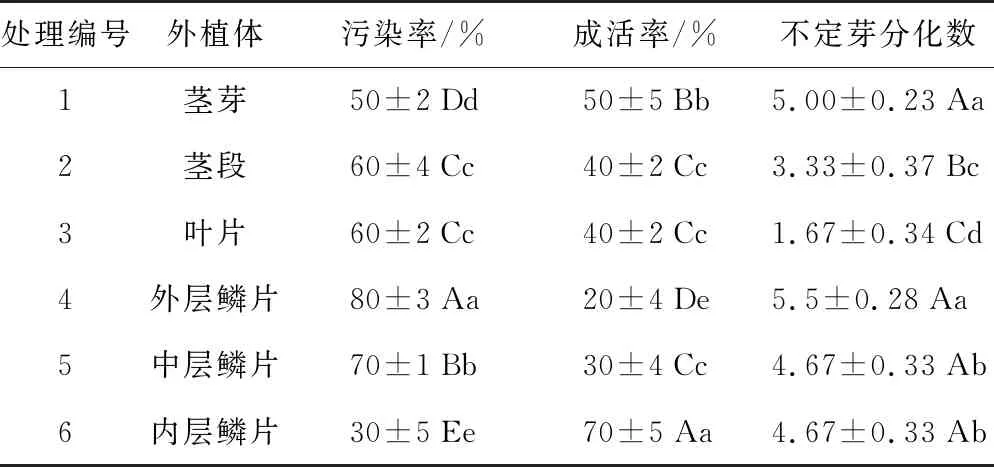
处理编号外植体污染率/%成活率/%不定芽分化数1茎芽50±2Dd50±5Bb5.00±0.23Aa2茎段60±4Cc40±2Cc3.33±0.37Bc3叶片60±2Cc40±2Cc1.67±0.34Cd4外层鳞片80±3Aa20±4De5.5±0.28Aa5中层鳞片70±1Bb30±4Cc4.67±0.33Ab6内层鳞片30±5Ee70±5Aa4.67±0.33Ab
注:表中大写字母表示差异达极显著水平,小写字母表示差异达显著水平。下同。
2.3 不同脱毒方法比较试验
随机抽提各处理样品负染色制片,利用JEM 100 CX-Ⅱ透射电子显微镜检测,脱毒效果见表4。结果表明,A方法热处理结合茎尖脱毒的效果最好,即经26 ℃和45 ℃交替热处理1个月后,剥取0.2~0.8 mm茎尖,2个检测的样品中,2号样品未观测到病毒颗粒,1号样品在5万倍下平均每视野1~5个病毒粒体,脱毒率为50%;其次是D方法,茎尖脱毒,虽然没完全脱掉病毒,存在的病毒粒体较少,7号样品在5万倍下平均每视野少于1个病毒粒体,8号样品,在5万倍下平均每视野1~5个病毒粒体。而只经热处理,剥取的较大茎芽和鳞片诱导的试管苗,病毒粒相对较多。检测报告显示:2号样品已经脱毒可以用于生产扩繁,如急需扩繁,7号样品也可用。
表4 不同脱毒处理方法病毒检测结果

脱毒方法样品编号电子显微镜观察结果A1号+SV(d~60nm)A2号—B3号+++SV(d~30nm)B4号+SV(d~40nm);+LVC5号++SV(d~30nm)C6号++SV(d~30nm);±SV(d~60nm)D7号±SV(d~30nm)D8号+SV(d~30nm)
注:“―”表示5万倍下平均每视野未观察到病毒粒体;“±”表示5万倍下平均每视野少于1个病毒粒体;“+”表示5万倍下平均每视野1~5个病毒粒体;“++”表示5万倍下平均每视野6~10个病毒粒体;“+++”表示5万倍下平均每视野11~15个病毒粒体;“SV”表示球形病毒;“LV”表示线形病毒;“d”表示直径。
2.4 不同激素配比对茎尖诱导分化及增殖的影响
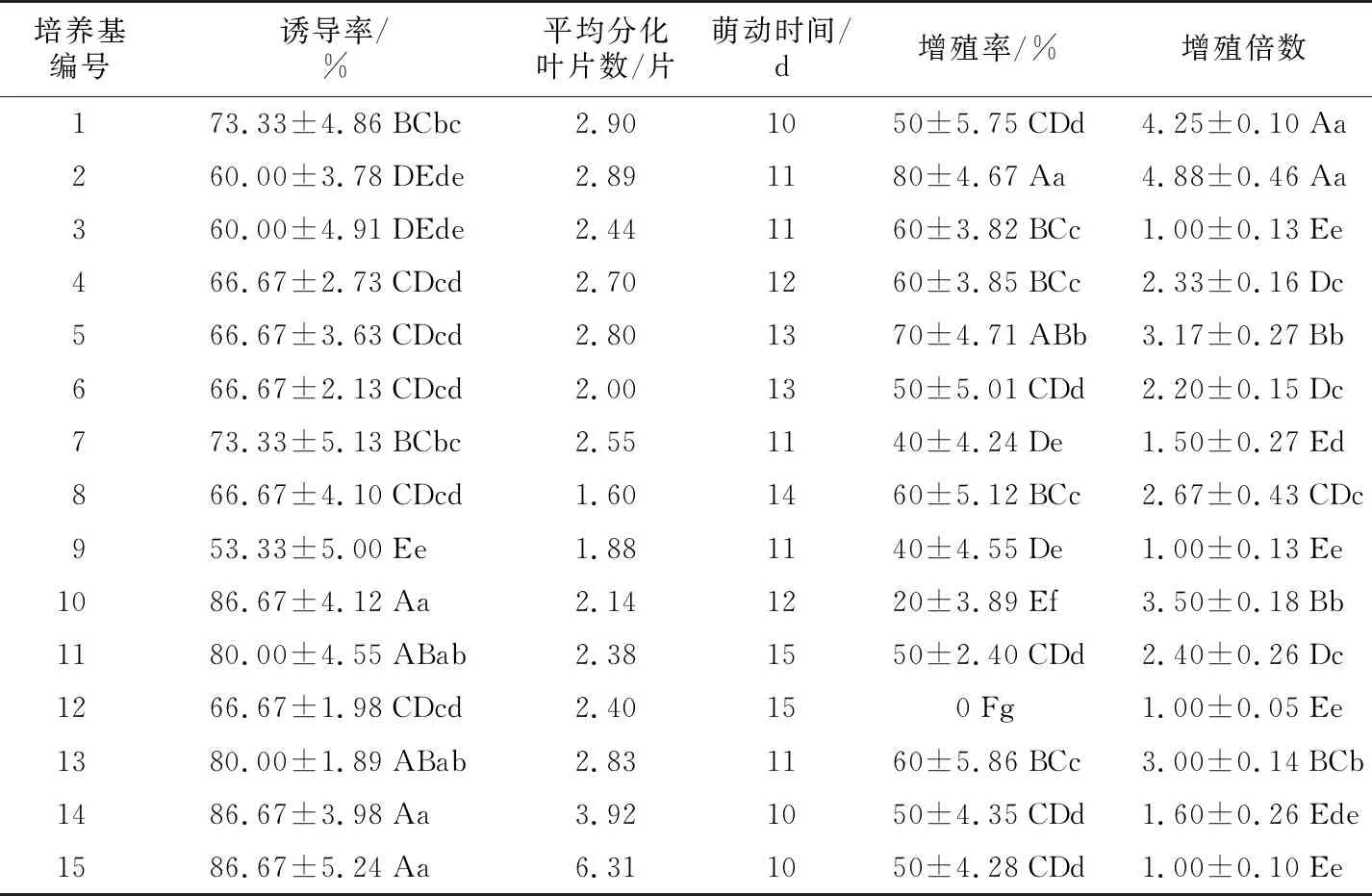
通过观察发现,2周左右部分茎尖开始膨大成愈伤组织,4周后部分组织开始分化成不定芽,8周后百合茎尖长成苗,不同激素配比对卷丹百合茎尖诱导分化的影响如表5所示,不同浓度的6-BA、NAA配比对茎尖诱导率、增殖率和增殖倍数的影响达到显著水平。诱导率最高的培养基是10号、11号、13号、14号和15号,诱导率在80.00%~86.67%之间,平均分化叶片数在2.14~6.31之间,萌动时间10~15 d;增殖率最高的培养基是2号,增殖率达80%;增殖倍数最高的培养基是1号、2号,增殖倍数分别为4.25倍、4.88倍。
表5 不同处理间诱导率、增殖率及增殖倍数的差异
培养基编号诱导率/%平均分化叶片数/片萌动时间/d增殖率/%增殖倍数173.33±4.86BCbc2.901050±5.75CDd4.25±0.10Aa260.00±3.78DEde2.891180±4.67Aa4.88±0.46Aa360.00±4.91DEde2.441160±3.82BCc1.00±0.13Ee466.67±2.73CDcd2.701260±3.85BCc2.33±0.16Dc566.67±3.63CDcd2.801370±4.71ABb3.17±0.27Bb666.67±2.13CDcd2.001350±5.01CDd2.20±0.15Dc773.33±5.13BCbc2.551140±4.24De1.50±0.27Ed866.67±4.10CDcd1.601460±5.12BCc2.67±0.43CDc953.33±5.00Ee1.881140±4.55De1.00±0.13Ee1086.67±4.12Aa2.141220±3.89Ef3.50±0.18Bb1180.00±4.55ABab2.381550±2.40CDd2.40±0.26Dc1266.67±1.98CDcd2.40150Fg1.00±0.05Ee1380.00±1.89ABab2.831160±5.86BCc3.00±0.14BCb1486.67±3.98Aa3.921050±4.35CDd1.60±0.26Ede1586.67±5.24Aa6.311050±4.28CDd1.00±0.10Ee
表6 不同激素组合对外植体茎尖诱导率、增殖率及增殖倍数的影响
项目水平茎尖诱导率/%增殖率/%增殖倍数处理6-BA浓度(A)0.1/(mg·L-1)64.44±7.70Bc63.33±25.27Aa3.38±2.08Aa0.5/(mg·L-1)66.67±6.25ABbc60.00±10.00Aa2.57±0.53Aa1.0/(mg·L-1)64.44±10.18Bc53.33±11.55ABa1.72±0.86Aa1.5/(mg·L-1)77.78±5.18ABab46.67±15.17Bb2.30±1.25Aa2.0/(mg·L-1)84.45±3.85Aa23.33±5.77ABa1.86±1.03AaNAA浓度(B)0.1/(mg·L-1)76.00±7.60Aa46.00±16.73Aab2.92±1.06Aa0.5/(mg·L-1)72.00±10.95Aa62.00±13.04Aa2.94±1.22Aa1.0/(mg·L-1)66.67±12.47Aa40.00±23.45Ab1.24±0.54Ab变异来源A247.47*756.67*1.30B109.60646.67*4.76*
注:方差分析中影响水平以均方表示,“*”表示在0.05水平上显著。下同。
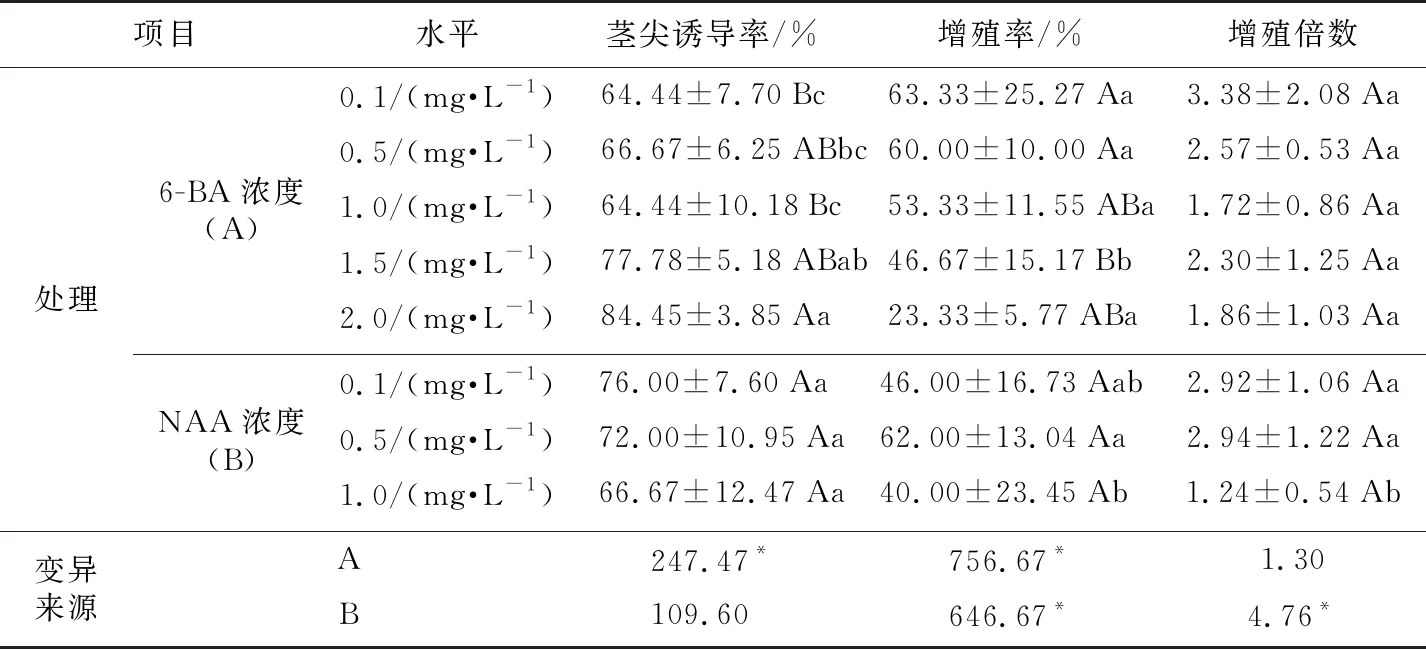
方差分析结果(表6)表明,激素浓度对茎尖诱导率、增殖率和增殖倍数分别有着显著影响(p<0.05),其中,6-BA浓度显著影响茎尖诱导率;NAA浓度显著影响增殖倍数;2种激素浓度均显著影响增殖率,又以6-BA浓度影响(均方值为756.67)最大,NAA浓度影响(均方值为646.67)次之。
由表6还可知,培养基中6-BA浓度较高时,有利于提高茎尖诱导率,在6-BA浓度为2.0 mg·L-1时,茎尖诱导率最高(84.45%)。较低浓度的6-BA有利于提高增殖率,在6-BA浓度为0.1 mg·L-1时的增殖率最高(63.33%),而6-BA浓度对增殖倍数无影响。培养基中NAA浓度较低时,有利于提高增殖率和增殖倍数,在NAA浓度为0.5 mg·L-1时,增殖率和增殖倍数最高,分别为62%和2.94倍,而NAA浓度对茎尖诱导率无影响。
综合表5和表6的结果认为,卷丹百合的最适诱导培养基为15号培养基:MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1,此条件下的诱导率达86.67%,接种10 d后能够萌动,8周后的平均分化叶片数为6.31片;最适增殖培养基为2号培养基:MS+6-BA 0.1 mg·L-1+NAA 0.5 mg·L-1,此条件下的增殖率、增殖倍数分别达80%、4.88倍。
2.5 不同激素配比对卷丹百合试管苗生根结鳞茎的影响
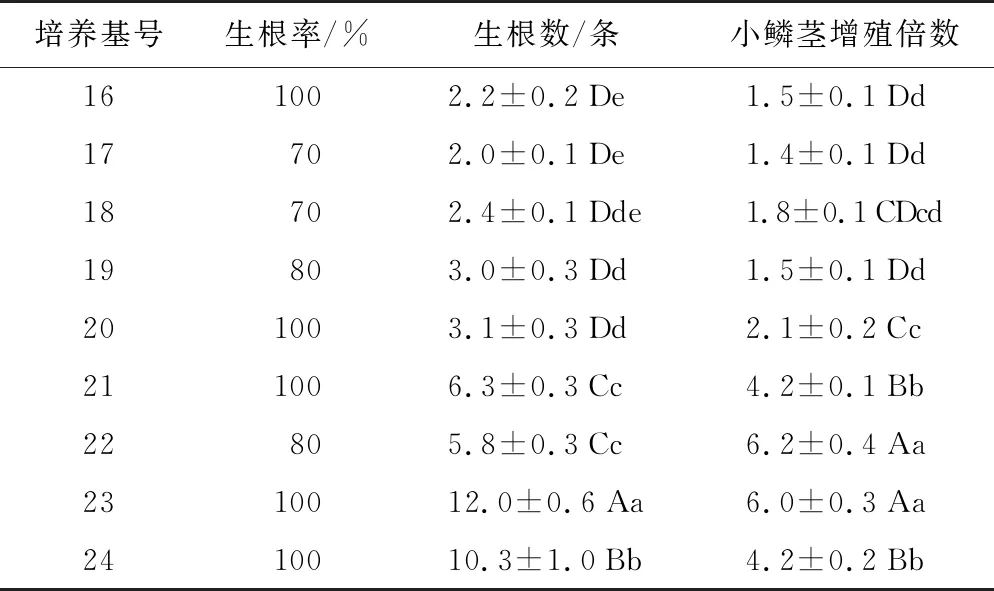
不同激素配比对卷丹百合试管苗生根结鳞茎的影响如表7所示,不同浓度的NAA、IBA配比对生根数、小鳞茎增殖倍数的影响达到显著水平。卷丹百合在9种激素配比条件下都能生根,生根率都在70%以上,其中,23号培养基中的试管苗生根数最多,为12条;22号、23号培养基中的试管苗小鳞茎增殖倍数为最高,增殖倍数在6.0~6.2之间。
表7 不同处理间生根数及小鳞茎增殖倍数的差异
培养基号生根率/%生根数/条小鳞茎增殖倍数161002.2±0.2De1.5±0.1Dd17702.0±0.1De1.4±0.1Dd18702.4±0.1Dde1.8±0.1CDcd19803.0±0.3Dd1.5±0.1Dd201003.1±0.3Dd2.1±0.2Cc211006.3±0.3Cc4.2±0.1Bb22805.8±0.3Cc6.2±0.4Aa2310012.0±0.6Aa6.0±0.3Aa2410010.3±1.0Bb4.2±0.2Bb

图版
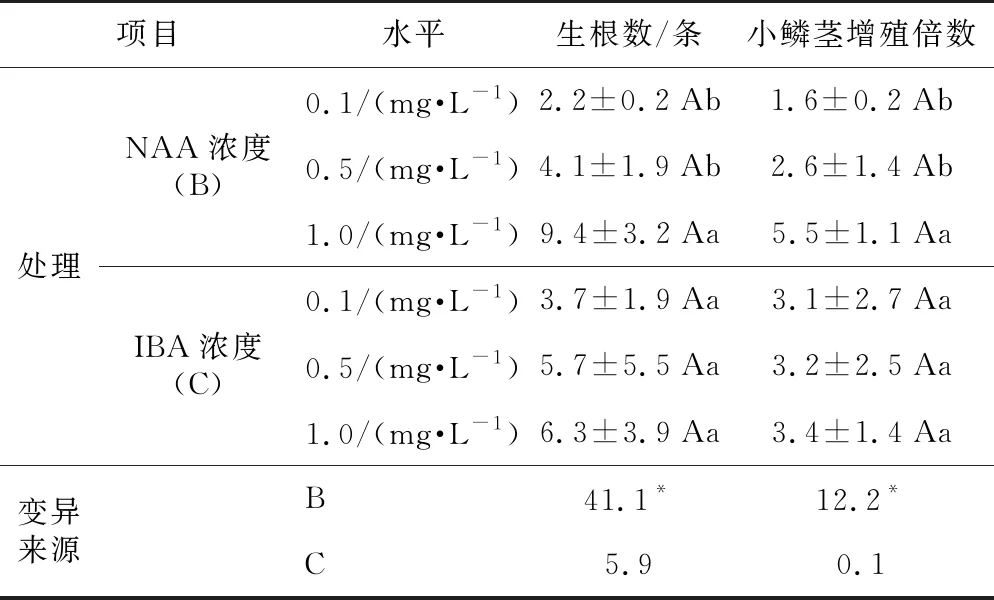
方差分析结果(表8)表明,NAA浓度对卷丹百合试管苗的生根数、小鳞茎增殖倍数的影响达到显著水平(p<0.05),而IBA浓度对生根结鳞茎影响不显著,培养基中NAA浓度越高,越有利于卷丹百合生根结鳞茎,当培养基中NAA浓度为1.0 mg·L-1时,试管苗生根数达到9.4条,小鳞茎增殖倍数为5.5倍。
表8 不同激素组合对试管苗生根数、小鳞茎增殖倍数的影响
项目水平生根数/条小鳞茎增殖倍数处理NAA浓度(B)0.1/(mg·L-1)2.2±0.2Ab1.6±0.2Ab0.5/(mg·L-1)4.1±1.9Ab2.6±1.4Ab1.0/(mg·L-1)9.4±3.2Aa5.5±1.1AaIBA浓度(C)0.1/(mg·L-1)3.7±1.9Aa3.1±2.7Aa0.5/(mg·L-1)5.7±5.5Aa3.2±2.5Aa1.0/(mg·L-1)6.3±3.9Aa3.4±1.4Aa变异来源B41.1*12.2*C5.90.1
综合表7和表8的结果来看,卷丹百合最佳的生根结鳞茎培养基是23号:MS+NAA 1.0 mg·L-1+IBA 0.5 mg·L-1,小鳞茎的增殖倍数为6倍(见图版e、图版f),生根率达100%(见图版g),平均根条数可达12条。
3 讨论与结论
3.1 讨 论
3.1.1卷丹百合的脱毒
食用百合(卷丹)由于需求量增加,长期使用无性繁殖导致病毒感染严重。交替热处理可使百合病毒受到抑制或钝化,生长点快速伸长拉大病毒到达茎尖的距离,且外植体不易受到伤害,既方便了显微操作,又提高了成活率。因此,常温和高温交替热处理结合茎尖脱毒是有效的脱毒方法[9-10]。
茎尖大小决定了无病毒率,茎尖越小,无病毒率越高,但却存在成活率较低、生长缓慢等弊端,降低了扩繁的效率。今后的研究中要探讨既能有效脱除病毒,又有较高的成活率和繁殖效率的方法,可以采用不同的外植体诱导成再生小鳞茎后,再进行茎尖脱毒,这样可以加大脱毒苗的成活率及繁殖系数。
3.1.2卷丹百合外植体的选择
百合组织培养过程可以选择鳞片、叶片、茎尖、茎段或花器官材料的部位,选择外植体关键要看其取材的方便性、材料数量、材料部位、生理状态、发育阶段及取材时间是否有利于在初代培养中愈伤组织或不定芽的诱导,外植体的选择是初代培养的关键因素[11-13],通常说来,鳞片就其方便性及数量是优于其它外植体的[14-16]。本试验中,卷丹百合的茎芽、茎段、叶片和鳞片作为外植体均可以成活,但外层鳞片污染率高,而内层鳞片和茎芽由于有鳞片和叶片包裹不易被污染,灭菌效果较好,且成活率和不定芽分化数较高,可作为卷丹百合组培快繁外植体选择。但作为外植体,鳞片相对茎芽数量较多,且容易诱导成功,分化不定芽系数较高,因此在种球不多,需大量扩繁时,内层鳞片则是卷丹百合组培快繁外植体的最佳选择,非常符合工厂化生产的需要。
3.1.3植物激素对卷丹百合诱导、增殖及生根结鳞茎的影响
6-BA与NAA的浓度水平是百合不定芽能否产生和增殖的主要因素,不同品种的百合在增殖时对激素浓度的要求有较大差异[17-19]。因此,在组织培养的过程中,要根据不同的品种进行激素浓度的配比。本研究中,不加6-BA,只加NAA和IBA配比的生根培养基MS+NAA 1.0 mg·L-1+IBA 0.5 mg·L-1,也适合卷丹百合试管苗的增殖和继代培养,在生根的同时能结出小鳞茎,且小鳞茎增殖系数较高。生根率可达100%,小鳞茎的增殖倍数为6倍,可以同时作为增殖和生根培养的最优培养基。
3.2 结 论
在卷丹百合的组培快繁过程中,宜选择内层鳞片为外植体,外植体用75%的乙醇浸泡30 s后,再用10%次氯酸钠消毒20 min,以26 ℃和45 ℃交替热处理1个月后,剥取0.3~0.8 mm茎尖的脱毒效果较好;最适诱导培养基为MS+6-BA 2.0 mg·L-1+NAA 1.0 mg·L-1;最适增殖培养基为MS+6-BA 0.1 mg·L-1+NAA 0.5 mg·L-1;最适生根结鳞茎培养基为MS+NAA 1.0 mg·L-1+IBA 0.5 mg·L-1。
