Andersen-Tawil 综合征1例报告并文献复习
2020-06-12高晔吴迪郭怡菁袁宝玉张志珺
高晔,吴迪,郭怡菁,袁宝玉,张志珺
Andersen-Tawil综合征(ATS)是一种常染色体显性遗传骨骼肌离子通道病,其患病率约为1/1 000 000,周期性麻痹、室性心律失常、面部和(或)骨骼畸形是其最常见的临床表现,但临床表型高度异质。本文介绍1例ATS,并系统综述其发病机制、临床表现。
1 临床资料
患者男,17岁,学生。因“反复发作性肢体无力4年,再发4 d”入院。患者4年前在剧烈运动后出现肢体无力,表现为四肢无力感,可正常活动,持续数分钟左右,休息后可自行缓解,发作频率约为每周数次。1年前,患者熬夜及喝碳酸饮料增加,肌无力发作频次较前明显增加。4 d前患者摄入2 L碳酸饮料后再次出现四肢无力,不能行走,查血清钾 2.48 mmol/L,ECG示室性期前收缩。既往“室性期前收缩”史4年。3年前外伤致肝挫裂伤,术后恢复可。吸烟史2年,每天十余支,否认饮酒史。父亲先天性右下肢发育异常,8岁前不能行走,现右下肢肌肉萎缩。母亲有癫痫病史,有类似肌无力发作史(未明确诊断),不明原因猝死。入院查体:T 36.4 ℃,P 87次/min,R 28次/min,BP 114/67 mmHg(1 mmHg=0.133 kPa),低位耳(图1)。神志清,言语流利,精神可,颅神经检查未见异常,左上肢远近肌力Ⅳ级,右上肢远近肌力Ⅰ级,左下肢远近肌力Ⅱ级,右下肢远近肌力Ⅰ级,四肢肌张力下降,双上肢腱反射及右下肢腱反射(-),左下肢腱反射(+),双侧病理反射未引出。脑膜刺激征阴性。心脏听诊可及早博音,余心肺腹检查未见异常。辅助检查:MMSE 30分。电解质示钾 2.48 mmol/L。ECG示窦性心律,T-U异常。骨密度测定:腰椎及左侧髋部骨密度≤-2.0,低于同龄人。心脏彩超未见明显异常。24 h动态ECG示频发室性期前收缩,时呈二联律,时呈插入性室早。长时程运动诱发试验阳性:右侧腕部刺激,小指展肌记录复合肌肉动作电位(CMAP)波幅与基线相比,运动后即刻上升6%,30 min下降17%,60 min下降25%,90 min下降35%(图2)。头颅MRI Flair示左侧额顶叶交界区脑白质内点状高信号影(图3)。基因检测(NGS)示染色体17q24的KCNJ2基因出现错义突变:c.224C > T(p.Thr75Met)(图4),CACNA1S、SCN4A基因未见突变,其父亲及舅舅均未发现相关基因突变。诊断为ATS。予补钾治疗后患者肌力恢复正常,出院后继续服用醋钾唑胺片,随访发现患者周期性麻痹的发作频率、严重程度及发作时间明显改善。

图1 患者表现为低位耳的面部特征 图2 长时程运动诱发试验结果 图3 患者头颅MRI Flair示左侧额顶叶交界区脑白质内点状高信号影
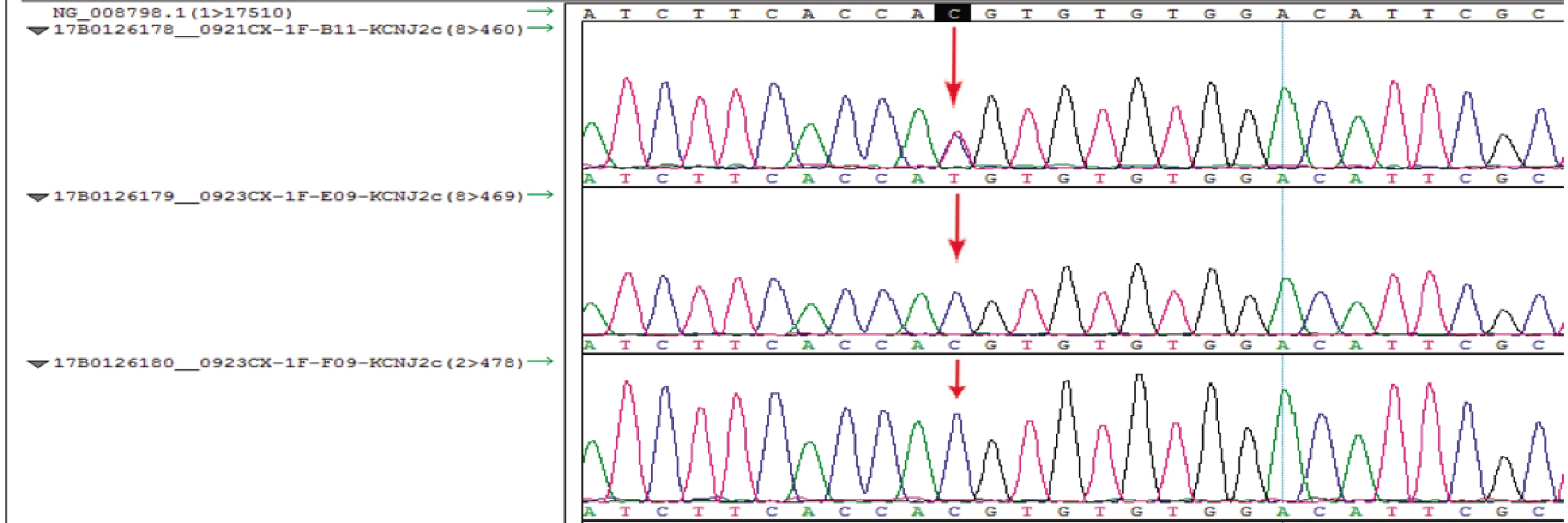
图4 基因测序显示染色体17q24.3的KCNJ2基因出现杂合突变:c.224C>T,导致氨基酸改变Thr75Met
2 讨 论
ATS以室性心律失常、周期性麻痹、面部和(或)骨骼发育畸形三联症为典型临床表现。此外,其他表型还包括扩张型心肌病[1]、肾发育不全[2]、执行功能受损[3]、抑郁症[4]、肾小管功能缺陷[5]、不自主运动及步态共济失调[5]等。本例患者除典型三联症外,还具有以下特征:(1)患者肌无力发作时,四肢肌力分布明显不对称,表现为近期有过剧烈活动的肢体肌力减退更明显,而CACNA1S钙离子通道突变所致的低钾型周期性麻痹的患者多表现为对称性肢体乏力。(2)头颅MRI Flair示左侧额顶叶交界区脑白质内点状高信号影,此前有文献报道2例ATS患者存在散在白质变性,患者年龄分别为35岁和24岁,位置均位于皮质下[4,6],结合本例患者进一步提示脑白质变性可能为ATS临床表型之一。(3)患者骨密度测定较同龄人低,虽不排除与患者喜饮碳酸饮料相关,但有学者提出表达于破骨细胞的Kir2.1突变导致细胞内外离子失衡影响氢-钾交换,破骨细胞正常工作所需要的酸性环境受到破坏使破骨细胞功能受损,而导致成骨与溶骨的失衡,引起发育畸形[7-8]。其他ATS患者骨密度是否降低及其机制有待进一步探究。(4)患者长时程诱发电位结果展示如图5所示,Fournier等[9]按照基因型不同将骨骼肌离子通道病运动诱发电位特征分为五种类型,其中CACNA1S钙离子通道突变引起低钾型周期性麻痹患者仅表现为运动后CAMP波幅逐渐下降,而SCN4A 钠离子突变引起高钾型周期性麻痹患者表现为运动即刻一过性波幅增高38%,而后逐渐降低至74%。本例患者临床为低钾血症,但表现与高钾型相似。
KCNJ2基因为ATS最常见的致病基因。本例患者突变位点(Thr75Met)位于Kir2.1蛋白氨基末端的高度保守区[5],患者父亲及舅舅均未发现相关基因突变,但无法完善母亲基因检测,故推测患者可能为新发病例或该突变来源于母亲。Tani等[10]报道1例Thr75Met位点突变致反复晕厥及双向性室性心律失常的35岁女性患者,并通过研究提示Thr75Met突变与双向性室性心动过速、QT间期延长等恶性心律失常相关。而本例患者除室性期前收缩外尚未发现以上恶性心律失常,需继续随访其后续是否会发生相关心律失常。KCNJ2编码的内向整流钾离子通道蛋白Kir2.1主要分布于心室肌和骨骼肌细胞[11-12],对维持稳定的细胞膜静息电位、缓冲细胞外钾以及在心肌细胞动作电位的快速复极末期起重要作用。发育畸形的致病机制仍未有统一的结论,除上述成骨与溶骨失衡的理论外,尚有Dahal等[13]通过果蝇实验提出:Kir2.1突变破坏了人骨形成蛋白信号传导而致畸以及Dany等[14]通过使KCNJ2基因在老鼠和非洲蟾蜍进行表达提出发育畸形的机制可能与外胚层内源细胞早期表达异常相关两种机制。
治疗方面,首先需避免延长QT间期、增强交感神经活动的诸多诱因,如应急情绪、剧烈运动及相关药物等。此外,ATS的治疗着重于预防周期性麻痹和室性心律失常两部分,目前临床上投入使用的药物分别包括补钾治疗、碳酸酐酶抑制剂、保钾利尿剂等以及针对心律失常的β-肾上腺素阻滞剂[6]、氟卡胺[15-17]等,对于恶性心律失常还可以选择心脏起搏器及植入型除颤仪[18]。由于ATS的罕发性,其治疗目前主要依据对于周期性麻痹和LQTS的治疗经验而定。
总之,ATS作为一个多系统累及的离子通道病,其临床表现高度变异,临床上要更加关注患者临床表型,从而有利于不断完善其表型及机制。
