薄荷McHD-Zip3基因的克隆及其调控腺毛发育的功能分析
2020-06-12陈泽群亓希武房海灵梁呈元
陈泽群,亓希武,房海灵,于 盱,李 莉,梁呈元
〔江苏省中国科学院植物研究所(南京中山植物园)江苏省植物资源研究与利用重点实验室,江苏 南京 210014〕
薄荷(MenthacanadensisLinn.)隶属于唇形科(Lamiaceae)薄荷属(MenthaLinn.),为多年生草本植物,其干燥地上部分可入药,具有疏散风热和清利头目之效,可用于治疗风热感冒、口疮和胸胁胀闷等[1]。薄荷精油是薄荷的主要药用成分,而腺毛是生成精油的“生物工厂”[2]。薄荷腺毛为多细胞结构,可分为分泌型腺毛和非分泌型腺毛2类,前者包括头状腺毛和盾状腺毛,其中盾状腺毛是薄荷精油合成、分泌和贮存的重要场所[3-4]。
腺毛的生长和发育受基因调控,且关于单细胞表皮毛的起始和发育研究较为深入[5-6]。从模式植物拟南芥〔Arabidopsisthaliana(Linn.)Heynh.〕中已鉴定获得70多种与表皮毛相关的突变体,涉及30多个基因,其中,由3类转录因子构成的复合体MYB-bHLH-WD40对单细胞表皮毛的发育具有重要的调控作用[6]。相对于单细胞表皮毛,研究者对多细胞表皮毛的发育调控研究尚不全面,目前报道的调控基因主要包括2类:一类是以金鱼草(AntirrhinummajusLinn.)MYB家族转录因子MIXTA为代表的同源基因[7-9];另一类为同源异型-亮氨酸拉链(Homeodomain-leucine zipper,HD-Zip)家族转录因子基因[10-12]。
HD-Zip转录因子家族属于Homeobox蛋白家族,是植物中特有的一类转录因子[13]。HD-Zip转录因子由DNA-同源结构域和亮氨酸拉链结构组成,其中,DNA-同源结构域由60个氨基酸残基组成,主要与DNA特异性结合;亮氨酸拉链结构由35~42个氨基酸残基组成,主要介导蛋白二聚体的形成[14-16]。HD-Zip转录因子根据其基因结构和进化关系,可分为4个亚家族,即HD-Zip Ⅰ、HD-Zip Ⅱ、HD-Zip Ⅲ和HD-Zip Ⅳ,主要参与生物和非生物胁迫响应、细胞分化、生长发育和形态建成等生物过程[17]。其中HD-Zip Ⅳ亚家族的基因在植物的表皮细胞中特异表达,主要参与调控表皮细胞分化、根生长和毛状体形成等[18]。在HD-Zip Ⅳ亚家族中,有多个转录因子能够调控植物腺毛的发育,例如:番茄(SolanumlycopersicumLinn.)的woolly基因可以调控番茄Type Ⅰ类型腺毛的起始和发育[19];黄花蒿(ArtemisiaannuaLinn.)的AaHD1基因可以增加黄花蒿腺毛的密度,且其AaMIXTA1和AaHD8基因还能够形成复合体,共同调控腺毛的发生和发育[12,20];黄瓜(CucumissativusLinn.)的CsGL3基因对瓜体多细胞腺毛的发育有重要的调节作用[21]。
作为合成精油的重要场所,腺毛的发育对薄荷精油的合成和积累具有重要作用。为探索HD-Zip转录因子在薄荷腺毛发育过程中的功能,进一步解析其腺毛发育的分子机制,作者依据前期对薄荷转录组的测序结果[22],从薄荷中克隆获得1个HD-Zip Ⅳ亚家族转录因子基因,对其序列特性、组织表达特性、亚细胞定位和转录激活活性进行分析,并通过该基因在烟草(NicotianatabacumLinn.)中的过表达,分析其对烟草腺毛发育的影响,以期为薄荷腺毛发育调控的分子机制研究奠定基础。
1 材料和方法
1.1 材料
供试薄荷品种‘68-7’由上海日用化学工业研究所选育,保存于江苏省中国科学院植物研究所薄荷种质资源圃中。于2018年4月,分别选取薄荷植株上生长状态良好的幼叶、老叶、茎和根,每3株的各组织样品分别混合均匀,共取样3组,记为3个生物学重复。供试样品经液氮速冻后置于-80 ℃条件下保存、备用。
供试烟草品种‘K326’和本氏烟草(NicotianabenthamianaDomin)种子由作者所在实验室保存,烟草种子经体积分数75%乙醇表面消毒1 min后置于MS培养基上萌发,长至苗高8 cm左右时,用于遗传转化;本氏烟草种子直接播种于营养土中,生长1个月后用于侵染实验。
1.2 方法
1.2.1 总RNA提取及cDNA第1链的合成 称取薄荷不同组织样品各1 g,置于液氮中研磨,采用RNAiso Plus试剂〔宝日医生物技术(北京)有限公司〕提取总RNA,并采用NanoDrop 1000微量紫外分光光度计(美国Thermo Scientific公司)检测总RNA的质量和浓度。取1 μg总RNA,用RT6 cDNA Synthesis Kit试剂盒(北京擎科新业生物技术有限公司)进行反转录,获得cDNA,具体的操作过程详见试剂盒使用说明书。
1.2.2 基因克隆 根据前期对薄荷转录组测序结果[22],用Primer Premier 5软件设计引物(表1),并以上述薄荷cDNA为模板进行PCR扩增。扩增体系总体积25.0 μL,包含金牌Mix 22.0 μL、模板cDNA 1.0 μL、10 μmol·L-1上游和下游引物各1.0 μL。扩增程序为:98 °C预变性5 min;98 ℃变性30 s、55 ℃退火30 s、72 ℃延伸35 s,共35个循环;最后于72 ℃延伸5 min。PCR产物用质量体积分数1%琼脂糖凝胶进行电泳分离,切取目标条带,用DNA凝胶回收试剂盒(北京擎科新业生物技术有限公司)纯化回收;连接至pClone007 Blunt Simple Vector载体(北京擎科新业生物技术有限公司),转化至大肠杆菌DH5α感受态细胞中,挑取阳性克隆,交由北京擎科新业生物技术有限公司测序验证。
1.2.3 生物信息学分析 使用BioEdit软件对克隆获得的McHD-Zip3基因序列进行蛋白质编码区预测和氨基酸翻译;使用ExPASy网站(http:∥web.expasy.org/cgi-bin/compute_pi/pi_tool)预测该基因编码的氨基酸序列的理论相对分子质量和理论等电点;使用NCBI网站BLAST程序(http:∥blast.ncbi.nlm.nih.gov/Blast.cgi.)对该基因的核苷酸序列及其编码的氨基酸序列进行比对搜索;使用SMART网站(http:∥smart.embl-heidelberg.de/)预测该基因编码的氨基酸序列的结构域;使用Clustal X软件对McHD-Zip3转录因子与其他植物的HD-Zip转录因子进行多重比对;基于McHD-Zip3转录因子和其他植物的HD-Zip Ⅳ亚家族转录因子的氨基酸序列,使用MEGA 4.0软件,采用Neighbor-joining(NJ)法构建系统树。
1.2.4 实时荧光定量PCR 根据McHD-Zip3基因序列设计用于实时荧光定量PCR(qRT-PCR)的引物,以薄荷肌动蛋白基因McActin为内参基因[22]设计用于qRT-PCR的引物(表1),以薄荷各组织cDNA为模板进行qRT-PCR分析。反应体系总体积20.0 μL,包含SYBR©PremixExTaqTMⅡ 10.0 μL、cDNA模板2.0 μL、10 μmol·L-1上游和下游引物各0.4 μL、去离子水7.2 μL。使用qTOWER 2.2荧光定量PCR仪(德国Analytik Jena公司)进行qRT-PCR反应,扩增程序为:98 ℃预变性1 min;98 ℃变性5 s、60 ℃退火10 s、72 ℃延伸15 s,共40个循环;72 ℃采集荧光信号。使用2-ΔΔCT法[23]计算基因的相对表达量,设3个生物学重复。
1.2.5 亚细胞定位 根据植物表达载体p35SGK-GFP以及McHD-Zip3基因序列设计引物(表1),使用同源重组试剂盒TreliefTMSoSoo Cloning Kit(北京擎科新业生物技术有限公司),并采用同源重组的方法[24]将McHD-Zip3基因的编码序列与绿色荧光蛋白(GFP)的编码序列融合,构建用于亚细胞定位的重组载体p35SGK-McHD-Zip3-GFP(其中McHD-Zip3基因不包含终止密码子);将重组载体和对照载体p35SGK-GFP分别转化农杆菌EHA105感受态细胞,之后挑取单克隆在YEB液体培养基中培养至OD600达到约0.6;收集菌体重悬后分别侵染本氏烟草叶片,培养2 d后,使用LSM710型激光共聚焦显微镜(德国Zeiss公司)观察本氏烟草叶片中的荧光信号并拍照记录。
1.2.6 转录激活检测 使用酵母细胞分析McHD-Zip3转录因子的转录激活活性,根据DNA-BD载体pGBKT7和McHD-Zip3基因序列设计引物(表1),使用同源重组试剂盒TreliefTMSoSoo Cloning Kit(北京擎科新业生物技术有限公司)构建重组载体pGBKT7-McHD-Zip3。用重组载体和空载体pGBKT7(对照)分别转化酵母AH109感受态细胞,并在SD/-Trp培养基上进行筛选,之后分别在SD/-Trp和SD/-Trp/-His/-Ade(+3AT)培养基上培养,4 d后观察其生长状况。采用含有β-半乳糖苷酶的菌落印迹法[25]进行LacZ活性检测,有转录激活作用的酵母菌株会激活LacZ基因并产生β-半乳糖苷酶,分解X-Gal产生5-溴-4-氯靛蓝,酵母细胞被染为蓝色。
表1 用于薄荷McHD-Zip3基因克隆和功能研究的引物及其序列
Table 1 Primers and their sequences used for cloning and function study ofMcHD-Zip3gene ofMenthacanadensisLinn.

引物 Primer序列(5′→3′)1) Sequence (5′→3′)1)用途 ApplicationMcHD-Zip3-FATGGAGAATCTTGGAGAGATGG基因克隆Gene cloningMcHD-Zip3-RTCAGTTGCATTGAAGCCCAGqMcHD-Zip3-FCCACCTGGCATCGTCTT实时荧光定量PCR Real-time quantitative PCRqMcHD-Zip3-RGCTGCTCTGGCTCACATqMcActin-FCCAGGAATTGCTGATAGGATGAG实时荧光定量PCR Real-time quantitative PCRqMcActin-RGCGCCACCACCTTAATCTTCMcHD-Zip3-SL-FTGGAGAGGACAGGGTACCATGGAGAATCTTGGAGAGATGG亚细胞定位Subcellular localizationMcHD-Zip3-SL-RCTTGCTCACCATGGATCCGTTGCATTGAAGCCCAGCTMcHD-Zip3-TA-FGAGGAGGACCTGCATATGATGGAGAATCTTGGAGAGATGG转录激活检测Transcriptional activation detectionMcHD-Zip3-TA-RACGGATCCCCGGGAATTCTCAGTTGCATTGAAGCCCAGMcHD-Zip3-OE-FCGGGATCCATGGAGAATCTTGGAGAGATGGMcHD-Zip3-OE-RACGCGTCGACTCAGTTGCATTGAAGCCCAG烟草细胞的遗传转化Genetic transformation of Nicotiana tabacum cell
1)下划线字母表示同源臂碱基,斜体字母表示酶切位点The underlined letters represent the bases of homologous arm,and the italic letters represent the restriction sites.
1.2.7McHD-Zip3基因过表达烟草 根据植物表达载体p35SGK和McHD-Zip3基因序列设计引物(表1),利用双酶切(选择BamHⅠ和SalⅠ)的方法将McHD-Zip3基因编码序列插入植物表达载体p35SGK中,构建用于遗传转化的重组载体p35SGK-McHD-Zip3。将重组载体转化农杆菌EHA105感受态细胞,之后挑取单克隆在YEB液体培养基中培养至OD600达到约0.6,收集菌体后用MS盐溶液重悬,用叶盘转化法[26]转化烟草叶片。利用抗生素、GUS染色和分子检测筛选阳性植株移栽至花盆中,待烟草植株开花结实后收集种子,与野生型烟草同时播种,观察植株生长过程中叶片表面腺毛的变化;待烟草幼苗长至4枚叶片时,用质量体积分数1%盐基品蓝染料对叶片表皮腺毛进行染色,然后置于Nikon ECLIPSE50i显微镜(日本Nikon公司)和Nikon SMZ1000体视显微镜(日本Nikon公司)下观察烟草叶片腺毛发育状况。
2 结果和分析
2.1 McHD-Zip3基因的克隆和生物信息学分析
对McHD-Zip3基因的PCR扩增结果见图1,该基因的核苷酸序列及其编码的氨基酸序列见图2。分析结果显示:以薄荷cDNA为模板进行PCR扩增,获得1条长度约2 200 bp的条带(图1),经过测序验证和分析,将该基因命名为McHD-Zip3。该基因编码区(CDS)全长2 226 bp,其编码的氨基酸序列有741个氨基酸残基(图2)。另外,该基因编码的氨基酸序列的理论相对分子质量为81 375.67,理论等电点为pI 5.92。
将McHD-Zip3基因编码的氨基酸序列在NCBI网站上用BLAST程序进行序列比对,获得其同源基因序列,并进行多重序列比对,结果见图3。结果显示:McHD-Zip3基因编码的氨基酸序列与一串红(SalviasplendensKer-Gawl.)的SsHD-Zip基因(TEY86230.1)、芝麻(SesamumindicumLinn.)的SiANL2基因(XP_011076208.1)、猴面花(ErythrantheguttataFisch.ex DC.)的EgANL2基因(XP_012852238.1)、渐狭叶烟草(NicotianaattenuataTorrey ex S.Watson)的NaANL2-like基因(XP_019251816.1)和小粒咖啡(CoffeaarabicaLinn.)的CaANL2-like基因(XP_027110364.1)编码的氨基酸序列具有一定的序列相似性,且McHD-Zip3转录因子与一串红SsHD-Zip转录因子的序列相似度最高,为82.57%。这些基因所编码的HD-Zip转录因子的氨基酸序列都具有保守的Homeodomain、bZip motif、START domain和SAD domain,均为HD-Zip Ⅳ亚家族转录因子共有的结构域和基序,McHD-Zip3转录因子与其他植物HD-Zip转录因子的结构域序列较为保守,表明他们可能具有类似的功能。
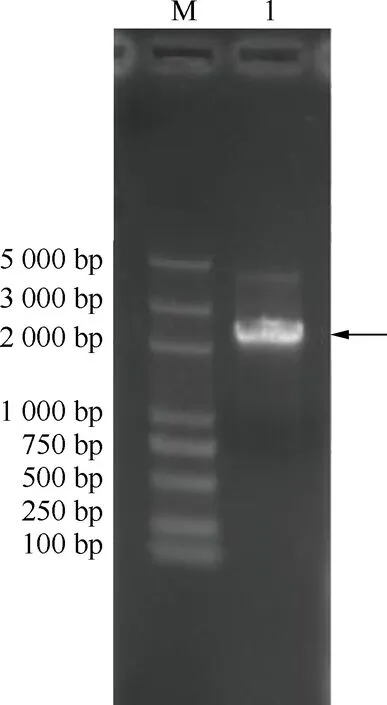
M:DNA marker;1:McHD-Zip3.
图1 薄荷McHD-Zip3基因的PCR扩增结果
Fig.1 PCR amplification result ofMcHD-Zip3gene ofMenthacanadensisLinn.

*:终止密码子Stop codon.

Mc:薄荷MenthacanadensisLinn.;Ss:一串红SalviasplendensKer-Gawl.;Si:芝麻SesamumindicumLinn.;Eg:猴面花ErythrantheguttataFisch.ex DC.;Na:渐狭叶烟草NicotianaattenuataTorrey ex S.Watson;Ca:小粒咖啡CoffeaarabicaLinn.
图3 薄荷McHD-Zip3基因编码的氨基酸序列与其他植物HD-Zip转录因子氨基酸序列的多重比对结果
Fig.3 Multiple alignment result of amino acid sequence encoded byMcHD-Zip3gene ofMenthacanadensisLinn.with that of HD-Zip transcription factor of other plants
对McHD-Zip3基因编码的氨基酸序列与其他植物的腺毛发育相关HD-Zip转录因子的氨基酸序列进行系统发育分析。结果(图4)表明:McHD-Zip3基因编码的氨基酸序列与黄花蒿的AaHD1[12](KU744599)、AaHD7[12](KU744600)和AaHD8[20](KX465135),以及番茄Slwoolly[27](JF518780)、黄瓜CsGL3[21](XP_004134971.1)和甜瓜(CucumismeloLinn.)CmGL[11](XP_008439968.1)等与植物腺毛发育相关的HD-Zip转录因子聚为同一支,均属于HD-Zip Ⅳ亚家族,其中McHD-Zip3转录因子与黄花蒿AaHD7转录因子的亲缘关系最近。
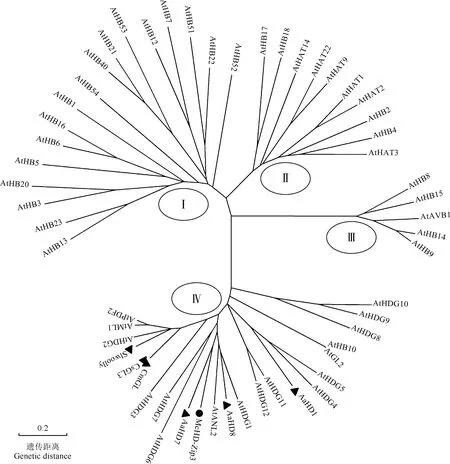
At:拟南芥ArabidopsisthalianaLinn.;Aa:黄花蒿ArtemisiaannuaLinn.;Sl:番茄SolanumlycopersicumLinn.;Cs:黄瓜CucumissativusLinn.;Cm:甜瓜CucumismeloLinn.;Mc:薄荷MenthacanadensisLinn.
图4 薄荷McHD-Zip3基因编码的氨基酸序列与其他植物HD-Zip转录因子氨基酸序列的系统树
Fig.4 Phylogenetic tree of amino acid sequence encoded byMcHD-Zip3gene ofMenthacanadensisLinn.and that of HD-Zip transcription factor of other plants
2.2 McHD-Zip3基因的组织表达特性
薄荷不同组织中McHD-Zip3基因的相对表达量见图5。结果显示:老叶中McHD-Zip3基因的相对表达量最高,根中该基因的相对表达量最低,且幼叶和老叶中McHD-Zip3基因的相对表达量显著高于茎和根,而该基因在茎中的相对表达量也显著高于根。
2.3 McHD-Zip3转录因子的亚细胞定位和转录激活活性
2.3.1 亚细胞定位 亚细胞定位结果(图6)显示:在转化对照载体(35S:GFP)的表皮细胞中,整个细胞中均能观察到荧光信号;而在转化重组载体(35S:McHD-Zip3-GFP)的表皮细胞中,仅在细胞核中观察到荧光信号,表明McHD-Zip3转录因子定位于细胞核中,为核定位蛋白,这与该类转录因子在细胞核中行使调控功能相一致。
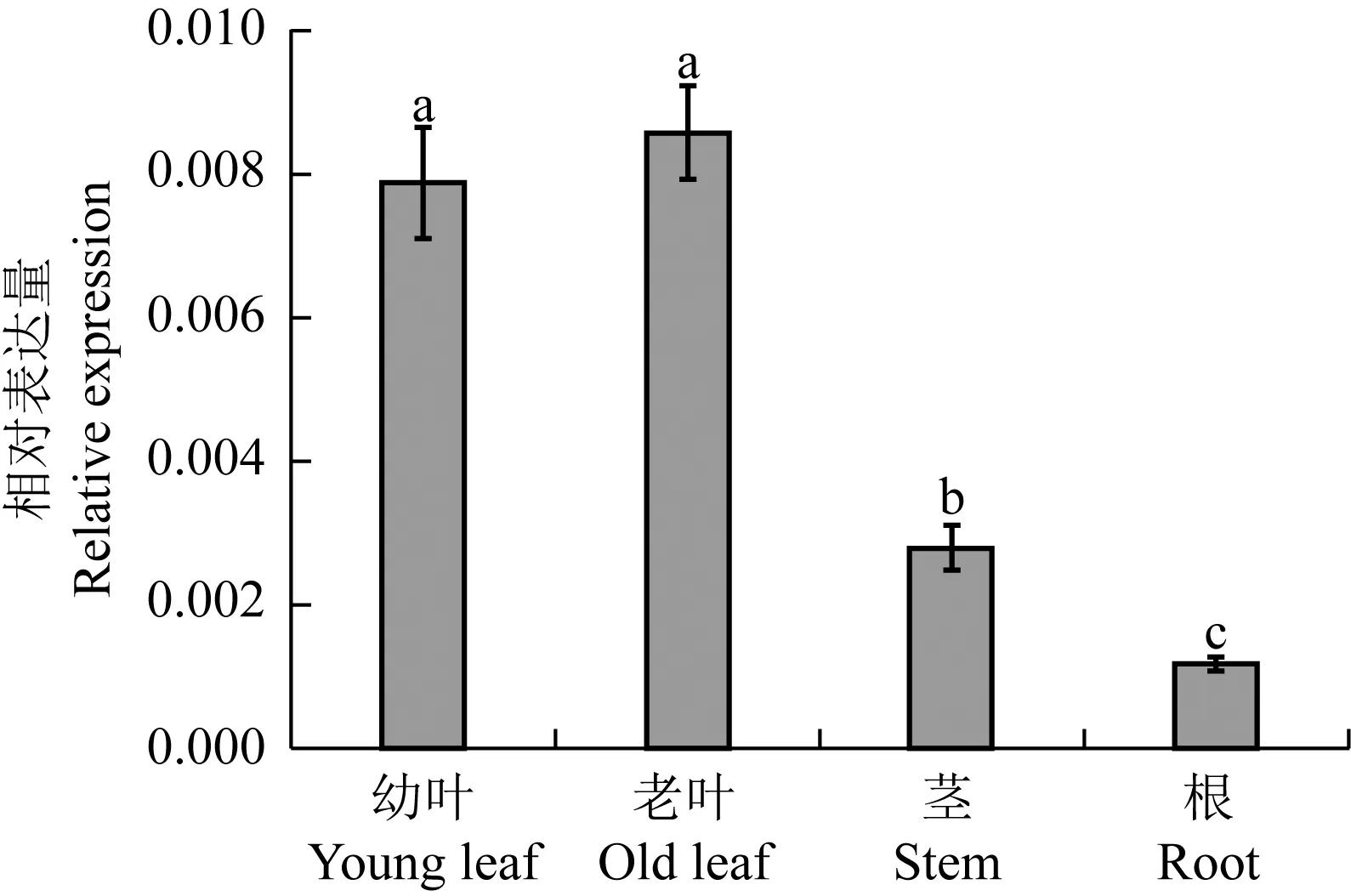
组织 Tissue
不同的小写字母表示在0.05水平上差异显著Different lowercases indicate the significant difference at 0.05 level.
图5 薄荷不同组织中McHD-Zip3基因的相对表达量比较
Fig.5 Comparison on relative expression ofMcHD-Zip3gene in different tissues ofMenthacanadensisLinn.
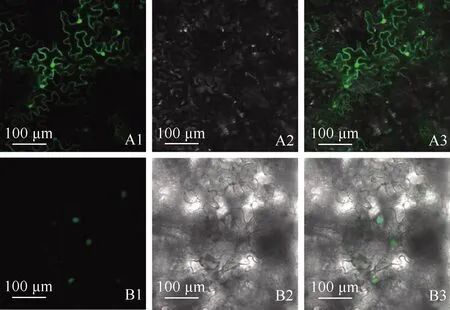
A:转化对照载体(35S:GFP)的表皮细胞 The epidermal cells of transformed control vector(35S:GFP);B:转化重组载体(35S:McHD-Zip3-GFP)的表皮细胞 The epidermal cells of transformed recombinant vector(35S:McHD-Zip3-GFP).1:绿色荧光视野Green fluorescence field;2:明视野Bright field;3:重合视野Merged field.
图6 薄荷McHD-Zip3转录因子在本氏烟草表皮细胞中的亚细胞定位结果
Fig.6 Subcellular localization result of McHD-Zip3 transcription factor ofMenthacanadensisLinn.in epidermal cells ofNicotianabenthamianaDomin
2.3.2 转录激活活性 利用酵母系统检测McHD-Zip3转录因子的转录激活活性,结果见图7。结果显示:转化重组载体pGBKT7-McHD-Zip3的酵母细胞能在SD/-Trp一缺培养基和SD/-Trp/-His/-Ade三缺培养基上生长,均能使酵母细胞呈现出蓝色;而转化空载体pGBKT7(对照)的酵母细胞只能在SD/-Trp一缺培养基上生长,不能使酵母细胞呈现蓝色,表明McHD-Zip3转录因子具有转录激活活性。
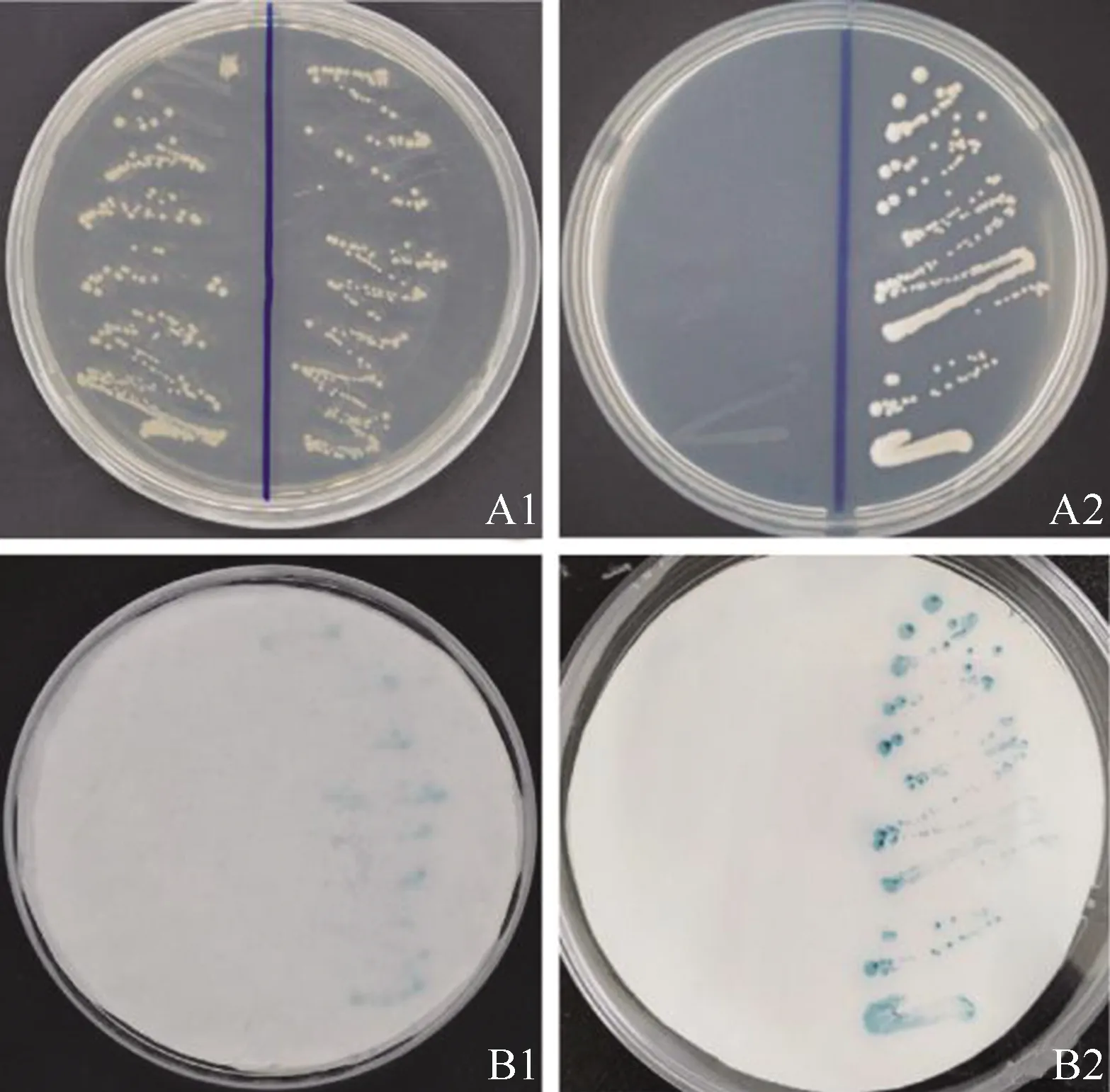
A:酵母细胞生长情况Growing of yeast cells;B:LacZ活性检测Activity detection ofLacZ.1:SD/-Trp培养基 Culture medium of SD/-Trp;2:SD/-Trp/-His/-Ade培养基Culture medium of SD/-Trp/-His/-Ade.培养皿左半边和右半边分别为转化空载体pGBKT7(对照)和重组载体pGBKT7-McHD-Zip3的酵母细胞The left half and right half of culture dish are yeast cells transformed the empty vector pGBKT7(the control)and the recombinant vector pGBKT7-McHD-Zip3,respectively.
图7 薄荷McHD-Zip3转录因子的转录激活活性分析结果
Fig.7 Analysis result of transactivation activity of McHD-Zip3 transcription factor ofMenthacanadensisLinn.
2.4 McHD-Zip3转基因烟草的腺毛发育状况
野生型烟草与McHD-Zip3转基因烟草的叶片腺毛发育状况比较结果见图8。结果显示:与野生型烟草相比,McHD-Zip3转基因烟草叶片的腺毛密度明显增加,说明McHD-Zip3基因能够在烟草叶片表皮细胞中过表达,具有促进烟草腺毛发育的功能。
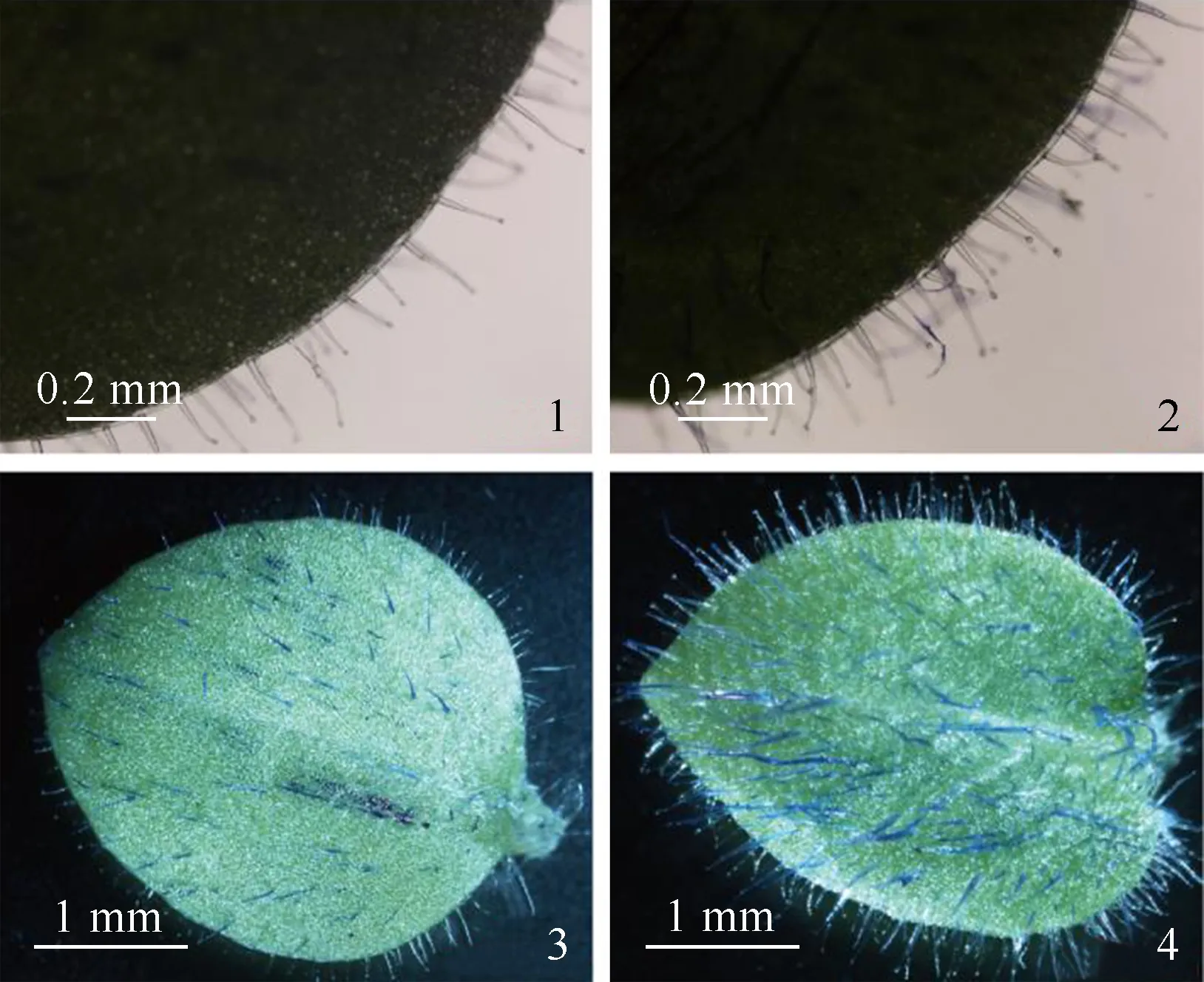
1,3:野生型植株的叶片 Leaf of wild type individual;2,4:McHD-Zip3转基因植株的叶片 Leaf ofMcHD-Zip3transgenic individual.
图8 野生型烟草与McHD-Zip3转基因烟草的叶片腺毛发育状况比较
Fig.8 Comparison on development of glandular trichomes on leaf between wild typeNicotianatabacumLinn.andMcHD-Zip3transgenicN.tabacum
3 讨论和结论
HD-Zip转录因子是植物中特有的一类转录因子,不同亚家族的保守结构域有所不同,其中HD-Zip Ⅰ亚家族含有保守的Homeodomain和bZip motif[28];HD-Zip Ⅱ亚家族除含有保守的Homeodomain和bZip motif外,其C端还含有1个CPSCE motif[29];HD-Zip Ⅲ亚家族含有Homeodomain、bZip motif、START domain、SAD domain以及C端的MEKHLA motif[30];HD-Zip Ⅳ亚家族与HD-Zip Ⅲ亚家族类似,但其C端缺少MEKHLA motif[31]。作者从薄荷中克隆获得1个HD-Zip转录因子编码基因McHD-Zip3,该基因编码的氨基酸序列含有Homeodomain、bZip motif、START domain和SAD domain,符合HD-Zip Ⅳ亚家族的特征,其中,Homeodomain参与DNA的结合,而bZip motif参与蛋白质二聚体的形成[17]。研究表明:McHD-Zip3转录因子具有转录激活活性,但HD-Zip Ⅳ亚家族行使转录激活功能的结构域仍存在争议。相关研究表明:在玉米(ZeamaysLinn.)的HD-Zip Ⅳ亚家族转录因子OCL1中,其START domain N端的85个氨基酸是其转录激活活性的关键位点,但是完整的START domain却不具有转录激活活性[32]。因此,START domain可能同时具有转录激活和抑制激活的功能,而HD-Zip Ⅳ亚家族转录因子的转录激活活性可能是多个结构域共同作用的结果。
HD-Zip Ⅳ亚家族基因可在植物表皮细胞中表达,对表皮细胞的分化有重要的调控作用。本研究结果表明:McHD-Zip3基因在薄荷的嫩叶和老叶中表达水平均较高,说明该基因可能主要在叶片中行使功能。HD-Zip Ⅳ亚家族转录因子是已知调控多细胞腺毛发育的最重要的一类转录因子。在黄花蒿中,响应茉莉酸信号的HD-Zip Ⅳ亚家族转录因子AaHD1能够促进腺毛发生并显著增加叶片表皮腺毛密度[12],且多个HD-Zip Ⅳ亚家族转录因子存在级联调控,如AaHD8通过形成蛋白复合体正向调控AaHD1[20],而AaHD1又能够调控AaHD7[12],通过级联反应共同调控腺毛发育。在前述的系统树上,McHD-Zip3基因编码的氨基酸序列与多种植物的腺毛发育相关HD-Zip转录因子聚为一支,其与黄花蒿AaHD7转录因子的亲缘关系最近,且后者能够促进腺毛发育[12],而薄荷腺毛与黄花蒿腺毛的结构与功能类似,均为分泌型多细胞腺毛,表明McHD-Zip3转录因子可能对薄荷腺毛发育具有类似功能。将McHD-Zip3基因转入烟草叶片后,该基因能够在烟草叶片中过表达,且烟草叶片的腺毛密度明显增加,说明McHD-Zip3转录因子与其他植物的腺毛发育相关的HD-Zip Ⅳ亚家族转录因子具有类似功能。
综合分析结果表明:薄荷中存在HD-Zip转录因子编码基因McHD-Zip3,其编码的氨基酸序列具有HD-Zip Ⅳ亚家族转录因子的保守结构域,定位于细胞核中,并且具有转录激活活性,是一个典型的转录激活子。McHD-Zip3基因在薄荷的嫩叶和老叶的表达量均较高,具有调控腺毛发育的功能。
