波生坦治疗新生儿缺氧性肺动脉高压的临床观察
2020-06-09陈波白波李广洪黄学良罗惠玲黄惠仪
陈波 白波 李广洪 黄学良 罗惠玲 黄惠仪

中圖分类号 R969;R722.1 文献标志码 A 文章编号 1001-0408(2020)10-1247-06
DOI 10.6039/j.issn.1001-0408.2020.10.17
摘 要 目的:观察波生坦治疗新生儿缺氧性肺动脉高压(HPH)的有效性和安全性。方法:选择2014年1月-2019年3月于我院新生儿科住院治疗的82例HPH新生儿为研究对象,按是否加用波生坦治疗分为波生坦组(50例)和非波生坦组(32例);另选取25例血清标本留取时间、出生胎龄、日龄等一般资料与波生坦组匹配的非HPH新生儿为对照组。所有HPH新生儿均给予持续静脉滴注盐酸多巴胺注射液5 mg/(kg·min),直到肺动脉收缩压(PASP)正常;在此基础上,波生坦组患儿加用波生坦片1 mg/kg(用适量注射用水溶解后喂服),q12 h,连用72 h。分析HPH患儿血清内皮素1(ET-1)水平与PASP的关系,并比较治疗前后波生坦组和非波生坦组HPH患儿的PASP和疗效以及3组患儿的动脉血气指标变化及不良反应发生情况。结果:治疗前,波生坦组患儿血清ET-1水平为(164.3±115.3)pg/mL,显著高于对照组的(41.9±3.7)pg/mL,且与PASP呈正相关(r=0.864,P<0.001)。波生坦组患儿的治疗总有效率为90.00%,显著高于非波生坦组的71.88%(P<0.05)。治疗72 h后,两组患儿的PASP均较治疗前显著下降(P<0.001),且波生坦组显著低于非波生坦组(P<0.05);3组患儿的动脉血氧分压、动脉血氧饱和度、动脉血二氧化碳分压和氧合指数均较治疗前显著改善(P<0.05),且波生坦组的动脉血氧分压、动脉血氧饱和度和氧合指数均显著高于非波生坦组(P<0.05)。在波生坦治疗期间及停药1周内,均未发现有患儿血清乳酸脱氢酶、天冬氨酸转氨酶、丙氨酸转氨酶及血清肌酐水平有明显变化。3组患儿喂养不耐受、贫血、白细胞及血小板减少的发生率比较,差异均无统计学意义(P>0.05)。结论:波生坦可改善HPH患儿的氧合状态,降低PASP,且短期用药是安全的。
关键词 缺氧性肺动脉高压;内皮素1;波生坦;新生儿;疗效;安全性
Clinical Observation of Bosentan in the Treatment of Hypoxic Pulmonary Hypertension in Neonates
CHEN Bo1,BAI Bo2,LI Guanghong2,HUANG Xueliang2,LUO Huiling2,HUANG Huiyi2(1. Dept. of Nosocomial Infection Management, Huadu Hospital Affiliated to Southern Medical University, Guangzhou 510800, China;2. Dept. of Neonatology, Huadu Hospital Affiliated to Southern Medical University, Guangzhou 510800, China)
ABSTRACT OBJECTIVE: To observe the effectiveness and safety of bosentan in the treatment of hypoxic pulmonary hypertension (HPH) in neonates. METHODS: From Jan. 2014 to Mar. 2019, a total of 82 HPH neonates hospitalized in the department of neonatology of our hospital were selected as research subjects. According to whether or not receiving bosentan therapy, 50 cases were included into bosentan group and 32 cases into non-bosentan group. Meanwhile, another 25 non-HPH neonates with serum sample retention time and general information such as gestational age at birth and day age matching the HPH group were selected as the control group. All neonates with HPH were given continuous intravenous infusion of Dopamine hydrochloride injection 5 mg/(kg·min) until PASP was normal. On this basis, neonates in the bosentan group were additionally given Bosentan tablets 1 mg/kg (fed after dissolving with appropriate amount of water for injection) for q12 h, 72 h. The relationship between serum ET-1 levels of neonates with HPH and PASP was analyzed, as well as PASP before and after treatment and therapeutic efficacy between bosentan and non-bosentan groups, the changes of arterial blood gas indexes and ADR in 3 groups were compared. RESULTS: Before treatment, the serum ET-1 levels of bosentan group was (164.3±115.3) pg/mL, which was significantly higher than (41.9±3.7)pg/mL of control group and positively correlated with PASP level (r=0.864,P<0.001). Total response rate of bosentan group was 90.00%, which was significantly higher than 71.88% of non-bosentan group (P<0.05). After 72 h of treatment, PASP of 2 groups was decreased significantly, compared with before treatment (P<0.001), and the bosentan group was significantly lower than the non-bosentan group (P<0.05). The PaO2,SaO2, PaCO2 and OI in 3 groups was significantly improved compared with that before treatment (P<0.001), and the PaO2,SaO2 and OI in the bosentan group was significantly higher than that in the non-bosentan group (P<0.05). During the treatment period of bosentan and within one week after drug withdrawal, there was no significant change in serum LDH, AST, ALT and Scr levels in neonates. There was no statistically significant difference in the incidence of feeding intolerance, anemia, reduced WBC and reduced PLT in 3 groups (P>0.05). CONCLUSIONS: Bosentan can improve the oxygenation status of neonates with HPH, reduce PASP, and short-term medication is safe.
KEYWORDS Hypoxic pulmonary hypertension; ET-1; Bosentan; Neonate; Efficacy; Safety
新生儿缺氧性肺动脉高压(Hypoxic pulmonary hypertension,HPH)是指新生儿出生前后因缺氧、酸中毒等引起肺动脉收缩、痉挛或肌层增生,使肺循环阻力、肺动脉压力升高而引起的呼吸、循环系统等严重功能障碍。HPH若未予以及时干预和处理,可进一步发展为新生儿持续肺动脉高压(Persistent pulmonary hypertension of newborn,PPHN),而后者导致患儿死亡的概率高达10%~20%[1]。HPH的发生机制较为复杂,体内很多血管活性物质及体液因子在缺氧发生后都有可能介入到肺血管舒缩调节过程中。动物实验表明,新生大鼠在缺氧早期即可发现其肺组织中内皮素1(ET-1)表达显著增多,其平均肺动脉压也显著增加[2],敲除小鼠内皮细胞ET-1基因后,不仅其血ET-1水平明显下降,而且其血压也显著降低[3-4]。在肺动脉高压患者中也发现,其血浆ET-1水平明显升高,且升高程度与肺血管阻力、右心房压力及患者不良结局密切相关[5],因而认为ET-1水平增高可能是促进HPH发生的重要原因。近年来,不少学者已开始关注ET-1与新生儿HPH的关系。吸入一氧化氮(iNO)是目前唯一被美国FDA认可的PPHN治疗方法,也是临床用于治疗PPHN的基石[6-7],但鉴于气体来源困难、使用设备昂贵、吸入效果个体差异大、停止治疗后可能存在“反跳”现象等不利因素,使得该方法的应用受到极大的限制,故寻找其替代治疗方法显得尤为迫切[8]。波生坦(Bosentan)为ET-1受体拮抗剂,已被多个指南推荐用于成人肺动脉高压的靶向治疗 [7,9],且已有将其用于治疗PPHN的国外报道[7,10-16],但国内相关的文献报道较少。为此,本研究以HPH新生患儿为对象,初步探讨波生坦治疗HPH的疗效和安全性,旨在为该症的临床治疗提供参考。
1 资料与方法
1.1 纳入与排除标准
本研究选择2014年1月-2019年3月于我院新生儿科住院治疗的HPH新生儿,根据其是否使用波生坦治疗分为波生坦组和非波生坦组,并选取同期住院的且一般资料(如出生胎龄、出生体质量、日龄、性别等)和血清标本留取时间与波生坦组匹配的非HPH新生儿作为对照组。
波生坦组纳入标准:(1)胎龄32~42周;(2)具有明确围生期缺氧史及缺氧症状和体征,并且需予以经鼻持续气道正压通气(NCPAP)或高频振荡通气(HFOV)治疗才可维持经皮血氧饱和度(TcSO2)≥90%;(3)床旁彩色多普勒超声检查结果显示肺动脉收缩压(PASP)>35 mmHg(1 mmHg=0.133 kPa)[17],伴或不伴动脉导管水平的双向分流或动脉导管、卵圆孔水平的右向左分流;(4)家属同意使用波生坦治疗并同意留取患儿静脉血进行ET-1水平检测,同时签署了知情同意书。
非波生坦组纳入标准:除家属不同意或其他原因未能留取患儿静脉血进行ET-1水平检测或家属不同意使用波生坦治疗外,其余标准与波生坦组相同。
上述两组排除标准相同,即:(1)合并膈疝、肺气漏、复杂型先天性心脏病及母亲产前应用过非甾体类抗炎药的新生儿;(2)低血压(即足月儿收缩压<50 mmHg,早产儿收缩压<40 mmHg)者;(3)血清乳酸脱氢酶(LDH)>正常值上限1.5倍、天冬氨酸转氨酶(AST)或丙氨酸转氨酶(ALT)>正常值上限3倍[10]者;(4)血肌酐(Scr)>正常值上限3倍[7]者;(5)静脉血白细胞(WBC)<2.5×109 L-1,血小板(PLT)<50×109 L-1[7]者。
对照组纳入标准:(1)胎龄、日龄、性别、分娩方式、血清标本留取时间、基础疾病等与波生坦组相匹配;(2)需接受NCPAP或HFOV治疗者;(3)动态PASP≤35 mmHg。排除标准:(1)治疗期间PASP>35 mmHg者;(2)需接受NCPAP或HFOV治療才可维持TcSO2≥90%,但是连续24 h未行床旁彩色多普勒超声检查者。所有患儿家属均在入院时同意将患儿相关标本及信息用于科研活动。
1.2 研究对象
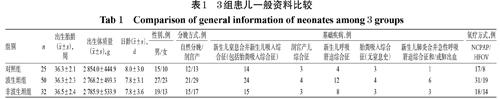
本研究最终纳入波生坦组和非波生坦组HPH新生儿50、32例,并纳入对照组非HPH新生儿25例。3组患儿的出生胎龄、体质量、日龄、性别、分娩方式、基础疾病等一般资料比较,差异均无统计学意义(P>0.05),具有可比性,详见表1。本研究方案通过南方医科大学附属花都医院医学伦理委员会审查、批准。
1.3 治疗方法
3组患儿均参照《实用新生儿学》(第4版)[18]进行综合管理和治疗,并根据缺氧表现、TcSO2及动脉血气分析结果按《新生儿机械通气常规》[19]予以NCPAP或HFOV,调节并维持TcSO2≥90%、动脉血氧分压(PaO2)≥60 mmHg、动脉血二氧化碳分压(PaCO2)30~55 mmHg、血pH值7.25~7.45。所有HPH新生儿均给予持续静脉滴注盐酸多巴胺注射液(亚邦医药股份有限公司,批准文号:国药准字H32023366,规格:2 mL ∶ 20 mg)5 g/(kg·min),直到PASP正常(即≤35 mmHg);在此基础上,波生坦组患儿加用波生坦片[瑞士(Actelion Pharmaceuticals Ltd.,注册证号:H20110291,规格:62.5 mg(以C27H29N5O6S计)]1 mg/kg(用适量注射用水溶解后喂服),q12 h,连用72 h[13]。
1.4 观察指标及测定方法
1.4.1 血清ET-1水平 波生坦组及对照组患儿在入组时,采集肘静脉或桡静脉血2 mL,置于含有分离胶的真空采血管中,以3 000 r/min离心10 min,留取上层血清,置于-80 ℃低温冰箱保存,待测。采用双抗体夹心酶联免疫吸附法(ELASA)检测两组患儿的血清ET-1水平,检测仪器为Elx800型酶标仪(美国BioTek公司),检测试剂盒为ET-1 ELASA试剂盒(上海科顺生物科技有限公司,批号:995170905)。严格按照试剂盒说明书操作。
1.4.2 PASP 测定所有纳入患儿的PASP,检测仪器为CX-30床旁彩色多普勒超声诊断仪(荷兰Philips公司),探头频率为3.75~7.00 MHz。具体步骤如下:首先常规探查患儿胸骨旁、心尖、剑突下和锁骨上各标准切面,测定三尖瓣反流(TR)速度、肺动脉瓣反流速度及动脉导管分流速度;根据简化Bernoulli方程计算出右心室与右心房、右心室与肺动脉及主动脉与肺动脉之间的压差;根据TR程度判断收缩期右心房压力(SRAP),当由右心室反流至右心房的血液量占右心房容积的比值为≤1/2、>1/2~3/4、>3/4时,分别设定SRAP为5、10、15 mmHg,此时PASP计算公式为:PASP(mmHg)=右心室与右心房之间的压差(mmHg)+SRAP(mmHg);若无TR及肺动脉瓣反流,而合并有动脉导管分流时,则PASP计算公式为:PASP(mmHg)=主动脉收缩压(mmHg)-主动脉与肺动脉之间的压差(mmHg),采用肱动脉收缩压代替主动脉收缩压[20]。记录对照组患儿治疗前以及波生坦组与非波生坦组患儿治疗前后的PASP,并于治疗过程中每6~12 h监测PASP 1次。
1.4.3 生命体征及动脉血气指标 除常规监测患儿体温(T)、脉搏(P)、呼吸(R)、TcSO2、血压外,每6~12 h至少做1次床旁动脉血气分析和电解质、血糖、乳酸检测,并记录3组患儿治疗前后的血气指标:PaO2、动脉血氧饱和度(SaO2)、PaCO2及氧合指数(OI)值,OI值=PaO2/ 吸入氧体积分数(FiO2)。血气指标检测标本采自患儿右侧桡动脉,每次0.1~0.2 mL。
1.4.4 不良反应监测 所有患儿入组后10 d内,除常规监测患儿的血压、喂养耐受情况外,对血常规、血清LDH、AST、ALT、Scr、总胆红素及电解质水平进行严密监测。当波生坦组患儿血清AST或ALT>正常值上限3倍、LDH>正常值上限1.5倍、Scr值较用药前升高2倍以上、WBC<2.5×109 L-1、PLT<50×109 L-1,若无其他可解释原因,则均认为可能与波生坦有关[7,10]。
1.5 疗效判断标准
显效:入组后72 h内发绀、气促等临床症状完全消失,PASP≤35 mmHg,TcSO2>90%;有效:发绀、气促等临床症状好转,PASP下降幅度>10 mmHg,TcSO2上升率>10%;无效:未达到以上标准[21]。总有效率=(显效例数+有效例数)/总例数×100%。
1.5 统计学方法
采用Excel 2007软件和SPSS 17.0软件进行数据处理和统计分析,采用Ssize软件确定满足本研究统计检验的最小样本量。对于近似正态分布且方差齐的计量资料采用x±s表示,两组间比较采用成组t检验,3组间比较采用单因素方差分析,进一步两两比较采用LSD法;计数资料以例数或率表示,采用χ2检验;血清ET-1水平与PASP的相关性采用Pearson两变量相关性检验。所有统计学检验均采用双侧检验,以P<0.05表示差异有统计学意义。
2 结果
2.1 血清ET-1水平与PASP的相关性
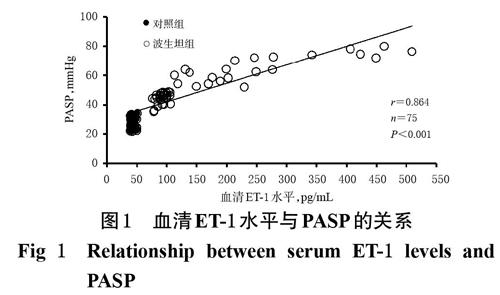
治疗前,波生坦组患儿血清ET-1水平为(164.3±115.3)pg/mL,显著高于对照组的(41.9±3.7)pg/mL(P<0.001)。相关性分析结果显示,血清ET-1水平与PASP成正相关(r=0.864,P<0.001),详见图1。
2.2 波生坦组与非波生坦组患儿治疗前后PASP比较
治疗前,波生坦组与非波生坦组患儿PASP比较差异无统计学意义(P>0.05)。治疗后,两组患儿的PASP均较治疗前显著下降(P<0.001),且波生坦组患儿显著低于非波生坦组(P<0.05),详见表2。
注:与治疗前比较,*P<0.001;与非波生坦组比较,#P<0.05
Note: vs. before treatment, *P<0.001; vs. non-bosentan group, #P<0.05
2.3 3组患儿血气指标改善情况比较
治疗前,3组患儿的血气PaO2、SaO2、PaCO2及OI比较差异均无统計学意义(P>0.05)。治疗后,3组患儿血气PaO2、SaO2、OI均较其治疗前显著增高,PaCO2显著降低(P<0.001),且波生坦组患儿的PaO2、SaO2、OI均显著高于非波生坦组(P<0.05),详见表3。
2.4 波生坦组与非波生坦组患儿疗效比较
波生坦组患儿的总有效率为90.00%,显著高于非波生坦组的71.88%(P<0.05),详见表4。
注:与非波生坦组比较,#P<0.05
Note:vs. non-bosentan group, #P<0.05
2.5 不良反应
在波生坦治疗期间及停药1周内,均未发现有患儿血清LDH、AST、ALT及Scr水平的变化达到“1.4.4”项下与波生坦不良反应有关的水平[13]。3组患儿喂养不耐受、贫血、WBC及PLT减少的发生率比较,差异均无统计学意义(P>0.05)。波生坦组中有3例患儿发生低血压(2例足月儿、1例早产儿),但均合并有严重肺部感染及肺出血;非波生坦组有2例、对照组有1例患儿发生低血压,因样本量过小,未做统计学分析,详见表5。
3 讨论
早期低氧性肺血管收缩及随后的低氧性肺血管重塑,是HPH发生的两个重要环节,前者主要发生在急性缺氧时,后者则出现在慢性缺氧时[1,4,22]。低氧及胎粪吸入综合征、呼吸窘迫综合征、严重感染、窒息等缺氧性疾病均可引起新生儿肺动脉压增高,其中低氧是最主要的高危因素[1,20]。在本研究中,肺动脉高压患儿的PaO2、SaO2均显著降低于正常值(PaO2正常值:50~80 mmHg,SaO2正常值:88%~95%),与此观点一致。有研究显示,缺氧可引起血管内皮细胞损伤,并促进血管内皮细胞ET-1的合成与释放[3-4]。ET-1是迄今发现的作用最强的血管收缩因子,在血管收缩、重构以及血栓形成过程中发挥了重要作用[5]。在本研究中,笔者比较了50例HPH和25例非HPH新生儿治疗前的血清ET-1水平,结果显示,HPH新生儿的ET-1水平显著高于非HPH新生儿,且ET-1水平与PASP成正相关,与文献研究结果[20,22]相似,提示ET-1在新生儿HPH的发生过程中可能具有重要作用。
ET-1主要由血管内皮细胞产生,肺部是其分泌和代谢的主要场所[4,22],其受体编码基因ETA、ETB mRNA除在肺血管的平滑肌细胞上均有较高表达外,ETB mRNA在肺血管的内皮细胞上也有较高表达,提示ET受体在肺组织里的分布较为密集[4-5]。ET-1与血管平滑肌细胞上的ET受体A(ETA)、ETB结合后,可引起血管强烈收缩[22-24],导致血管进一步狭窄、阻力增加和血管重构,最终导致肺动脉高压形成[4,25];但ET-1同时也可与位于内皮细胞上的ETB结合,促进一氧化氮、环前列腺素等扩血管物质的释放,平衡ET-1 的缩血管作用,并促进ET-1的清除[4-5,25]。缺氧不仅可通过缺氧反应元件诱导血管内皮细胞合成释放更多的ET-1,而且还可使血管平滑肌上ETA、ETB表达增多,血管内皮细胞上的ETB表达减少[25],从而导致血管的舒缩功能失衡,这可能也是新生儿HPH发生的重要机制。近几十年来,国内外对是否可用ET受体拮抗剂来治疗HPH进行了大量研究,目前《中国肺高血压诊断和治疗指南(2018)》[9]已将波生坦列为治疗成人肺动脉高压的靶向药物之一,但对该药是否也可用于新生儿HPH的治疗,国内外学者的关注并不多。
波生坦为一种非选择性的ET受体拮抗药,可通过阻滞ET-1与肺血管平滑肌细胞上的ETA、ETB结合而阻滞ET-1的强烈缩血管作用。Mohamed WA等[13]在早先的一项以波生坦治疗PPHN的双盲、随机、对照研究中发现,服用波生坦6 h后,患儿的OI开始改善,治疗有效率为87.5%;Fatima N等[15]的一项单盲研究结果显示,波生坦联合西地那非治疗PPHN,患儿服药3 d后的肺动脉压下降幅度明显高于单用西地那非者;More K等[14]報道,波生坦无论单独给药或作为iNO的辅助用药,患儿缺氧改善状况及机械通气持续时间均显著优于相应的对照组;在Maneenil G等[16]的一项回顾性研究中,对轻中度PPHN但未达iNO治疗标准的患儿,加用波生坦2 h后,其OI、肺泡-动脉血氧分压差(PA-aO2)、SaO2均明显改善,对重度PPHN且予iNO治疗效果不好者加用波生坦6 h后的OI、PA-aO2及SaO2也有明显改善。但Steinhorn RH等[7]的多中心、随机、对照研究却与以上结果不一致,该文作者指出,应用波生坦辅助iNO治疗PPHN并未明显改善OI的原因可能与样本量小、观察组(13例)病情较对照组(8例)病情更严重以及波生坦吸收有所延迟有关 。在本研究中,HPH新生儿在治疗72 h后PASP和PaO2、SaO2、PaCO2、OI均较治疗前有明显改善,且波生坦组的PaO2、SaO2和OI均显著高于非波生坦组,PASP显著低于非波生坦组,治疗总有效率更高,与文献研究结果[10-16]相似。
波生坦已知的可能影响肝肾功能的不良反应在本研究中未被发现,而如喂养不耐受、贫血、WBC及PLT减少等其他不良反应虽有发生,但可能与患儿感染、肺出血等原发或继发疾病有关[7],而且3组患儿的发生率比较差异均无统计学意义。波生坦组有3例患儿发生低血压,但都发生在入组后12 h内且皆合并有严重肺部感染及肺出血,经扩容和调整多巴胺输注速度等处理后,患儿血压很快恢复正常;同时,非波生坦组及对照组中也有患儿发生低血压,但由于例数较少,未能进行统计学分析,亦无法确认本研究中低血压的发生与波生坦的使用有关。
此外,本研究由于时间跨度稍长、样本量相对较小,未能动态监测HPH患儿血清ET-1的水平变化,可能对研究结果造成一定影响,这也是本研究的不足之处。
综上所述,波生坦对改善HPH新生儿的氧合状态、降低肺PASP是有效的,且短期使用是安全的。
参考文献
[ 1 ] 杜延娜,富建华,薛辛东.低氧致肺动脉高压新生大鼠TRIP6和cyclinD1表达及其对肺血管重塑的影响[J].中国小儿急救医学,2016,23(11):774-779.
[ 2 ] WANG L,ZHOU Y,LI M,et al. Expression of hypoxia- inducible factor-1α,endothelin-1 and adrenomedullin in newborn rats with hypoxia-induced pulmonary hypertension[J]. Exp Ther Med,2014,8(1):335-339.
[ 3 ] KIM FY,BARNES EA,YING L,et al. Pulmonary artery smooth muscle cell endothelin-1 expression modulates the pulmonary vascular response to chronic hypoxia[J]. Am J Physiol Lung Cell Mol Physiol,2015,308(4):368-377.
[ 4 ] DAVENPORT AP,HYNDMAN KA,DHAUN N,et al. Endothelin[J]. Pharmacol Rev,2016,68(2):357-418.
[ 5 ] DHAUN N,WEBB DJ. Endothelins in cardiovascular biology and therapeutics[J]. Nat Rev Cardiol,2019. DOI:10.1038/s41569-019-0176-3.
[ 6 ] MATHEW B,LAKSHMINRUSIMHA S. Persistent pulmonary hypertension in the newborn[J]. Children,2017. DOI:10.3390/children4080063.
[ 7 ] STEINHORN RH,FINEMAN J,KUSIC-PAJIC A,et al. Bosentan as adjunctive therapy for persistent pulmonary hypertension of the newborn:results of the randomized multicenter placebo-controlled exploratory trial[J]. J Pediatr,2016. DOI:10.1016/j.jpeds.2016.06.078.
[ 8 ] 成梦遇,宓亚平,桂永浩,等.吸入一氧化氮和伊洛前列素治疗婴幼儿先天性心脏病术后中重度肺动脉高压的随机对照研究[J].中华实用儿科临床杂志,2015,30(13):1004-1006.
[ 9 ] 中华医学会心血管病学分会肺血管病学组,《中华心血管病杂志》编辑委员会.中国肺高血压诊断和治疗指南:2018[J].中华心血管病杂志,2018,46(12):933-964.
[10] GOISSEN C,GHYSELEN L,TOURNEUX P,et al. Persistent pulmonary hypertension of the newborn with transposition of the great arteries:successful treatment with bosentan[J]. Eur J Pediatr,2008,167(4):437-440.
[11] NAKWAN N,CHOKSUCHAT D,SAKSAWAD R,et al.Successful treatment of persistent pulmonary hypertension of the newborn with bosentan[J]. Acta Paediatr,2009,98(10):1683-1685.
[12] RADICIONI M,BRUNI A,CAMERINI P. Combination therapy for life-threatening pulmonary hypertension in a premature infant:first report on bosentanuse[J]. Eur J Pediatr, 2011,170(8):1075-1078.
[13] MOHAMED WA,ISMAIL M. A randomized,double- blind,placebo-controlled,prospective study of bosentan for the treatment of persistent pulmonary hypertension of the newborn[J]. J Perinatol,2012,32(8):608-613.
[14] MORE K,ATHALYE-JAPE GK,RAO SC,et al. Endothelin receptor antagonists for persistent pulmonary hypertension in term and late preterm infants[J]. Cochrane Database Syst Rev, 2016. DOI:10.1002/14651858.
[15] FATIMA N,ARSHAD S,QUDDUSI AI,et al. Comparison of the efficacy of sildenafil alone versus sildenafil plus bosentan in newborns with persistent pulmonary hypertension[J]. J Ayub Med Coll Abbottabad,2018,30(3):333-336.
[16] MANEENIL G,THATRIMONTRICHAI A,JANJINDAMAI W,et al. Effect of bosentan therapy in persistent pulmonary hypertension of the newborn[J]. Pediatr Neonatol,2018,59(1):58-64.
[17] 中華医学会儿科学分会新生儿学组,《中华儿科杂志》编辑委员会. 新生儿肺动脉高压诊治专家共识[J].中华儿科杂志,2017,55(3):163-168.
[18] 邵肖梅,叶鸿眉,邱小汕.实用新生儿学[M].4版.北京:人民卫生出版社,2012:395-451.
[19] 《中华儿科杂志》编辑委员会,中华医学会儿科学分会新生儿学组.新生儿机械通气常规[J].中华儿科杂志,2015,53(5):327-330.
[20] HAN CF,LI ZY,LI TH. Roles of hypoxia-inducible factor-1α and its target genes in neonatal hypoxic pulmonary hypertension[J]. Eur Rev Med Pharmacol Sci,2017,21(18):4167-4180.
[21] 杨雪峰.米力农联合高频通气对持续性肺动脉高压新生儿动脉血气指标及机械通气时间的影响[J].实用临床医药杂志,2018,22(11):33-35.
[22] LIU G,WU HW,LI ZG. Study on sildenafil combined with inhalationalnitric oxide therapy on the curative effects and serum levels of HIF-1α,ET-1,and calcium in neonatal pulmonary hypertension[J]. Eur Rev Med Pharmacol Sci,2018,22(14):4683-4690.
[23] REYES RV,CASTILLO-GAL?N S,HERNANDEZ I,et al. Revisiting the role of TRP,Orai,and ASIC channels in the pulmonary arterial response to hypoxia[J]. Front Physiol, 2018. DOI:10.3389/fphys.2018.00486.
[24] SOMMER N,STRIELKOV I,PAK O,et al. Oxygen sensing and signal transduction in hypoxic pulmonary vasoconstriction[J]. Eur Respir J,2016,47(1):288-303.
[25] LAN NSH,MASSAM BD,KULKARNI SS,et al. Pulmonary arterial hypertension:pathophysiology and treatment[J]. Diseases,2018. DOI:10.3390/diseases 6020038.
(收稿日期:2019-09-08 修回日期:2020-03-30)
(编辑:孙 冰)
