齐墩果酸对人卵巢癌SKOV3细胞增殖、侵袭、转移的影响及其作用机制研究
2020-06-09杜贵强张永莉胡孝辉
杜贵强 张永莉 胡孝辉

中图分类号 R285 文献标志码 A 文章编号 1001-0408(2020)10-1190-08
DOI 10.6039/j.issn.1001-0408.2020.10.07
摘 要 目的:探讨齐墩果酸抑制人卵巢癌SKOV3细胞增殖、侵袭、转移的作用及其机制。方法:采用CCK-8法检测不同浓度齐墩果酸(10、20、40、60、80、100 μmol/L)作用12、24、36、48 h对卵巢癌SKOV3细胞增殖能力的影响;采用Transwell实验观察低、高剂量齐墩果酸(20、40 μmol/L)作用24 h对SKOV3细胞迁移及侵袭能力的影响;采用Western Blotting法检测低、高剂量齐墩果酸对SKOV3细胞中核因子κB p65 (NF-κB p65)、肝再生磷酸酶3(PRL-3)、肿瘤坏死因子α (TNF-α)、白细胞介素6 (IL-6)、上皮钙黏着蛋白E (E-cadherin)等蛋白表达的影响;运用脂多糖(LPS)诱导和NF-κB p65质粒转染SKOV3细胞,采用Western blotting法和實时荧光定量PCR考察低、高剂量齐墩果酸对NF-κB/PRL-3通路相关蛋白及其mRNA表达的影响。结果:随着齐墩果酸给药浓度的增加和作用时间的延长,SKOV3细胞的增殖能力有随之降低的趋势,各剂量组的细胞存活率均显著低于对照组(P<0.05或P<0.01)。低、高剂量的齐墩果酸组的迁移和侵袭细胞数均显著减少(P<0.05或P<0.01),且其NF-κB p65、PRL-3、TNF-α、IL-6蛋白的相对表达量均显著降低,E-cadherin蛋白的相对表达量均显著升高(P<0.05或P<0.01)。经LPS刺激后,LPS模型组细胞中NF-κB p65、PRL-3、TNF-α、IL-6 蛋白及其mRNA的相对表达量较对照组显著升高,E-cadherin 蛋白及其mRNA的相对表达量均显著降低(P<0.05或P<0.01);低、高剂量齐墩果酸组细胞中NF-κB p65、PRL-3、TNF-α、IL-6 蛋白及其mRNA的相对表达量均显著降低,E-cadherin 蛋白及其mRNA的相对表达量均显著升高(P<0.05或P<0.01)。在NF-κB p65过表达SKOV3细胞中,低、高剂量齐墩果酸同样能够显著下调NF-κB p65、PRL-3、TNF-α、IL-6蛋白的表达,显著上调E-cadherin 蛋白的表达(P<0.05或P<0.01)。结论:齐墩果酸能够通过调控NF-κB/PRL-3信号通路来抑制人卵巢癌细胞SKOV3的增殖、侵袭、转移。
关键词 齐墩果酸;卵巢癌;SKOV3细胞;增殖;侵袭;转移;核因子κB;肝再生磷酸酶3
Study on the Effects of Oleanolic Acid on the Proliferation, Invasion and Metastasis of Human Ovarian Cancer SKOV3 Cells and Its Mechanism
DU Guiqiang,ZHANG Yongli,HU Xiaohui(Dept. of Gynecology, the First Affiliated Maternal and Infant Hospital of Tongji University, Shanghai 200126, China)
ABSTRACT OBJECTIVE: To investigate the effects and mechanism of oleanolic acid on inhibiting the proliferation, invasion and metastasis of human ovarian cancer SKOV3 cells. METHODS: CCK-8 assay was used to detect the effects of different concentrations of oleanolic acid (10, 20, 40, 60, 80, 100 μmol/L) on the proliferation of ovarian cancer SKOV3 cells at 12, 24, 36 and 48 h. The effects of low-dose and high-dose of oleanolic acid (20, 40 μmol/L) on the metastasis and invasion ability of SKOV3 cells for 24 h were observed in Transwell assay. Western blotting assay was used to detect the effects of low-dose and high-dose of oleanolic acid on the protein expression of NF-κB p65, PRL-3,TNF-α, IL-6 and E-cadherin in SKOV3 cells. Through LPS induction and NF-κB p65 plasmid transfection, Western blotting and RT-qPCR assay were used to investigate the effects of low-dose and high-dose oleanolic acid on the expression of NF-κB/PRL-3 pathway related proteins and their mRNA. RESULTS: With the increase of the concentration and action time of oleanolic acid, the proliferation capacity of ovarian cancer SKOV3 cells was decreased, the surval rates of administration groups were significantly lower than that of the control group (P<0.05 or P<0.01). Low-dose and high-dose of oleanolic acid could significantly reduce the number of migrating and invading cells (P<0.05 or P<0.01). The protein relative expression of NF-κB p65, PRL-3, TNF-α and IL-6 in SKOV3 cells were significantly decreased, while the protein relative expression of E-cadherin was significantly increased (P<0.05 or P<0.01). After LPS induction, protein and mRNA relative expression of NF-κB p65, PRL-3, TNF-α and IL-6 were increased significantly in LPS model group, while protein and mRNA relative expression of E-cadherin were significantly decreased (P<0.05 or P<0.01). The protein and mRNA relative expression of NF-κB p65, PRL-3, TNF-α and IL-6 were significantly decreased, and protein and mRNA relative expression of E-cadherin were significantly increased in low-dose and high-dose of oleanolic acid group (P<0.05 or P<0.01). In SKOV3 cells with over-expressed NF-κB p65,low-dose and high-dose of oleanolic acid could significantly down-regulat the protein expression of NF-κB p65, PRL-3, TNF-α and IL-6, while upregult the protein relative expression of E-cadherin (P<0.05 or P<0.01). CONCLUSIONS: Oleanolic acid can inhibit SKOV3 cells proliferation, invasion and metastasis by regulating NF-κB/PRL-3 signaling pathway.
KEYWORDS Oleanolic acid; Ovarian cancer; SKOV3 cell; Proliferation; Invasion; Metastasis; NF-κB; PRL-3
卵巢癌是最常见的女性生殖器官恶性肿瘤之一,其致死率在妇科肿瘤中居首位,对女性生命健康造成严重威胁[1-2]。卵巢深居盆腔,体积小,卵巢癌早期缺乏典型症状且发展迅速,极易发生侵袭转移[3],超过70%的患者在晚期才被确诊[4],因此临床上卵巢癌治疗效果和患者预后均较差。流行病学调查结果表明,在全球范围内每年新增卵巢癌病例超过22.5万,死亡人数超過14万[5-6],临床在卵巢癌的预防和治疗方面均面临巨大挑战。目前,临床治疗卵巢癌以药物治疗为主,但奥拉帕利等卵巢癌一线治疗药物的长期使用易引发多种不良反应,并导致肿瘤细胞耐药[7],严重影响药物治疗效果及患者预后。因此,寻找安全有效防治卵巢癌的药物对于提升卵巢癌的治疗效果具有重要的意义。
齐墩果酸是一种广泛存在于各种水果和可食用植物中的一种五环三萜类化合物,具有显著的抗炎作用[8-9]。越来越多的研究证实,炎症是肿瘤微环境的基本特征,炎症信号通路活化与肿瘤的发生发展密切相关[10-11]。核因子κB(NF-κB)信号通路可促进肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)等炎症因子的释放,抑制上皮钙黏着蛋白E(E-cadherin)的表达进而促进肿瘤细胞发生上皮间质转化,是肿瘤细胞增殖、侵袭、转移过程中重要的调节通路[12-13]。因此,抑制NF-κB信号通路以调节肿瘤细胞炎症微环境,进而抑制细胞增殖、侵袭、转移可作为防治肿瘤的新策略。McQueeney KE等[14]的研究表明,肿瘤侵袭转移关键因子肝再生磷酸酶3(PRL-3)在卵巢癌细胞中呈高表达,其通过活化端粒结合蛋白RAP1进而激活NF-κB信号通路以促进肿瘤侵袭、转移;Wang Z等[15]的研究表明,NF-κB p65在卵巢癌SKOV3细胞中异常表达,抑制该蛋白的表达则可抑制SKOV3细胞的增殖、侵袭、转移。由此可见,NF-κB/PRL-3信号通路与卵巢癌细胞侵袭、转移密切相关,有望作为卵巢癌防治的新靶标。研究表明,齐墩果酸对宫颈癌、肝癌、肺癌等多种恶性肿瘤细胞的增殖、侵袭、转移均具有抑制作用[16-18],但其对卵巢癌细胞增殖、侵袭、转移的影响及其机制仍不明确。基于此,本研究以人卵巢癌SKOV3细胞为对象,探讨齐墩果酸对其增殖、侵袭、转移的影响及其机制,以期为该化合物防治卵巢癌提供理论研究基础。
1 材料
1.1 仪器
3111型CO2培养箱(美国Thermo Fisher Scientific公司);xMark型酶标仪、164-5050型电泳仪、170-4156型全能蛋白转膜仪、TC20型细胞计数器、Gel Doc XR型凝胶成像系统、iQ5型实时荧光定量聚合酶链反应(PCR)仪等购自美国Bio-Rad公司;M400D型离心机(上海迈皋科学仪器有限公司);ML-T型分析天平(瑞士Mettler Toledo多公司);CKX31型倒置显微镜(日本Olympus公司)。
1.2 药品与试剂
齐墩果酸对照品(批号:O110087,纯度:>98%)、脂多糖(LPS,批号:L118716)均购自上海阿拉丁试剂有限公司; NF-κB p65质粒(北京华越洋生物科技有限公司,批号:VECT76065);LipofectamineTM2000转染试剂(批号:12566014)、TRIzolTMRNA提取试剂(批号:12183555)、BCA 蛋白定量试剂盒(批号:23227)、ECL超敏化学发光液(批号:34580)、M-PERTM哺乳动物蛋白提取试剂(批号:78501)均购自美国Thermo Fisher Scientific公司;胎牛血清(FBS,批号:10099-141)、0.25%胰蛋白酶溶液(批号:25200-056)、青霉素-链霉素双抗(批号:15070063)均购自美国Gibco公司;DMEM培养基(美国HyClone公司,批号:SH30022.01);NF-κB p65、PRL-3、TNF-α、IL-6、E-cadherin、GAPDH等编码基因上、下游引物和探针均由生工生物工程 (上海) 股份有限公司设计与合成;荧光定量PCR试剂(上海星汉生物科技有限公司);结晶紫染色液(北京索莱宝科技有限公司,批号:G1063);CCK-8试剂盒(日本Dojindo公司,批号:CK04);NF-κB p65兔单克隆抗体、PRL-3兔多克隆抗体、TNF-α兔单克隆抗体、白细胞IL-6兔单克隆抗体、E-cadherin兔单克隆抗体、β-肌动蛋白(β-actin)兔单克隆抗体、辣根过氧化物酶标记的山羊抗兔免疫球蛋白(IgG)二抗均购自美国CST公司(批号分别为8242、6484、11948、12912、3195、4970、7074);十二烷基硫酸钠-聚丙烯酰胺电泳(SDS-PAGE)凝胶快速制备试剂盒(上海联迈生物工程有限公司,批号:LM-048);其余试剂均为实验室常用规格,水为超纯水。
1.3 细胞
人卵巢癌SKOV3细胞株(批号:TCHu185)购自中国科学院生物化学与细胞生物学研究所。
2 方法
2.1 细胞培养
SKOV3细胞用含10%FBS、1%青霉素-链霉素双抗的DMEM培养基(以下简称“完全培养基”),在37 ℃、5%CO2的培养箱中培养(培养条件下同),待细胞处于对数生长期时进行后续试验。
2.2 齐墩果酸药液配制
精密称取齐墩果酸对照品适量,溶于二甲基亚砜1 mL中,配成浓度为1×105 ?mol/L的母液,于-20 ℃保存;用时取上述母液适量,加完全培养基稀释,经0.22 ?m微孔滤膜滤过后,即得,备用。
2.3 细胞毒性检测
采用CCK-8法检测。取对数生长期的SKOV3细胞,以4 000个/孔接种于96孔板中,培养24 h时将细胞随机分为对照组及不同浓度药物组,另设不含细胞只含培养基的空白组,每组设6个复孔。各给药组分别加入齐墩果酸终浓度为10、20、40、60、80、100 μmol/L(浓度设置参考文献[19])的含药完全培养基100 μL,对照组和空白组加入完全培养基100 μL,分别于培养12、24、36、48 h时,加入CCK-8试剂10 μL ,继续培养2 h后,使用酶标仪于450 nm波长处测定各孔吸光度(A),计算细胞存活率:细胞存活率(%)=(A试验组-A空白组)/(A对照组-A空白组)×100%。上述试验重复3次。
2.4 分组、造模与给药
2.4.1 齐墩果酸对SKOV3细胞的作用 取SKOV3细胞,以5×106个/皿接种于细胞培养皿中培养;待细胞生长融合至80%时,将其随机分为对照组和齐墩果酸低、高剂量药物组(剂量设置参考“2.3”项下结果),每组设3个复孔。药物组分别加入低、高剂量齐墩果酸含药完全培养基5 mL,对照组加入完全培养基5 mL,培养24 h。
2.4.2 齐墩果酸对LPS诱导SKOV3细胞的作用 取SKOV3细胞,以5×106个/皿接种于细胞培养皿中培养;待细胞生长融合至80%时,将其随机分为对照组、LPS模型组和齐墩果酸低、高剂量药物组(剂量设置参考“2.3”项下结果),每组设3个复孔。对照组加入完全培养基5 mL,模型组加入LPS终浓度为100 ?g/L 的含药完全培养基5 mL[20],药物组加入为100 ?g/L LPS和低、高剂量齐墩果酸含药完全培养基5 mL,培养24 h。
2.4.3 齐墩果酸对NF-κB p65转染的SKOV3细胞的作用 取SKOV3细胞,以5×106个/皿接种于细胞培养皿中培养;待细胞生长融合至80%时,将其随机分为对照组、NF-κB p65过表达模型组和齐墩果酸低、高剂量药物组(剂量设置参考“2.3”项下结果),模型组及药物组加入NF-κB p65过表达载体(LipofectamineTM2000转染试剂10 ?L与NF-κB p65质粒10 ?g于室温下孵育20 min即得)转染12 h后,药物组分别加入低、高剂量齐墩果酸含药完全培养基5 mL,对照组及模型组给予完全培养基5 mL,培养24 h。
2.5 Transwell迁移实验
将SKOV3细胞用不含FBS的DMEM培养基培养24 h,使其处于饥饿状态。SKOV3细胞经胰蛋白酶消化后用DMEM培养基制成细胞悬液,以1×105个/孔加入到Transwell小室上层中,小室下层加入DMEM培养基(含10%FBS)800 μL,培养24 h。按“2.4.1”项下方法分组、给药,培养24 h后,取出小室,用棉签擦去小室内侧底部未穿膜的细胞,经多聚甲醛固定、结晶紫染色液染色后,在显微镜下选取5个不同视野观察,计算各组细胞迁移数目(迁移细胞被染成紫色)。上述试验重复3次。
2.6Transwell侵袭实验
Matrigel胶融化后均匀铺于Transwell小室底部上层中,37 ℃放置致凝固。其余操作同“2.5”项下方法,选取5个不同视野在显微镜下观察,计算各组细胞侵袭数目。上述试验重复3次。
2.7 相关基因mRNA表达检测
采用实时荧光定量PCR法检测。SKOV3细胞按“2.4.1”“2.4.2”项下方法分组、给药、培养后,收集细胞,运用TRIzolTM RNA提取试剂提取细胞RNA,将其逆转录为cDNA后,采用实时荧光定量PCR仪检测NF-κB p65、PRL-3、TNF-α、IL-6、E-cadherin 等编码基因mRNA的表达水平。PCR反应体系(共20 ?L):cDNA 模板2 ?L,上、下游引物各1 ?L,荧光定量PCR试剂10 ?L,无酶水6 ?L。PCR扩增条件:95 ℃预变性2 min;95 ℃变性10 s,60 ℃退火30 s,72 ℃延伸15 s,共40个循环(引物序列见表1)。以GAPDH为内参,采用2-ΔΔCt法计算相关基因mRNA的相对表达量。上述试验重复3次。
2.8 相关蛋白表达检测
采用Western blotting法检测。SKOV3细胞按“2.4.1”~“2.4.3”項下方法分组、给药、培养后,收集细胞,运用M-PERTM哺乳动物蛋白提取试剂提取蛋白,后用BCA试剂盒测定蛋白浓度。随后将蛋白于95 ℃水浴中变性5 min后即得蛋白样品。取蛋白样品40 ?g在100 V、80 mA的电泳条件下进行SDS-PAGE,在25 V、1.0 A条件下转膜至PVDF膜(0.45 ?m)上,以5%脱脂牛奶封闭1 h后,加入NF-κB p65、PRL-3、TNF-α、IL-6、E-cadherin、β-actin等一抗(稀释度均为1 ∶ 1 000),在4 ℃条件下孵育过夜,TBST溶液清洗10 min×3次,加入辣根过氧化物酶标记的山羊抗兔IgG二抗(稀释度为1 ∶ 10 000),室温孵育1 h,TBST溶液清洗10 min×3次,经ECL显色后运用凝胶成像分析系统成像,采用Image J 1.8.0图像软件分析。以β-actin作为内参,以目标蛋白与内参的灰度值比值作为目标蛋白的相对表达量。上述试验重复3次。
2.9 统计学方法
采用SPSS 13.0软件进行统计分析。计量资料均以x±s表示,多组间比较采用单因素方差分析(One-way ANOVA),两两比较采用t检验。P<0.05表示差异有统计学意义。
3 结果
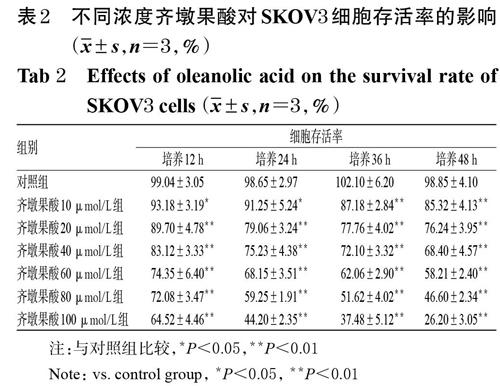
3.1 不同浓度齐墩果酸对SKOV3细胞存活率的影响
随着齐墩果酸浓度的增加和作用时间的延长,SKOV3细胞的增殖能力有随之减弱的趋势,齐墩果酸各剂量组细胞存活率均显著低于对照组(P<0.05或P<0.01),详见表2。当齐墩果酸浓度为20 μmol/L、作用24 h时,SKOV3细胞的存活率为(79.06± 3.24)%,提示该浓度齐墩果酸对SKOV3细胞具有显著的细胞毒性。因此,选择20 μmol/L作为齐墩果酸给药的低剂量,选择40 μmol/L作为齐墩果酸给药的高剂量,并选择作用24 h作为齐墩果酸的给药条件。
注:与对照组比较,*P<0.05,**P<0.01
Note: vs. control group, *P<0.05, **P<0.01
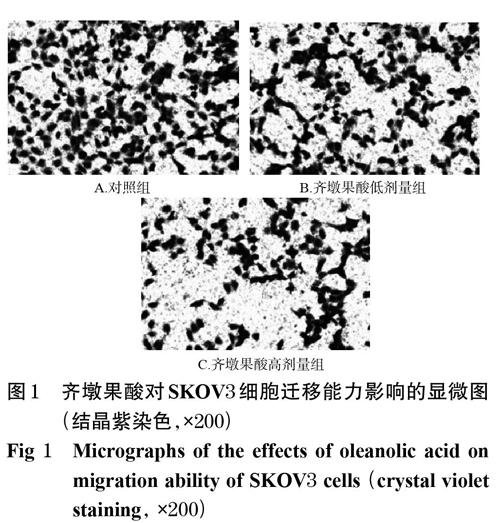
3.2 齐墩果酸对SKOV3细胞迁移和侵袭的影响
与对照组比较,齐墩果酸低、高剂量组迁移和侵袭的细胞数均显著减少(P<0.05或P<0.01),详见图1、图2、表3。
3.3 齐墩果酸对SKOV3细胞增殖、侵袭、转移相关蛋白表达的影响
与对照组比较,齐墩果酸低、高剂量组NF-κB p65、PRL-3、TNF-α、IL-6的相对表达量均显著降低,E-cadherin蛋白的相对表达量均显著升高(P<0.05或P<0.01),详见图3、表4。
3.4 齐墩果酸对LPS诱导的SKOV3细胞NF-κB/PRL-3通路相关蛋白及其mRNA表达的影响
与对照组比较,LPS模型组细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白及其mRNA的相对表达量均显著升高,E-cadherin 蛋白及其mRNA的相对表达量均显著降低(P<0.01);与LPS模型组比较,齐墩果酸低、高剂量组细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白及其mRNA相对表达量均显著降低,E-cadherin 蛋白及其mRNA相对表达量均显著升高(P<0.05或P<0.01),详见表5、图4、表6。
注:与对照组比较,*P<0.05,**P<0.01;与LPS模型组比较,#P<0.05,##P<0.01
Note: vs. control group, *P<0.05, **P<0.01;vs. LPS model group, #P<0.05, ##P<0.01
3.5 齐墩果酸对NF-κB过表达诱导的SKOV3细胞NF-κB/PRL-3通路相关蛋白表达水平的影响
与对照组比较,NF-κB p65过表达模型组细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白的相对表达量均显著升高,E-cadherin蛋白的相对表达量显著降低(P<0.05或P<0.01);与NF-κB p65过表达模型组比较,齐墩果酸低、高剂量组细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白的相对表达量均显著降低,E-cadherin 蛋白的相对表达量均显著升高(P<0.05或P<0.01),详见图5、表7。
4 讨论
卵巢癌具有早期难以诊断、恶性程度高、极易发生转移等特点,难以进行早期预防,治疗难度较大[21-22]。近年来,卵巢癌的发病率逐年升高,且呈年轻化趋势[23],故探寻有效防治卵巢癌的药物已成为目前研究的热点。研究表明,肿瘤细胞微环境与肿瘤的发生发展具有密切关联[10-11],因此改善肿瘤细胞微环境为肿瘤的防治提供了新思路。
齐墩果酸为可用于肿瘤患者的免疫调节,其广泛存在于蔬菜、水果和可食用植物中,是一种自然资源充足的天然活性成分,具有显著的抗炎、调节免疫、保肝及抗肿瘤等作用[24-25]。本研究探讨了齐墩果酸对卵巢癌SKOV3细胞增殖、侵袭、转移的影响。CCK-8结果显示,随着齐墩果酸给药浓度的增加和作用时间的延长,SKOV3细胞的增殖能力有随之减弱的趋势,齐墩果酸各剂量组细胞存活率均显著低于对照组,说明齐墩果酸对SKOV3细胞增殖具有抑制作用。Transwell实验结果显示,20、40 μmol/L齐墩果酸均能够显著减少卵巢癌SKOV3细胞迁移、侵袭细胞数目,说明其具有抑制SKOV3细胞迁移与侵袭的作用。
肿瘤细胞炎性浸润是肿瘤发生发展过程中的一个重要特征。NF-κB信号通路介导的炎症反应能够促进大量炎症因子(如TNF-α、IL-6等)释放,加速肿瘤细胞的增殖、侵袭与转移[26-27]。其中,TNF-α能够增加血管通透性,IL-6能够促进血管生成及肿瘤细胞增殖、分化,在肿瘤细胞侵袭与转移过程中发挥着重要的作用[28]。PRL-3是肿瘤细胞侵袭与转移的关键调控因子[29],研究表明,该因子能够促进触发肿瘤细胞上皮间质转化活化,抑制上皮标志物E-cadherin蛋白的表达,从而降低肿瘤细胞黏附作用并促进细胞外基质降解,最终诱导肿瘤细胞向周围组织、血管侵袭和转移[30-31]。由此可见,NF-κB/PRL-3信号通路对肿瘤细胞增殖、侵袭、转移均具有促进作用。研究显示,SKOV3细胞中NF-κB信号通路异常活化,具有促进卵巢癌细胞增殖、侵袭、转移的作用,活化的NF-κB信号通路能够促进PRL-3高表达进而促进肿瘤细胞增殖、侵袭、转移[32]。这提示靶向调节NF-κB/PRL-3信号通路可作为抑制卵巢癌细胞增殖、侵袭、转移的重要途径。
本研究结果表明,不同浓度齐墩果酸均能够显著抑制SKOV3细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白的表達,升高E-cadherin蛋白的表达。研究显示,LPS能够通过活化NF-κB信号通路介导炎症反应以促进肿瘤细胞上皮间质转化[33]。因此,本研究运用LPS诱导SKOV3细胞活化NF-κB/PRL-3信号通路,进一步研究齐墩果酸对该信号通路的调控作用。结果显示,采用LPS诱导后,SKOV3细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白及其mRNA的表达均显著升高,E-cadherin 蛋白及其mRNA的表达均显著降低;采用齐墩果酸干预能够显著降低细胞中NF-κB p65、PRL-3、TNF-α、IL-6蛋白及其mRNA的表达,升高E-cadherin 蛋白及其mRNA的表达。这提示齐墩果酸抑制SKOV3细胞侵袭、转移的作用可能与调控NF-κB/PRL-3信号通路以抑制炎症反应有关。NF-κB信号通路活化能够激活PRL-3、抑制E-cadherin,从而促进肿瘤细胞的侵袭与转移[34]。为了进一步确定齐墩果酸是否通过抑制NF-κB p65进而调节PRL-3、TNF-α、IL-6、E-cadherin的表达,本研究运用LipofectamineTM 2000转染试剂将NF-κB p65质粒转染至SKOV3细胞中,使细胞中的NF-κB p65过表达,从而激活PRL-3、TNF-α、IL-6等相关蛋白。结果显示,齐墩果酸仍然能够抑制NF-κB p65过表达诱导的炎症反应,下调SKOV3细胞中NF-κB p65、PRL-3、TNF-α、IL-6 蛋白的表达,上调E-cadherin蛋白的表达。由此推测,齐墩果酸可能主要通过抑制炎症反应及上皮细胞间质化过程而抑制SKOV3细胞增殖、侵袭、转移。
综上所述,齐墩果酸可能通过调控NF-κB/PRL-3通路相关因子的表达,抑制炎症反应和上皮间质转化而抑制SKOV3细胞增殖、侵袭、转移,对于防治卵巢癌具有一定的潜力。
参考文献
[ 1 ] BOWTELl DD, BOHM S, AHMED AA, et al. Rethinking ovarian cancer Ⅱ: reducing mortality from high-grade serous ovarian cancer[J]. Nat Rev Cancer, 2015,15(11):668-679.
[ 2 ] TORRE LA, TRABERT B, DESANTIS CE, et al. Ovarian cancer statistics:2018[J]. CA Cancer J Clin,2018,68(4):284-296.
[ 3 ] 周琳,何秀萍.卵巢癌形成、诊断及治疗的研究进展[J].中国生育健康杂志,2018,29(5):491-493.
[ 4 ] STEWART C, RALYEA C, LOCKWOOD S. Ovarian cancer: an integrated review[J]. Semin Oncol Nurs,2019,35(2):151-156.
[ 5 ] FRANIER B, THOMPSON M. Early stage detection and screening of ovarian cancer: a research opportunity and significant challenge for biosensor technology[J]. Biosens Bioelectron, 2019. DOI:10.1016/j.bios.2019.03.041.
[ 6 ] LA VECCHIA C. Ovarian cancer: epidemiology and risk factors[J]. Eur J Cancer Prev,2017,26(1):55-62.
[ 7 ] GOULOOZE SC, COHEN AF, RISSMANN R. Olaparib[J]. Br J Clin Pharmacol,2016,81(1):171-173.
[ 8 ] 程艳刚,荆然,谭金燕,等.齊墩果酸及其衍生物抗肿瘤作用机制研究进展[J].辽宁中医药大学学报,2016,18(11):210-213.
[ 9 ] SHANMUGAM MK, DAI X, KUMAR AP, et al. Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer: preclinical and clinical evidence[J]. Cancer Lett,2014,346(2):206-216.
[10] 唐亚尼,孙洋,叶茂.炎症反应促进肿瘤的侵袭和转移的研究进展[J].生命科学研究,2015,19(2):160-164.
[11] CHANG CH, QIU J, OSULLIVAN D, et al. Metabolic competition in the tumor microenvironment is a driver of cancer progression[J]. Cell,2015,162(6):1229-1241.
[12] QIN Y, ZHAO D, ZHOU HG, et al. Apigenin inhibits NF-κB and snail signaling, EMT and metastasis in human hepatocellular carcinoma[J]. Oncotarget,2016,7(27):41421-41431.
[13] TANIGUCHI K, KARIN M. NF-κB, inflammation, immunity and cancer: coming of age[J]. Nat Rev Immunol,2018,18(5):309-324.
[14] MCQUEENEY KE, SALAMOUN JM, BURNETT JC, et al. Targeting ovarian cancer and endothelium with an allosteric PTP4A3 phosphatase inhibitor[J]. Oncotarget, 2018,9(9):8223-8240.
[15] WANG Z, ZHAI Z, DU X. Celastrol inhibits migration and invasion through blocking the NF-κB pathway in ovarian cancer cells[J]. Exp Ther Med,2017,14(1):819- 824.
[16] 王晶,张涛,商云飞.齐墩果酸对宫颈癌Hela细胞凋亡的影响[J].黑龙江医药科学,2011,34(1):31-32.
[17] BAO X, GAO M, XU H, et al. A novel oleanolic acid-loaded PLGA-TPGS nanoparticle for liver cancer treatment[J]. Drug Dev Ind Pharm,2015,41(7):1193-1203.
[18] ZHAO X, LIU M, LI D. Oleanolic acid suppresses the proliferation of lung carcinoma cells by miR-122/Cyclin G1/MEF2D axis[J]. Mol Cell Biochem, 2015,400(1/2):1-7.
[19] 耿传营, 徐波, 李红艳,等. 3种中药单体对卵巢癌端粒酶活性与放射敏感性的影响[J].中华中医药杂志,2009,24(10):1372-1375.
[20] 于洋,刘师兵,李松岩,等.脂多糖通过调节iNOS表达影响人卵巢癌SKOV3/DDP细胞顺铂耐药性的研究[J]. 毒理学杂志,2017,31(5):350-354.
[21] 李晶,吴妙芳,林仲秋. 《FIGO 2018妇癌报告》:卵巢癌、输卵管癌、腹膜癌诊治指南解读[J].中国实用妇科与产科杂志,2019,35(3):304-314.
[22] BURSTEIN HJ, KRILOV L, ARAGON-CHING JB, et al. Clinical cancer advances 2017: annual report on progress against cancer from the American Society of Clinical Oncology[J]. J Clin Oncol,2017,35(12):1341-1367.
[23] WEBB PM, GREEN AC, JORDAN SJ. Trends in hormone use and ovarian cancer incidence in US white and Australian women: implications for the future[J]. Cancer Causes Control,2017,28(5):365-370.
[24] 廖忻,陈文莹,杨杰也琦,等.齐墩果酸的来源及护肾作用研究进展[J].安徽农学通报,2018,24(6):156-160.
[25] 王京,郑诚月,王杨,等.齐墩果酸衍生物的合成、抗癌活性及构效关系研究进展[J].国外医药(抗生素分册), 2017,38(3):118-124.
[26] 胡芳.核因子-κB与卵巢癌[J].国外医学(妇产科學分册),2001,28(4):228-231.
[27] 方艳惠,赵喜娃,安丽沙. IL-6对卵巢癌细胞迁移和侵袭影响及机制探讨[J].中华肿瘤防治杂志,2018,25(16):1156-1162.
[28] 林镇海,闫士灿,张洁筠,等. MST4通过激活MAPK- ERK信号通路调节炎症因子释放促进肝癌的侵袭和转移的机制研究[J].中国癌症杂志,2017,27(9):681-686.
[29] 宋秀军,刘建红,吕进,等. PRL-3在肿瘤中作用机制的研究进展[J].临床肿瘤学杂志,2017,22(6):566-569.
[30] XIONG J, LI Z, ZHANG Y, et al. PRL-3 promotes the peritoneal metastasis of gastric cancer through the PI3K/Akt signaling pathway by regulating PTEN[J]. Oncol Rep,2016,36(4):1819-1828.
[31] XU H, ZENG Y, LIU L, et al. PRL-3 improves colorectal cancer cell proliferation and invasion through IL-8 mediated glycolysis metabolism[J]. Int J Oncol,2017,51(4):1271-1279.
[32] GARI HH, DEGALA GD, RAY R, et al. PRL-3 engages the focal adhesion pathway in triple-negative breast cancer cells to alter actin structure and substrate adhesion properties critical for cell migration and invasion[J]. Cancer Lett,2016,380(2):505-512.
[33] HUANG T, CHEN Z, FANG L. Curcumin inhibits LPS- induced EMT through downregulation of NF-κB-Snail signaling in breast cancer cells[J]. Oncol Rep, 2013,29(1):117-124.
[34] LI H, LI Y, LIU D, et al. LPS promotes epithelial-mesenchymal transition and activation of TLR4/JNK signaling[J]. Tumour Biol,2014,35(10):10429-10435.
(收稿日期:2019-09-14 修回日期:2020-03-26)
(编辑:段思怡)
