巴西橡胶树HbAIH 基因的克隆及表达分析
2020-06-09杨洪岳镒繁胡燕玲邓治代龙军李德军
杨洪 岳镒繁,2 胡燕玲,2 邓治 代龙军 李德军
(1. 中国热带农业科学院橡胶研究所 农业农村部橡胶树生物学与遗传资源利用重点实验室 省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室,海口 571101;2. 南京农业大学农学院,南京 210095)
多胺(Polyamines,PAs)是一类广泛存在于生物体内的具有较强生物活性的小分子脂肪族含氮碱,常见的多胺种类有腐胺(Putrescine,Put)、亚精 胺(Spermidine,Spd)、 精 胺(Spermine,Spm)和尸胺(Cadaverine,Cad)等。此外,高亚精胺(Homospermidine,Hspd)、高精胺(Homospermine,Hspm)、降亚精胺(Norspermidine,Nspd)和降精胺(Norspermine,Nspm)等稀有多胺也陆续被发现。已有许多研究表明,多胺在植物正常生长、发育、逆境应答等众多生理过程中发挥重要作用[1-6]。在生理pH 环境下,多胺极易与核酸和酸性蛋白质相结合,参与转录、翻译和物质的跨膜转运过程的调控[4,7-10]。多胺的积累往往与植物抵抗逆境的能力成正相关。逆境胁迫下,植物多胺的含量和多胺合成酶的活性显著上升,抗逆性增强。因此,在农业生产中常通过外源施加多胺来提高植物对干旱、高盐、低温等逆境的抵抗能力[11-13]。此外,多胺在植物体内还起着类似于cAMP“第二信使”的作用,通过与NO、γ-氨基丁酸、脯氨酸和植物激素等物质相互作用来促进植物生长、发育,增强逆境适应 能力[14-16]。
在生物体内,多胺的合成起始于腐胺的生物合成,因此腐胺的合成对生物体内源多胺的合成至关重要。根据合成起始物的不同,腐胺的生物合成途径分为鸟氨酸途径和精氨酸途径[17]。鸟氨酸途径是一个单反应过程,前体鸟氨酸在鸟氨酸脱羧酶(Ornithine decarboxylase,ODC)的作用下脱羧直接生成腐胺;精氨酸途径则以精氨酸为前体在精氨酸脱羧酶(Arginine decarboxylase,ADC)的作用下脱羧生成鲱精胺(Agmatine,AGM),AGM 相继经鲱精胺亚胺水解酶(Agmatine iminohydrolase,AIH)和N-氨甲酰腐胺-酰胺水解酶(N-carbamoylputrescine amidohydrolase,CPA)作用最终生成Put。已发现有些植物(如拟南芥、小立碗藓)由于ODC 基因的缺失使得精氨酸途径成为其腐胺合成的唯一途径[18]。作为精氨酸途径中3 个酶之一,AIH 基因或蛋白已在玉米、小麦、大豆和拟南芥等植物中克隆或纯化,关于该酶结构特征的研究也部分报道[19-22]。
巴西橡胶树(Hevea brasiliensis)属于大戟科乔木,是目前唯一大面积商业化种植用于生产天然橡胶的产胶植物。在生产中,通过割胶切断树皮中次生乳管从而使胶乳流出获得天然橡胶的原始材料。巴西橡胶树胶乳中主要含有Put、Spd 和Spm 三种多胺,且以Put 为主;割面上的Put 和PAs 总含量高于非割面,割面上离割口越近Put 含量越高,其生物合成越活跃,而非割面上的Put 及其它多胺垂直变化不大[23]。这些结果说明Put 可能是橡胶树胶乳中的重要多胺,对调节橡胶树橡胶生物合成和胶乳再生具有重要作用。巴西橡胶树中多个多胺合成途径基因已相继报道,但对AIH 基因了解甚少[24-25]。本研究克隆了巴西橡胶树AIH 基因并对其进行生物信息学及表达特性分析,旨在为进一步丰富和完善多胺在巴西橡胶树中的生物学功能奠定基础。
1 材料与方法
1.1 材料
本文试验材料为巴西橡胶树品系热研-73397,叶、茎尖、雄花、雌花、健康及死皮橡胶树胶乳和树皮等组织样品均采自中国热带农业科学院试验农场开割橡胶树,叶片不同发育阶段样品采自国家橡胶树种质资源圃。每样品取3 个生物学重复,每重复选3株橡胶树。样品采集后用液氮速冻,-80℃保存。
低温、干旱、高盐等非生物胁迫处理材料为移栽培养6 个月的热研-73397 组培苗。低温处理在4℃人工气候箱中进行;干旱和高盐胁迫处理参照刘辉等[26]方法,分别用30% PEG 6000 和1 mol/L NaCl 溶液模拟干旱和高盐环境。各处理于设定时间点采集第2 和3 片叶,以未处理正常植株作对照。以上各处理每时间点均设3 次生物学重复,每重复5 株组培苗。样品采集后液氮速冻,-80℃保存,用于RNA 提取。
过氧化氢(H2O2)、乙烯利和茉莉酸甲酯(MeJA)等处理材料为达到开割标准的未开割橡胶树品系热研-73397。H2O2处理分别参照Tang 等[27]和Zhu 等[28]方法,乙烯利和MeJA 处理参照Hao 等[29]方法,以不作任何处理的未开割树为对照。每处理每时间点均设3 个生物学重复,每重复5 棵树。各处理于设定时间点采集胶乳,液氮冻存,用于RNA 提取。
1.2 方法
1.2.1 RNA 提取及cDNA 合成 使用植物通用总RNA 提取试剂盒(北京百泰克生物技术有限公司)说明书提取橡胶树RNA,采用DNase I(Fermentas)去除RNA 中的DNA。利用PrimeScript® RT reagent Kit with gDNA Eraser 试剂盒(TaKaRa)反转录合成第一链cDNA。
1.2.2HbAIH的 克 隆 3′-RACE(rapid amplification of cDNA ends)采用SMARTerTMRACE cDNA Amplification Kit(Clontech,USA)试剂盒进行。3′-RACE所用引物为5′- CACCAAACACAAGACTTGCTG-3′和5′-CCAAATCATGAGGTGGTGAG-3′。按照试剂盒说明用3′-RACE CDS Primer A 对1 μg 各组织混合RNA进行反转录,以获得的cDNA 为模板用PrimeSTAR Max Premix(TaKaRa,Dalian,China)进行3′端序列的扩增。将获得的3′端序列与转录组中获得的unigene 序列进行拼接,并设计全长cDNA 扩增引物,进行PCR 扩增验证。
1.2.3HbAIH生物信息学分析 利用ORF finder 预测开放阅读框;用在线程序Smart(http://smart.emblheidelb erg.de/) 和InterProScan(http://www.ebi.ac.uk/interpro/)对蛋白保守结构域进行分析;用Expasy 网 站 的ProtParam 程 序(http://web.expasy.or g/protparam/)分析蛋白质分子量、等电点、氨基酸组成等理化性质;用NCBI 中的BLAST和DNASTAR 软件进行同源性分析;信号肽预测用SignalP 4.1 Server 软 件(http://www.cbs.dtu.dk/services/SignalP/),采用程序TMHMM 2.0(http://www.cbs.dtu.dk- /services/ TMHMM/)预测跨膜结构域。用ClustalX 和MEGA6.0 进行多序列比对和Neighbor-Joining 进化树的构建,多序列比对显色用ESPript 工具完成[30]。
1.2.4 实时荧光定量PCR 分析 根据测序结果设计HbAIH基因实时荧光定量PCR 引物,正、反向引物序列分别为5′-CCAAATCATGAGGTGGTGAG-3′和5′-GCTCTAGACCAAGCTACTAG-3′。 选 择 巴 西橡胶树HbUBC4作为内参基因,正、反向引物序列 分 别 为5′- TCACCCTGAACCTGATAGCC-3′ 和5′- TTTCTTTGGTGACGCTGCAA-3′。 根 据SYBR Green I Master Mix 试剂盒说明书qPCR 反应体系如下:SYBR® Premix Ex TaqTM(2×)(TaKaRa)10 μL,正、反向引物各1 μL,模板 2 μL,补ddH2O 至20 μL。每样品设置3 次重复。qPCR 在Bio-Rad CFX96 qPCR 仪进行,程序设置为:95℃预变性5 min;95℃ 10 s,58℃ 30 s,72℃ 20 s,40 个循环后进行熔解曲线分析,以确定引物的特异性。基因相对表达量采用公式2-ΔΔCt计算。
2 结果
2.1 HbAIH的克隆及序列特征
通过对巴西橡胶树转录组测序结果分析,获得了一条与植物AIH 基因序列高度同源的unigenes。利用RT-PCR 和3′-RACE 技术获得了该序列完整开放阅读框(ORF,open reading frame)和全部3′端序列(图1)。序列分析结果表明,扩增获得的基因全长1 462 bp,ORF 长为1 137 bp,编码378 个氨基酸。同源序列比对结果表明,该蛋白与木薯、蓖麻、麻风树、毛果杨等AIH 蛋白序列一致性较高,故将该基因命名为HbAIH。
预测HbAIH 分子量为42.28 kD,理论等电点为5.09。不稳定系数为39.09,为稳定蛋白。信号肽预测结果表明,HbAIH 不含有信号肽,为胞内蛋白。疏水性分析表明,该蛋白亲水性氨基酸为152 个,占40.21%;疏水性氨基酸为167 个,占44.18%,平均疏水系数为-0.411,为亲水性蛋白。氨基酸组成中带有负电荷的氨基酸(Asp+Glu)共有51 个,占13.49%;带有正电荷的氨基酸(Arg+Lys)共有35 个,占9.26%。跨膜结构域预测结果表明,HbAIH 不含跨膜结构域,为非膜蛋白。
2.2 HbAIH基因结构分析
将HbAIHcDNA 序列在橡胶树热研-73397 基因组数据中进行比对,获得HbAIH基因组序列,序列全长8 446 bp。编码区含有10 个外显子和9 个内含子(图2),外显子长度介于56-233 bp,内含子长度介于95-1 799 bp 之间。所有内含子的剪切位点均符合真核生物“GT-AG”规则。利用GSDS 2.0 在线工具分析了橡胶树、木薯、麻风树、蓖麻、可可、拟南芥和玉米等的AIH 基因结构,结果表明这些植物AIH具有相同的外显子/内含子组织形式,都由10 个外显子和9 个内含子组成(图2)。
2.3 HbAIH同源比对及二级结构特征

图1 HbAIH cDNA 序列及其推导的氨基酸序列
将HbAIH 与其它物种AIH 基因的氨基酸序列进行同源序列比对,结果(图3)表明HbAIH 与木薯MeAIH 氨基酸序列一致性最高,达90.74%。其次是大戟科的蓖麻RcAIH 和麻风树JcAIH,一致性分别是87.57%和85.57%。与原核生物粪链球菌EfAIH 和变形链球菌SmAIH 氨基酸序列一致性最低,分别为43.57%和45.34%。利用在线程序SOPMA 对HbAIH 进行二级结构预测。结果表明HbAIH 二级结构以无规则卷曲为主要构成元件,占42.86%;其次是α-螺旋和被β 片层结构,占比例分别为26.19%和22.75%;β-转角结构最少,仅占8%。
2.4 HbAIH系统进化分析
在橡胶树与与其他物种AIH 氨基酸同源比对分析的基础上,利用NJ 法进行了分子进化树聚类分析。如图4 所示,巴西橡胶树HbAIH 与木薯MeAIH、麻风树JcAIH 位于同一进化分枝,亲缘关系最近,而其它植物AIHs 亲缘关系较远;细菌AIHs 单独聚类为一大枝。
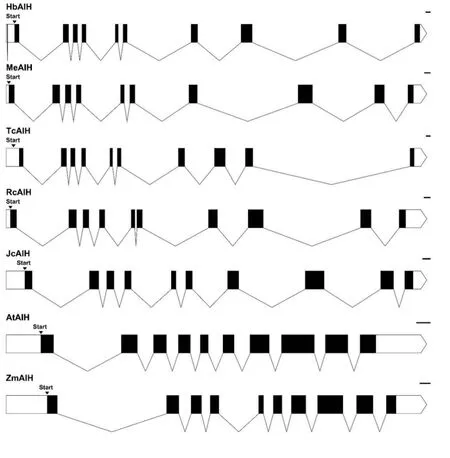
图2 HbAIH 及其他植物AIH 基因结构示意图
2.5 HbAIH组织表达特性及对橡胶树死皮的响应
组织表达谱分析结果表明,HbAIH在巴西橡胶树茎尖、胶乳、叶、树皮、雌花、雄花等各组织中均有表达,其中,在雌花中表达量最高,雄花中表达量最低(图5-A)。比较健康和死皮橡胶树中表达差异发现,HbAIH基因在胶乳中的表达量高于树皮,且在死皮橡胶树胶乳和树皮中的表达量均高于健康树(图5-B)。在叶片不同发育阶段,HbAIH基因的表达也存在差异,其中,在淡绿期表达量最高,接下来依次是变色期、衰老期、古铜期,稳定期表达量最低(图5-C)。
2.6 HbAIH响应逆境胁迫及激素处理的表达模式
胶乳中HbAIH表达受H2O2、乙烯利和MeJA 调控。H2O2处理抑制HbAIH表达,处理6 hHbAIH表达水平显著低于处理前,24 h 达到最低,48 h 略有升高但仍低于处理前水平(图6-A)。乙烯利处理前8 h,HbAIH表达水平持续下降,处理24、48 和72 h该基因表达水平基本一致但仍低于处理前(图6-B)。MeJA 处理下,胶乳中HbAIH的表达呈下降-上升-下降波浪式变化,处理4 h 该基因表达量最低,24 h该基因的相对表达量达到最高(为处理前1.5 倍),此后该基因的表达量开始下降,至48 h 恢复到处理前水平(图6-C)。

图3 HbAIH 与其它AIH 多序列比对及二级结构预测

图4 HbAIH 与其它物种AIHs 蛋白序列聚类分析
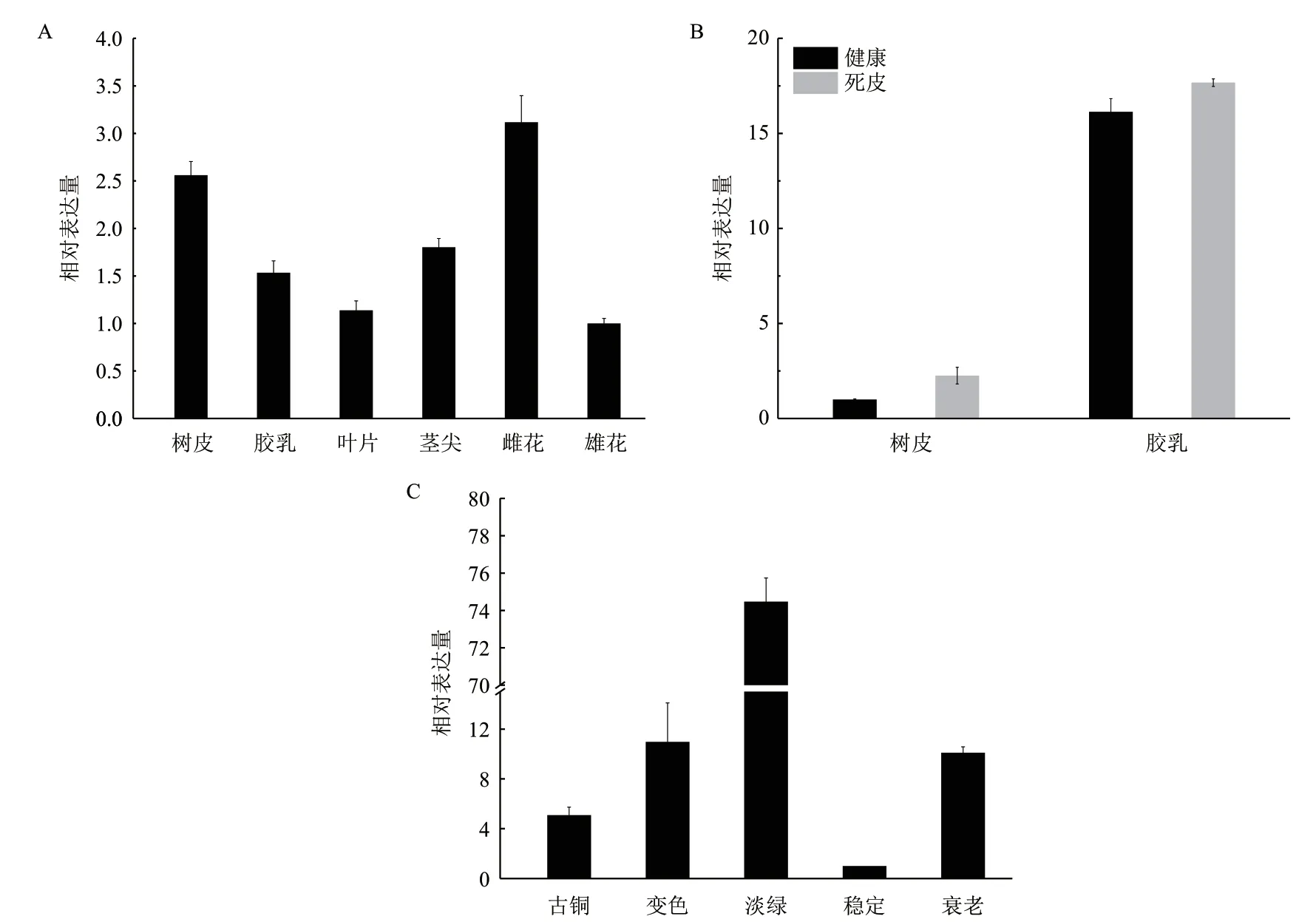
图5 HbAIH 在巴西橡胶树不同组织(A)、健康及死皮橡胶树胶乳和树皮(B)及叶片不同发育时期(C)表达模式
叶片中HbAIH的表达也受低温、干旱和高盐的影响。低温胁迫下,HbAIH的表达呈现出波浪形变化,处理3 h 该基因相对表达量降低,然后开始升高,处理24 h 该基因相对表达量达到最高值,为处理前的1.4 倍,然后又开始下降,处理48 h 基本恢复处理前水平(图6-D)。PEG 模拟干旱胁迫3 h,叶片中HbAIH表达量高于处理前,为处理前的1.3 倍;此后,该基因表达开始下降,处理48 h 恢复处理前水平(图6-E)。高盐胁迫3 h,叶片中HbAIH表达基本没有变化;随后,HbAIH的表达快速升高,胁迫48 h 时该基因的表达量达到最高,为处理前的3倍(图6-F)。
3 讨论
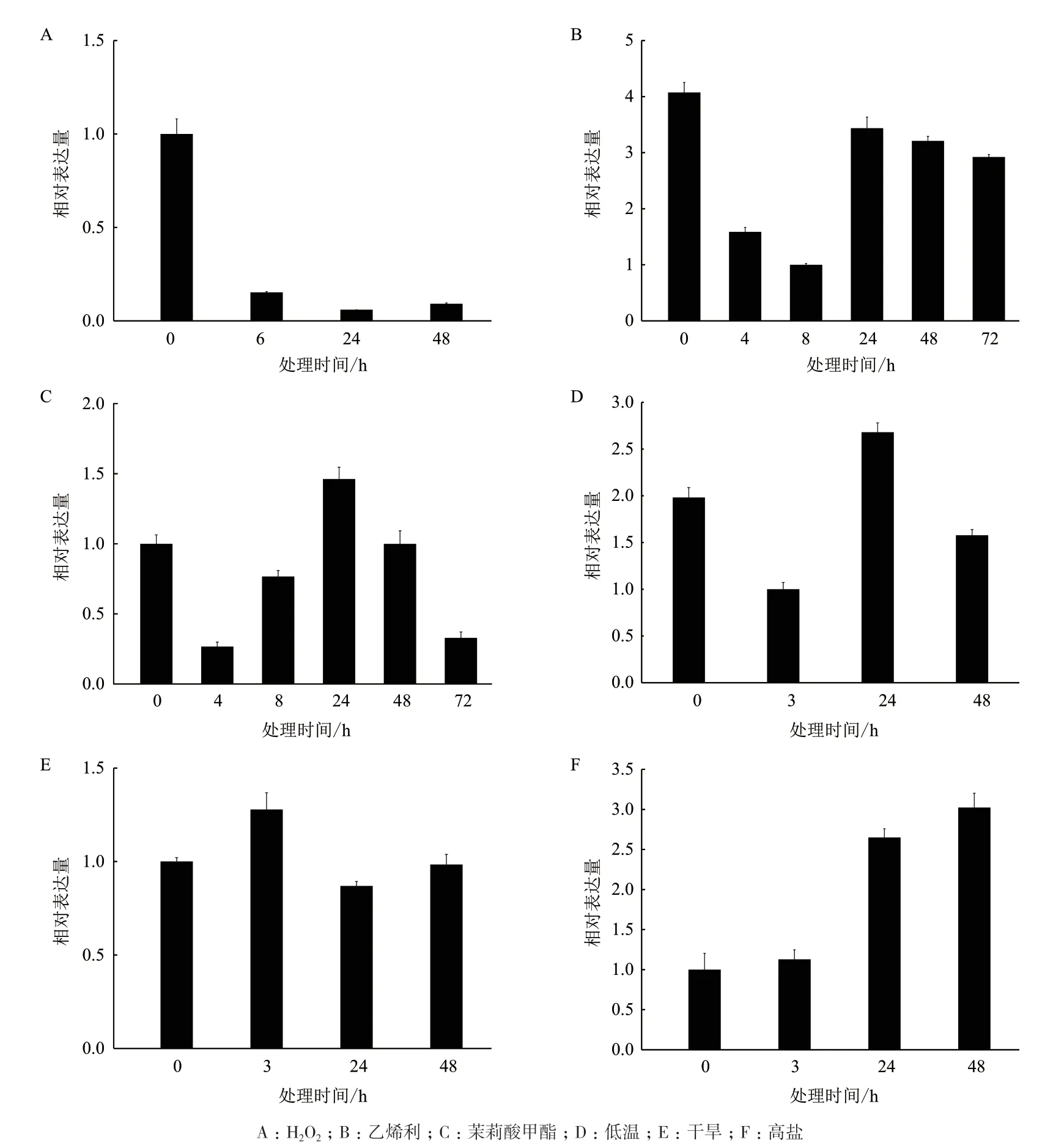
图6 不同处理条件下HbAIH 的表达模式
真核生物中仅植物能够通过精氨酸途径合成腐胺,AIH 是该途径中的第二个酶。根据结构分类,AIH 属于戊烷超家族中的卟啉单胞菌型肽基精氨酸脱氨酶家族成员,具有该家族特有的以5 个αββαβ重复单元组成的螺旋桨式结构特征[31-32]。研究表明,AIH 是一个同源二聚体蛋白,且参与2 个亚基间氢键形成的氨基酸高度保守[20,22,33]。本研究克隆获得了巴西橡胶树AIH 基因HbAIH,该基因序列全长1 462 bp,ORF 序列长1 137 bp,编码378 个氨基酸。生物信息学分析表明,HbAIH 为亲水性蛋白,不含跨膜结构域和信号肽。蛋白序列比对分析结果表明,酶活性位点形成和参与底物结合的11 个氨基酸在HbAIH 及其他植物AIH 氨基酸高度保守。氨基酸相似性分析及系统进化分析结果表明HbAIH 与大戟科木薯MeAIH 和麻风树JcAIH 等的相似性最高,预示着它们亲缘关系较近,这与植物学传统分类一致。
组织表达谱表明HbAIH表达无组织特异性,在本研究所检测的橡胶树6 个组织中均有表达但表达量具有差异。HbAIH在雌花中表达量最高而在雄花中表达量最低,推测HbAIH可能与橡胶树雌花发育有关。此外,不同发育阶段叶片中HbAIH的表达也存在一定差异。死皮和健康橡胶树胶乳和树皮表达结果表明,HbAIH在死皮橡胶树胶乳和树皮中表达均有上调。橡胶树死皮是割面部分或全部不排胶的现象,这暗示HbAIH可能参与橡胶树死皮发生和胶乳再生的分子调控过程。乙烯利(Ethephon,ET)在天然橡胶生产中常用于刺激胶乳合成和排胶,具有明显的增产效果[34];茉莉酸是乳管分化和发育的重要调节因子,可以诱导橡胶树乳管分化,调节橡胶生物合成[29,35-36]。本研究发现,乙烯利和茉莉酸甲酯处理后HbAIH表达存在波动,但整体呈下调趋势,暗示其可能负向调控橡胶树ET 反应和产排胶过程。
我国属于非传统植胶区,橡胶树生长周期内经常遭受季节性干旱、低温、台风等逆境的影响,这些逆境因子严重制约着巴西橡胶树的胶乳产量和质量。本研究发现低温、干旱、高盐等逆境胁迫下,HbAIH的表达有不同程度上调,表明该基因可能参与了巴西橡胶树逆境响应过程。过氧化氢诱导的氧化胁迫下,HbAIH的表达明显下调,表明该基因可能负向调控巴西橡胶树氧化胁迫应答。
4 结论
从巴西橡胶树中克隆获得HbAIH,其开放阅读框1 137bp,编码378 个氨基酸,预测其是一个亲水性蛋白。HbAIH表达无组织特异性,在检测的组织中均有表达。HbAIH可能参与巴西橡胶树叶片生长发育、逆境应答等过程,并可能参与橡胶树死皮发生和胶乳再生的调控。
