壳聚糖/木质素磺酸钠豚草提取物微胶囊的制备
2020-06-09苏景波
包 颖,苏景波
(1.吉林省林业技术推广站,吉林 长春 130022;2.洮南市国有林总场,吉林 白城 137100)
微胶囊化 (Microencapsulation) 是将固体、液体或气体物质包覆起来,以天然或高分子材料作为囊壁,将作为囊芯的活性物质包裹起来,形成具有半透性或密封性囊膜粒子的过程。微胶囊化后可避免囊芯物质因外界环境的影响而失去活性。微胶囊的常用制备方法有物理法(喷雾干燥法、包合法、超临界流体法、喷雾冷却法、空气悬浮法和挤压法等),化学法(界面聚合法、原位聚合法),物理化学法(相分离法、干燥浴法)[1]。
豚草(Ambrosiaartemisiifolia)是一种分布广泛的一年生杂草, Chen, K. W, Demers, I,Gentili, R.等调查研究表明,豚草起源于北美,至今,豚草在全球许多国家和地区都有发现。现阶段许多研究发现豚草花粉是世界许多地区致敏花粉的重要来源之一,在夏末和秋末能够引起过敏反应,在美国和欧洲一些国家已经很普遍。气候变化、城市化以及长途运输增加了豚草种子传播的可能性,因此,豚草在非入侵地区变得越来越普遍,进而增加了致敏率[2-4]。到目前为止,已经发现11种豚草过敏原,目前很多豚草的相关研究都是如何对其进行防治,有学者对2013—2015年在罗马尼亚西北和罗马尼亚中部豚草花粉引起的过敏性鼻炎患者进行记录,结果表明,豚草花粉的强烈致敏性与眼睛和哮喘相关症状有关联。Bousquet, J.等在豚草花粉传播季节,对美国和欧盟国家与豚草花粉过敏相关的谷歌术语进行了分析,结果发现,在调查的11个国家中,有8个在春季和夏季出现了“豚草” “花粉”“花粉症”和“过敏”等相关询问[5,6]。Case, M. J.等报道了气候变化对豚草分布的影响,显示佛罗里达州中部,阿巴拉契亚山脉南部和弗吉尼亚东北部的豚草有减少趋势,并且在其当前分布的北部边缘,特别是在美国东北部,潜在扩张的区域显著增加,到2070年可能有所缓和,这意味着豚草可能对气候变化敏感。由于豚草对健康的影响,文中建议当地的杂草控制委员会扩展监测范围,并增加根除工作[7]。近几年,有研究表明豚草提取物具有低毒性,可作为植物源农药用于生物防治[8-15]。
壳聚糖是唯一具有氨基的天然多糖,由甲壳素的脱乙酰化获得,甲壳素广泛存在于自然界,是β(1,4)-2-组成的线性天然聚合物氨基-2-脱氧-D-葡聚糖和β(1,4)-2-乙酰氨基-2-de-氧-D-葡聚糖。Aman, R. M.等将壳聚糖、瓜尔胶和阿拉伯胶等混合生物聚合物的水凝胶基质制成纳米乳液,基于纳米乳剂的纳米纤维可以作为局部给药系统,有效地治疗炎性疾病,取代具有不良作用的非甾体类药剂,可将其引入植物药领域[16]。Esmaeili, H.等发现用壳聚糖和乳清蛋白薄膜纳米囊封后的大蒜精油,可延长冷藏真空包装的保质期[17]。Andonegi, M.等研究表明,壳聚糖/胶原蛋白薄膜的开发和表征证实,这些薄膜在生物医学应用中具有适用性[18]。Asadzadeh, H.等使用分子动力学模拟确定典型的抗菌肽与壳聚糖和聚乙二醇聚合物的相互作用,进而确定合适的载体改善肽药物递送系统[19]。Ashassi-Sorkhabi, H.等对用于钢合金的壳聚糖基抑制剂体系进行论述,研究表明壳聚糖在各种腐蚀性介质中具有有效保护金属的作用,具有消除腐蚀性的功能[20]。Augustine, R.等发现壳聚糖生物聚合物可用于制备亚微米纤维膜,具有细胞外基质的模拟性能、渗出液吸收性能、生物相容性、抗菌活性和生物可降解性,基于负载生物活性剂的壳聚糖的电纺膜可在伤口愈合应用中发挥重要作用[21]。Zhang, Z. L等通过喷雾干燥法制备了基于壳聚糖的释放微球,将壳聚糖用作载体材料,三七、党参和白术提取物为活性物质,通过单因素试验和正交设计优化了微球的喷雾干燥制备工艺。喷雾干燥法制备的壳聚糖基药物微球的制备过程简单、稳定,制备的微球在体外显示出缓释作用[22]。
木质素磺酸钠是一种大分子表面活性剂,Vainio, U. Qiu, X.等研究表明,木质素磺酸钠可广泛用于各种工业领域中的界面添加剂[23,24]。Lou, H.等使用木质素磺酸盐作为稳定剂合成硒纳米颗粒[25]。Wang, X.等使用具有生物相容性的壳聚糖和木质素磺酸钠作为外壳材料,通过层层自组装方法配制除草剂微胶囊,结果表明,基于聚电解质生物聚合物的多层微胶囊可以实现控制释放和光稳定特性[26]。
由于植物源农药易受外界环境影响而失活,因此,在使用时应对其进行保护处理,壳聚糖和木质素磺酸钠两种材料性质稳定,可用于渗透性材料使用,本文尝试采用物理化学法—相分离法—水相分离法—复合凝聚法,以豚草作为囊芯材料,壳聚糖和木质素磺酸钠作为囊壁材料制备壳聚糖/木质素磺酸钠豚草提取物微胶囊剂,并对其进行检验。
1试验材料和仪器
豚草采自黑龙江省牡丹江市,壳聚糖,木质素磺酸钠,吐温80,乙醇,戊二醛,冰乙酸,丙酮,氢氧化钠,去离子水,以上药品和材料均来自国药集团化学试剂有限公司或实验室自制。
电子天平,超声波仪,循环水式多用真空泵,旋转蒸发仪,磁力搅拌器,离心机,扫描电子显微镜,傅立叶变换红外光谱系统,紫外分光光度仪,电热恒温鼓风干燥箱。
2 试验方法
2.1 豚草提取物的制备
采摘豚草植株洗净晾干,粉碎。取豚草干粉与乙醇溶液混合,超声波仪处理后抽滤,弃去粉末,将上层溶液蒸发,回收有机溶剂,保存余下油状物质,避光低温保存。
2.2 壳聚糖/木质素磺酸钠-豚草提取物微胶囊的制备
将豚草提取物与乙醇溶液混合,低速搅拌,制成豚草提取物悬浮液。
壳聚糖-豚草提取物溶液的配制:将壳聚糖溶于醋酸溶液,搅拌。将豚草提取物悬浮液与壳聚糖溶液混合,慢慢滴入乳化剂。
微胶囊悬浮液的配制:将木质素磺酸钠溶液搅拌后倒入壳聚糖-豚草提取物悬浮液中,边倒边搅拌,调节体系pH,加去离子水,继续反应一段时间后加入固化剂,调节体系pH,固化后,离心处理,取上清液,加丙酮溶液离心处理并抽滤,得到微胶囊粉末,室温下保存。
2.3 检测方法
2.3.1 微胶囊外部形态特征
将制备好的微胶囊粉末进行喷金处理,利用电镜扫描观察外部形态特征。
2.3.2 微胶囊的红外光谱分析
利用傅立叶变换红外光谱系统对壳聚糖、木质素磺酸钠、豚草提取物及壳聚糖/木质素磺酸钠-豚草提取物微胶囊进行红外表征分析。红外光谱表征是检验微胶囊是否成功包覆的重要试验过程,首先要掌握每种物质红外光谱吸收峰所代表的化学键和变化趋势,根据不同成分所含化学物质和基团分析光谱变化规律,进而确定囊芯材料和囊壁材料是否结合,可以判断囊芯材料是否成功包埋,红外光谱表征分析的关键是查阅资料找出成分里所含起主要作用的物质和其对应的峰值,囊芯材料和囊壁材料必须分别与制备好的壳聚糖/木质素磺酸钠豚草提取物微胶囊光谱进行对比,分析重要吸收峰的变化,从而确定试验反应情况。
微胶囊的红外光谱分析是微胶囊性能测定的基础,只有验证囊芯材料已成功包覆于囊壁材料后,再进行粒径分析、热重分析、缓释试验、室内毒力测定和田间生物防治试验才具有现实意义,红外光谱分析是进一步研究的核心环节和前提条件。
2.3.3 豚草提取物微胶囊化的效率和有效载量
取实验室已制好的一定量的豚草提取物质,分别配制成0.5 %、1.0 %、1.5 %、2.0 %和2.5 %五个质量分数的溶液,选择乙醇溶液作为空白对照,使用紫外分光光度计,在660 nm波长条件下测其各自的吸光度,绘制吸光值曲线,并得出方程。将制备完成的壳聚糖/木质素磺酸钠豚草提取物微胶囊悬浮液进行离心处理后,取其上清液1 mL,稀释,取含有游离未被包覆的豚草提取物的上清液适量于比色皿中,用紫外分光光度计进行测定,重复3次。
微胶囊的效率(A.E.)和有效载量(L.C.)计算公式如下:
A.E.( %) =(1-W2/W1) ×100 %
L.C.( %)=〔(W1-W2)/W3〕×100 %
式中:W1为芯材总质量;W2为微胶囊表面未被包覆的芯材总质量;W3为微胶囊粉末的质量。
3 结果与分析
3.1 形态特征
利用电子扫描显微镜观察外部形态特征,如图1所示。
从图1中可以看出,壳聚糖/木质素磺酸钠豚草提取物微胶囊分布有序,大小均匀,形态规则,大部分成圆形,极少部分成椭圆形,整体杂质较少,基本包覆完全。

图1微胶囊外部形态
Fig.1 The external shape of the microcapsule
3.2 红外光谱表征
壳聚糖的红外光谱图如图2所示。

图2壳聚糖的红外光谱
Fig.2 Infrared spectrum of chitosan
从图2中可以看出,3 359 cm-1处是缔合-NH2和-OH伸缩振动吸收峰,而-OH和-NH2伸展一般在3 200~3 700 cm-1出现,由于含有的氢键在壳聚糖分子里起作用,形成氢键的-OH伸展峰,从而键强减弱,因此,羟基的伸缩振动峰向低频3 200~3 550 cm-1处移动,在3 285 cm-1处出现,峰形肥宽[27]。2 923 cm-1处和1 649 cm-1处分别对应的是-CH的伸缩振动吸收峰和酞胺基伸缩振动吸收峰,1 588 cm-1和1 421 cm-1是-NH2的弯曲振动吸收峰和-CH2的弯曲振动吸收峰,1 370 cm-1和1 149 cm-1对应-CH-NH2的伸缩振动吸收峰和醚键的伸缩振动吸收峰,1 066 cm-1和1 043 cm-1分别对应的是-CO弯曲振动吸收峰[28-31]。
豚草提取物的红外光谱图如图3所示。
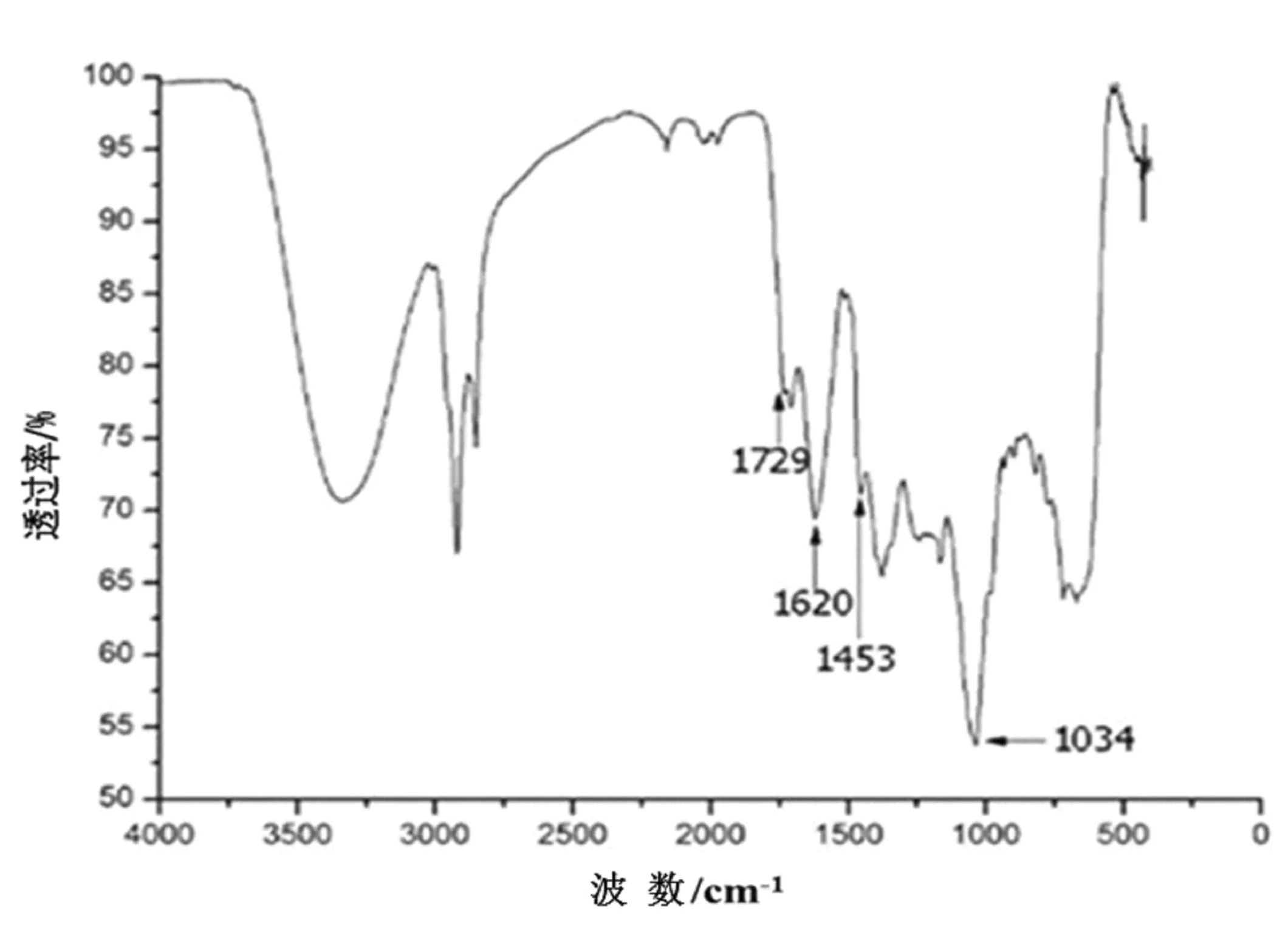
图3豚草提取物的红外光谱
Fig.3 Infrared spectrum of ragweed extract
从图3中可以看出,在1 729 cm-1处的吸收峰为不饱和五元内酯环,1 620 cm-1处的吸收峰为共轭双键。在1 453 cm-1附近处有一芳环的伸展峰,在900~1 200 cm-1之间1 034 cm-1处有一酚类化合物的γ(C-O) 峰。这一系列主要吸收峰为豚草内倍半萜内酯的主要基团[27]。
壳聚糖、木质素磺酸钠和壳聚糖/木质素磺酸钠豚草提取物微胶囊的红外光谱表征分析如图4所示。
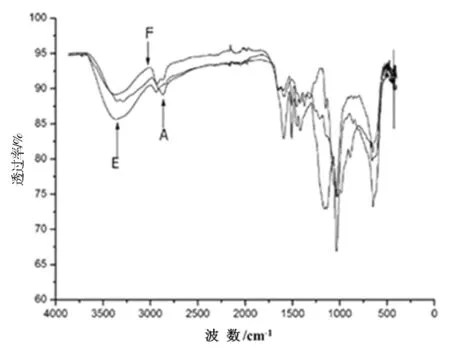
注:A 为壳聚糖;E为木质素磺酸钠;F为壳聚糖/木质素磺酸钠豚草提取物微胶囊。
图4壳聚糖、木质素磺酸钠和壳聚糖/木质素磺酸钠豚草提取物微胶囊的红外光谱
Fig.4 Infrared spectra of chitosan, sodium lignosulfonate and chitosan/sodium lignosulfonate ragweed extract microcapsules
从图4中可以看出,壳聚糖的红外光谱图中1 588 cm-1处对应-NH2的弯曲振动吸收峰,1 370 cm-1处对应-CH-NH2伸缩振动吸收峰,两者都在壳聚糖/木质素磺酸钠豚草提取物微胶囊的红外光谱图中减弱。这是由于囊皮材料间彼此的键合作用,壳聚糖分子与木质素磺酸钠在溶液里进行复凝聚反应,形成囊壁凝聚物。
豚草提取物和壳聚糖/木质素磺酸钠豚草提取物微胶囊的红外光谱如图5所示。
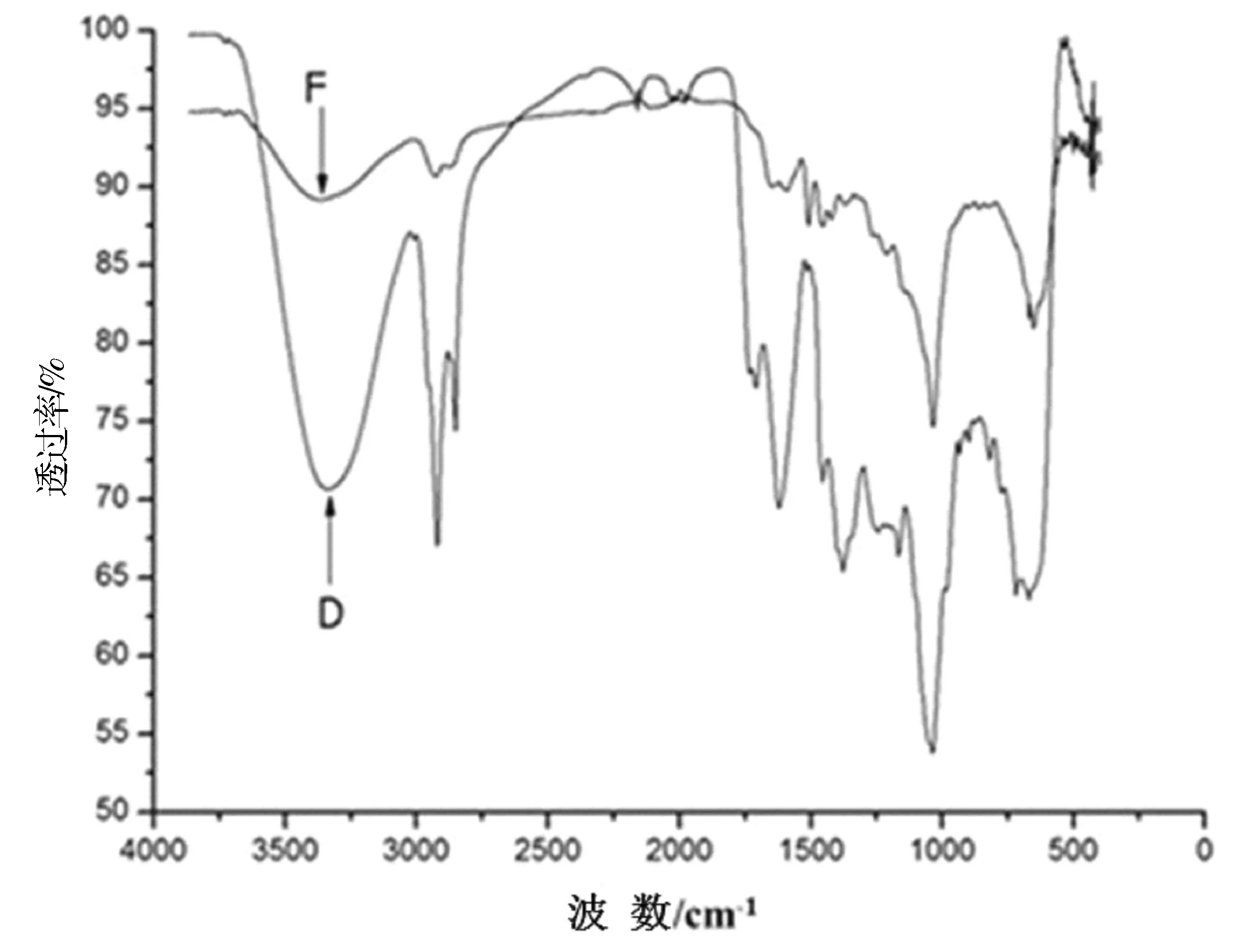
注:D为豚草提取物;F为壳聚糖/木质素磺酸钠豚草提取物微胶囊。
图5豚草提取物和壳聚糖/木质素磺酸钠豚草提取物微胶囊的红外光谱
Fig.5 Infrared spectrum of ragweed extract and chitosan/sodium lignosulfonate ragweed extract microcapsules
从图5中可以看出,在1 729 cm-1处的吸收峰为不饱和五元内酯环,1 620 cm-1处的吸收峰为共轭双键。光谱D豚草提取物在1 729 cm-1处峰强,光谱F壳聚糖/木质素磺酸钠豚草提取物微胶囊在1 729 cm-1处吸收峰变弱至消失,说明药品被包覆在微胶囊中。同样,药品被包覆于微胶囊后光谱F中1 620 cm-1处吸收峰与光谱D相比,在很大程度上变弱,光谱D中在1 453 cm-1附近处有一芳环的伸展峰,在900~1 200 cm-1之间1 034 cm-1处有一酚类化合物的γ(C-O) 峰。光谱F中1 453 cm-1附近处和900~1 200 cm-1之间1 034 cm-1处也有几乎相同的芳环伸展峰和酚基γ(C-O) 峰。这些主要吸收峰显示的基团为豚草内倍半萜内酯的主要基团。因此,说明豚草提取物质被成功包覆于囊壁材料壳聚糖/木质素磺酸钠[27]。
从上述分析可知,在各物质的红外光谱中均可以很清晰地看出主要化学物质的吸收峰,当囊皮材料壳聚糖和木质素磺酸钠产生凝聚反应后,壳聚糖的红外光谱图中1 588cm-1处和1 370 cm-1处分别对应的是-NH2的弯曲振动吸收峰和-CH-NH2的伸缩振动吸收峰明显减弱,说明壳聚糖和木质素磺酸钠反应完全,正负电荷相互吸引,产生复凝聚反应,形成微胶囊囊皮结构。光谱图中能够显示豚草倍半萜内酯的主要基团的吸收峰在壳聚糖/木质素磺酸钠豚草提取物微胶囊光谱图中明显减弱,说明豚草提取物质被成功包埋,因此,红外光谱图可以同时成功验证囊皮材料反应程度和微胶囊包覆情况。
3.3 效率和有效载量
根据豚草提取物微胶囊化的效率和有效载量计算方法,制备的壳聚糖/木质素磺酸钠豚草提取物微胶囊的效率和有效载量均达到80 %以上。
4结论
试验制备的壳聚糖/木质素磺酸钠豚草提取物微胶囊分布有序,大小均匀,形态规则,大部分成圆形,极少部分成椭圆形,整体杂质较少,基本包覆完全。红外光谱显示豚草提取物质被成功包覆于囊壁材料壳聚糖/木质素磺酸钠。效率和有效载量均达到80 %以上。
