多学科协作指导下的新辅助短程放疗联合化疗对中低位进展期直肠癌的疗效和安全性分析—单中心研究
2020-06-09薛军武雪亮屈明郭圣超郭飞韩磊孙光源刘进宇牛亚进袁泽龙范爽
薛军 武雪亮 屈明 郭圣超 郭飞 韩磊 孙光源 刘进宇 牛亚进 袁泽龙 范爽
河北北方学院附属第一医院普通外科(河北张家口075000)
结直肠癌的新辅助治疗是指在手术切除前附加辅助治疗,包括放疗、化疗及放化疗3 种模式。新辅助放疗又包括短程放疗(SCRT)和长程放疗(LCRT)两种模式,前者多应用于北欧,后者则广泛应用于美洲、亚洲以及南欧国家[1-2]。目前,中国临床肿瘤学会(CSCO)推荐首选LCRT 同步化疗作为局部晚期直肠癌的新辅助治疗方案。其优点在于降期效果显著,缺点是治疗周期长、花费高,术前等待及住院时间长,患者依从性差。SCRT 因其治疗周期短、患者依从性好的优势,成为直肠癌新辅助治疗的一个新研究方向[3]。此外,美国国立综合癌症网络(NCCN)提出SCRT 有其特殊的适应证:应用于T3 或N+期的直肠癌,同时SCRT需要经过多学科团队(MDT)讨论[4]。优质的MDT 诊治模式能够使肿瘤的临床评估、治疗及术后紧密衔接,由于MDT 集中了各专业组的学科精英,其临床诊疗水平相对较高,联合诊疗能够有效避免单独科室医师由于认识不足对肿瘤诊疗的局限性,最大限度地避免误诊、治疗不规范等不良事件的发生,为肿瘤患者提供最佳的个体化诊疗方案。
基于此,笔者组建专业MDT 团队,纳入普通外科、病理科、肿瘤内科、放疗科、内镜中心等相关科室的专业精英,共同制定治疗方案,将术前SCRT联合化疗应用于中低位进展期直肠癌中,分析该治疗模式的依从性、临床疗效和安全性,从而为局部进展期直肠癌的新辅助治疗提供新的个体化治疗方案。
1 资料与方法
1.1 一般资料选取2015年6月至2016年1月间河北北方学院附属第一医院普通外科收治的中低位进展期直肠癌患者,纳入标准:年龄≤80 岁;入组前均行肠镜病理检查以明确诊断,且距肛缘齿状线10.0 cm 以内;依照美国癌症联合委员会(AJCC)直肠癌第七版TNM 分期系统[5]确诊为进展期直肠癌;ECOG 评分≤2 分,该研究项目经本院伦理委员会批准,患者知情同意。
1.2 MDT 模式邀请包括病理科、肿瘤内科、放疗科、消化内科、内镜科、护理等相关科室高年资、专业的医师协同推动,成立结直肠肿瘤MDT 团队,建立MDT 微信群,及时完成会诊工作。团队职能涉及术前诊断、肿瘤分期、治疗和手术方案制定,护理、随访等各个环节。MDT 模式以患者为中心,结合肿瘤分型、影像学分期及患者的实际情况,制定个体化治疗方案。本研究选取MDT 指导下确定行术前SCRT+Xelox 方案者40 例纳入本研究中,其中,男26 例,女14 例,中位年龄52 岁,低分化10 例,中分化25 例,高分化5 例,Ⅱ期16 例,Ⅲ期24 例,病变距肛缘0 ~5 cm 18 例,5 ~10 cm 22 例。
1.3 新辅助治疗方法所有入组患者先接受盆腔适形调强技术的术前SCRT,总放射剂量25.0 Gy,剂量分割5 Gy×5 次,之后2 周内行化疗治疗,Xelox方案(奥沙利铂130 mg/m2,1 d;卡培他滨2 000 mg/m2,1 ~14 d,3 周为1 周期,共4 周期),4 周期后行影像学检查,评估降期效果。新辅助治疗完成后6 ~8 周,满足手术条件后,均接受遵循TME 原则的根治性手术治疗,手术由同一团队完成。
1.4 疗效评价
1.4.1 影像学评估基于新辅助治疗前后磁共振成像(MRI)层面肿瘤体积的变化,采用实体瘤疗效评价标准来进行疗效评价,CR+PR 视为客观有效。
1.4.2 肿瘤消退学分级评价根据AJCC 第七版推荐的TRG 评估方法[6]对术后标本进行评估。0 级:肿瘤无消退,无变化;1 级:轻度消退,肿瘤组织中伴明显纤维化但<25%;2 级:中度消退,纤维化占26%~50%;3 级:消退良好,纤维化>50%;4 级:完全消退,无癌细胞残留即PCR。
1.4.3 分子生物学指标评价应用免疫组化方法对治疗前后病变组织中的RUNX3、Ki-67 进行阳性率检测。判断标准:(1)按染色强度:无着色为0分,淡黄为1分,深黄为2分,棕黄为3分;(2)阳性细胞计数:<10%为0 分,10% ~25%为1 分,26%~50%为2 分,51% ~75%为3 分,≥76%为4 分。两者相加<2 分为阴性(-),2 ~3 分为弱阳性(+),4 ~5 分为中等强度阳性(++),6 ~7 分为强阳性(+++),由两名具备高级职称的病理医师经双盲法独立评分。
1.5 观察指标
1.5.1 手术相关指标手术时间、术中出血量、淋巴结清扫数目、保肛率及术后并发症。
1.5.2 不良反应参考WHO 分级标准,评估骨髓抑制、消化道反应,乏力、皮肤黏膜反应,神经毒性,肝肾功能异常等不良反应程度。
1.5.2 术后近期生存指标所有术后病例均出院跟踪随访,行电子肠镜等检查,评估患者有无局部复发、远端转移以及预后情况。
1.6 统计学方法采用SPSS 16.0 统计学软件进行分析,计量资料以均数±标准差表示,采用t检验;计数资料以例数(%)表示,采用卡方检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 患者新辅助治疗完成情况40 例进展期中低位直肠癌患者均顺利完成了SCRT,中位时间为7 d(5 ~10 d),后行中子俘获治疗(NCT),3 例患者出现化疗中断,其中2 例为重度骨髓抑制,1 例为严重腹泻;2 例患者出现化疗剂量降低,其中1 例因放射性肠炎,1 例为骨髓抑制;4 例患者出现新辅助化疗延迟,其中2 例为放射性肠炎,1 例为骨髓抑制,1 例为神经毒性;整个治疗足量完成率达87.50%(35/40)。
2.2 影像学评估35 例患者完成足量的新辅助治疗后复查MRI,重新评估,结果显示CR 4 例(11.43%),PR 21 例(60.00%),SD 7 例(20.00%),PD 3 例(8.57 %),总有效率为71.43 %。见图1A、B 和图2A、B。
2.3 内镜及病理学缓解情况35 例患者接受了治疗后的内镜评估,其中3 例患者达到了内镜下的完全缓解,但均选择了手术治疗,术后病理确诊完全缓解;余32 例患者亦进行了手术治疗。术后病理TRG 分级:0 级0 例,1 级8 例,2 级10 例,3 级14 例,4 级3 例。见图1C、D 和图2C、D。
2.4 RUNX3、Ki-67 检测免疫组化定量检测结果显示:治疗前病灶样本中RUNX3 表达水平为(1.165 ± 0.350),治疗后为(2.091 ± 0.652);治疗前病灶样本中Ki-67 表达水平(2.109 ± 0.488),治疗后为(1.223 ± 0.316),差异均有统计学意义(t=8.920,t=7.884,P<0.001)。见图3。
2.5 手术及术后并发症情况35 例入组患者均行TME 手术治疗,全部达到R0 切除,13 例接受Miles 术,20 例接受Dixon 术,2 例接受Hartmann 术,腔镜手术率为82.86%(29/35),保肛率为57.14%(20/35),平均手术时间(203 ± 31)min,术中出血量(213 ± 62)mL,术中淋巴结清扫(19.6 ± 3.9)个,吻合口瘘2 例(5.71%),肠梗阻2 例(5.71%),肺部感染1 例(2.86%),切口感染1 例(2.86%)。其中肠梗阻经禁食水、肠外营养等保守治疗,于1 周后逐步恢复;吻合瘘均为低位,发生于术后7、10 d,经禁食水,肠外营养,骶前引流管持续冲洗,于2 周后逐步闭合;均顺利出院,所有入组患者无1 例死亡。
2.6 不良反应不良反应主要为骨髓抑制(三系减少),Ⅰ级29 例,Ⅱ级20 例,Ⅲ级以上5 例;消化道反应(恶心、呕吐、腹泻等),Ⅰ级21 例,Ⅱ级10例,Ⅲ级以上3 例;乏力,Ⅰ级10 例,Ⅱ级4 例;皮肤黏膜反应,Ⅰ级4 例,Ⅱ级1 例;神经毒性,Ⅰ级5例,Ⅱ级1 例;肝肾功能异常,Ⅰ级8 例,Ⅱ级3 例;放射性肠炎,Ⅰ级5 例,Ⅱ级2 例,Ⅲ级以上1 例。所有不良反应大多均为Ⅰ和Ⅱ级,经过治疗或休息后明显缓解。
2.7 生存期随访随访5 ~48 个月,中位随访时间28 个月,共获得完整随访29 例,随访率为82.86%(29/35),死亡8 例,总生存率为72.41%(21/29),复发3 例,远处转移4 例。
3 讨论
随着各学科、各专业在肿瘤治疗领域的优势凸显,肿瘤的诊疗已不再是单一科室的专项管理,而是强调多学科协作。MDT 是在肿瘤诊疗管理过程中,结合患者的生理、病理、心理等影响因素,由外科、内科、麻醉科、影像科、内镜科、护理、营养科等科室组建的MDT 共同探讨制定诊疗方案,该模式可以吸收各个不同专业的观点,综合评估病情,从而达到精准化和个体化。

图1 同一患者治疗前后影像学、病理学图片(PCR)Fig.1 Imaging and pathological images of the same patient before and after chemoradiotherapy(PCR)

图2 同一患者治疗前后影像学、病理学图片(TRG 1 级)Fig.2 Imaging and pathological images of the same patient before and after chemoradiotherapy(TRG 1 Grade)
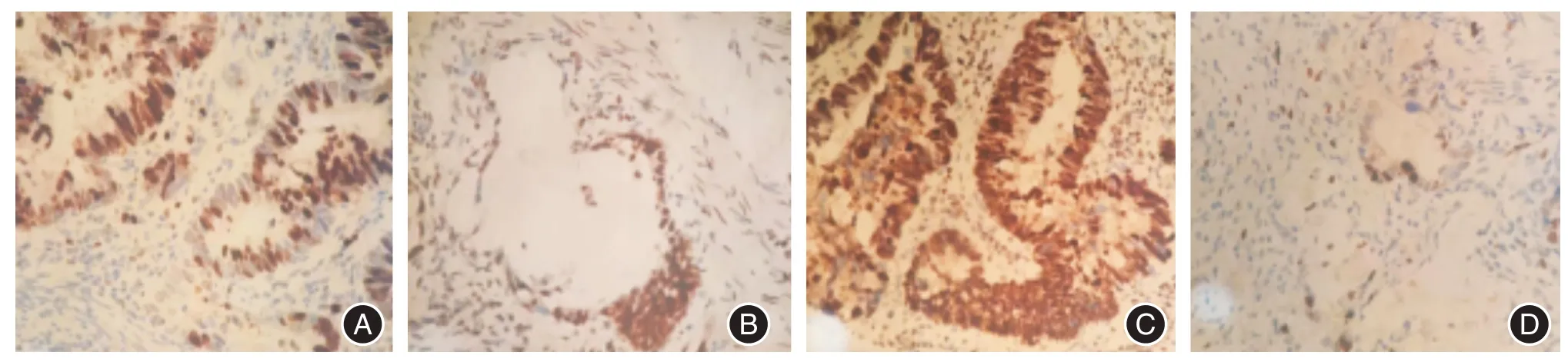
图3 新辅助放化疗前后RUNX3、Ki-67 的表达变化(×400)Fig.3 Expression of RUNX3 and Ki-67 before and after neoadjuvant chemoradiotherapy
近年来,SCRT 逐步走入广大临床医师的视野,SCRT 单次照射剂量大、时限短,尤其对肿瘤外层富氧增殖细胞具有较好的杀灭效果,且能达到常规放疗相同的等效剂量,可避免放射相关并发症如放射性肠炎、组织纤维化等因素对手术的影响,操作简单、易行,明显缩短治疗和间歇时间,提高了患者的依从性,同时也减轻了经济负担[7]。
本研究团队在MDT 指导下共纳入40 例中低位进展期直肠癌患者,给予SCRT,均顺利完成,在化疗期间因放射性肠炎、骨髓抑制等不良反应,3 例患者出现中断、2 例降低剂量、4 例延迟,整个治疗足量完成率达87.50%。在所有不良反应中,绝大多数以Ⅰ级和Ⅱ级为主,Ⅲ级以上极少,且通过积极的对症处理,均能顺利完成治疗。因而,该治疗模式总体上是安全的,患者易于接受。
本研究将完成足量新辅助治疗的35 例患者,均予复查MRI,评估降期效果,结果显示总有效率为71.43%,从以往的检出文献看,该数据基本与国内外研究[8-9]报道吻合;同时应用TRG 评估,中度(含中度)以上消退者占77.14%(27/35),明显消退者(TRG 3 ~4 级)48.57%(17/35),R0 切除率为100%,总体达到了降期的目的,因而证实该方案应用于局部进展期直肠肿瘤在影像学和病理学方面均具有良好的疗效。
RUNX3 是近年来研究较热的抑癌基因,能调控细胞的生长、发育和凋亡,对细胞的信号转导有着重要的调节作用,前述研究已证实RUNX3 的低表达与直肠癌的发生、发展以及与肿瘤微血管的形成密切相关[10]。Ki-67 为目前较为肯定的核增殖性标志基因,用于评估肿瘤的增殖和侵袭能力。本研究应用免疫组化定量检测证实,治疗前病灶中RUNX3 表达水平明显低于术后,而治疗前Ki-67 表达水平则明显高于术后,表明SCRT 联合NCT 能明显抑制肿瘤细胞的增殖和侵袭能力。
从术后的并发症来看,本中心的数据为17.14%(6/35),尽管各中心数据不一,但总体来看,SCRT联合NCT 方案在术后并发症方面仍是一个可选择的方案。当然该结论仍缺乏多中心研究结果支持,同时,也和术者的技巧、手术经验、患者的体质以及术后患者的护理、康复相关。从随访数据来看,本研究完整随访29 例,总生存率为72.41%,复发3 例(10.34%),远处转移4 例(13.79%),相对于其他类似研究报道,该治疗模式在预后方面有一定的优势。
综上所述,本研究团队证实对于中低位进展期直肠癌,在MDT 指导下给予SCRT+NCT 的治疗模式是安全有效的。当然,本研究亦存在一定的局限,本研究未做相应的病例对照研究,仅仅是新辅助化疗前后影像学、病理学和分子生物学指标的对照,虽然与国内外同类研究结果基本吻合,相对于LCRT 有较好的依从性,但毕竟说服力有限;再者,本研究纳入病例相对较少,因而仍需要进一步的大样本数据支持,这均是本团队今后的重要研究方向。
