丁香酚对紫红笛鲷幼鱼的麻醉效果
2020-06-09黄小林杨洁戴超李涛杨育凯黄忠虞为林黑着孙莘溢舒琥
黄小林,杨洁,,戴超,,李涛,杨育凯,黄忠,虞为,林黑着*,孙莘溢,舒琥
(1.中国水产科学研究院南海水产研究所深圳试验基地,广东 深圳518121;2.中国水产科学研究院南海水产研究所,农业农村部南海渔业资源开发利用重点实验室/国家渔业资源环境大鹏观测实验站/广东省渔业生态环境重点实验室,广州510300; 3.广州大学生命科学学院,广州 510006)
紫红笛鲷 (Lutjanusargentimaculatus) 隶属鲈形目、笛鲷科、笛鲷属(Lutjanus),俗称红友、红油等,分布于印度洋、太平洋中部和西部[1],为珊瑚礁、岩礁鱼类,肉质细嫩,广盐性,抗病力强,是中国华南沿海水产养殖的常见鱼种[2]。
丁香酚是丁香油的主要成分,化学名为2-甲氧基-4-烯丙基苯酚,分子式为C10H12O2,常温下为淡黄色黏稠油状液体,挥发性强,有强烈的丁香气味,易溶于有机溶剂而难溶于水,在口腔科治理、麻醉和消炎镇痛等方面应用广泛[3-4]。此外,丁香酚也广泛应用于水产动物麻醉[5-6]、畜牧业抑菌抗虫[7-8]和食品与饲料防腐添加剂[9]等领域。
水产养殖生产过程中,为减少鱼类应激反应,需在亲鱼精卵采集、活鱼抽血、鲜活运输、试验取样和标记放流等人为操作时进行麻醉,以保护鱼类[10-11]。丁香酚类产品凭借其高性价比、代谢物在鱼体内能快速排出等特点,是目前水产养殖产业中使用较多的鱼类麻醉剂之一[12]。丁香酚被美国FDA(Food and Drug Administration)认定为对人体无害物质,可用作食品添加剂[13]。在日本、澳大利亚、芬兰和智利等国家,丁香酚作为水产麻醉剂得到广泛应用,麻醉后的水产品须休药暂养后方可上市[12-14]。丁香酚对鱼类麻醉效果的研究已有较多报道,比如锦鲤(Cyprinuscarpio)[15]、斑点叉尾鮰(IetalurusPunetaus)[16]、鲫(Carassiusauratus)[17]、大西洋鲑(Salmosalar)[18]、斑马鱼(Daniorerio)[19]、俄罗斯鲟(Acipensergueldenstaedti)[20]、翘嘴鲌(Culteralburnus)[21]、Flowerhorn(Amphilophuslabiatus×Amphilophustrimaculatus)[22]及神仙鱼(Pterophyllumscalare)[23]和黄斑篮子鱼(Siganusoramin)[6]等,目前,国内外尚未见丁香酚对紫红笛鲷麻醉研究的相关报道。本实验研究了不同浓度丁香酚对紫红笛鲷幼鱼的麻醉效果,以期为紫红笛鲷养殖生产、试验操作、运输和增殖放流等提供参考依据。
1 材料与方法
1.1 材料
紫红笛鲷幼鱼来源于深圳市龙岐庄实业发展有限公司土池培育的苗种,人工随机选出活力好、体表无伤的个体进行实验,幼鱼体质量 (1.041±0.477) g,全长 (4.02±0.54) cm。实验开始前禁食1 d,实验在室内透明玻璃缸中进行,玻璃缸大小为20 cm×20 cm×50 cm。丁香酚购自常熟尚齿齿科材料有限公司,净含量96 %,密度范围为1.0361~1.050 g/mL。实验用水为沙滤自然海水,盐度31‰,水温 (29.5±0.9) ℃,溶解氧高于6 mg/L,pH为7.9。
1.2 方法
1.2.1 麻醉剂的配制
麻醉液现配现用,丁香酚与无水乙醇按体积比为1∶9混合作为母液,按实验所需浓度将母液稀释即可。
1.2.2 麻醉和复苏过程行为特征观察
实验鱼在20 mg/L丁香酚溶液中,10 min内未能进入4期麻醉,而在麻醉剂浓度大于50 mg/L时,实验鱼绝大部分在1 min 30 s内进入4期麻醉状态,丁香酚浓度过高时,各麻醉分期界限不明显,而浓度过低则无法进入深度麻醉。因此,为观察到稳定且分期明显的麻醉特征,需要适当的麻醉剂浓度。根据预实验结果,紫红笛鲷幼鱼在丁香酚浓度为30 mg/L时麻醉过程的行为特征比较明显,适于观察。
随机选取6尾紫红笛鲷幼鱼置于30 mg/L的丁香酚溶液中,一半用于入麻观察直到实验鱼完全进入6期麻醉,一半在鱼进入4期麻醉后,迅速捞出放入自然海水内复苏,重复3次,麻醉和复苏全过程用高清摄像机拍摄,之后结合现场观察和录像对各麻醉分期的行为特征进行描述。麻醉和复苏的分期标准参考彭宁东等[5]和刘长琳等[10]等的研究,并结合紫红笛鲷幼鱼自身行为特征。
1.2.3 最终麻醉程度
根据预实验结果,设计10、15、20、30、40、50、60、70、80和90 mg/L等10个质量浓度梯度。每个梯度实验用鱼20尾,测定10、20和30 min后各浓度下实验鱼能达到的最终麻醉程度。
1.2.4 不同质量浓度的丁香酚的麻醉效果
根据实验1.2.3的结果,分别在30、40、50、60、70、80和90 mg/L等7个丁香酚质量浓度下测定紫红笛鲷幼鱼的入麻时间和复苏时间,各浓度下实验用鱼3尾,重复3次。入麻时间为从放入丁香酚溶液开始至进入4期麻醉所需的时间,复苏时间为从4期麻醉捞出放入自然海水中开始至完全复苏所需时间。
1.2.5 空气暴露时间对复苏的影响
将紫红笛鲷幼鱼放入30 mg/L的丁香酚溶液中,进入4期麻醉后捞出置于海水浸湿毛巾上,并用另一块湿毛巾覆在鱼体上,漏出头部,在空气中分别暴露2、4、6、8、10、12、14和16 min后,各取3尾放入自然海水中复苏,记录复苏时间,重复3次。
1.2.6 麻醉对呼吸频率的影响
根据预实验结果,在30、40、50、60、70、80和90 mg/L等7个质量浓度的丁香酚溶液中,分别测定20 s、40 s、1 min、1 min 30 s、2 min、3 min和5 min时紫红笛鲷幼鱼的呼吸频率。各浓度实验鱼3尾,重复3次,鳃盖一张一合记为1次呼吸,通过录像统计连续10 s的呼吸次数,再换算为每分钟的呼吸次数,即为呼吸频率。
1.2.7 低麻醉状态下紫红笛鲷幼鱼耗氧率
采用静水法测定耗氧率。实验在室内自制透明玻璃鱼缸中进行,玻璃缸高30 cm、长15 cm、宽15 cm,用虹吸管从提前储备的500 L养殖桶中将沙滤自然海水吸到玻璃缸中并溢出,养殖桶中海水溶解氧大于6 mg/L,用校准后的德国WTW多参数分析仪溶氧探头插入玻璃缸,缸口用封口膜密封,待玻璃缸中水的溶解氧降为4 mg/L时,结束实验并记录时间。每个浓度用鱼6尾,重复3次。耗氧率的计算公式见式(1)。
RO=(CDO0-CDO1)×Q/T×W
式(1)
式中RO为耗氧率[mg/(g·h)];CDO0为试验前养殖桶中海水溶氧量(mg/L);CDO1为流出呼吸室的海水溶氧量(mg/L);Q为试验玻璃缸体积(L);T为玻璃缸中溶氧降到4 mg/L所需时间(min);W实验鱼体重(g)。
1.2.8 数据处理
实验所得数据用SPSS 20.0(IBM公司,美国)和Microsoft Excel 2016软件(微软公司,美国)进行统计分析。
2 结果与分析
2.1 麻醉和复苏的行为特征
紫红笛鲷幼鱼在30 mg/L丁香酚溶液中入麻和复苏各分期的时间及行为特征如表1。
2.2 紫红笛鲷幼鱼在丁香酚溶液中的最终麻醉程度
丁香酚浓度小于100 mg/L时,紫红笛鲷幼鱼在10、20及30 min内达到的最终麻醉程度如图1、图2及图3所示。
在10 mg/L丁香酚溶液中,浸泡10 min和 20 min时,紫红笛鲷幼鱼的最终麻醉程度为2期(100%),30 min时90%紫红笛鲷幼鱼进入4期麻醉,10%进入5期麻醉;在15 mg/L丁香酚溶液中,浸泡10 min有30%进入2期麻醉,70%进入3期麻醉,20 min时全部进入3期麻醉,30 min时40%进入5期麻醉,60%进入6期麻醉;在20 mg/L丁香酚溶液中,浸泡10 min全部进入3期,20 min时20%进入3期,80%进入4期,30 min时全部进入6期麻醉;在30 mg/L丁香酚溶液中,浸泡10 min有90%进入4期,10%进入5期,20 min时50%进入5期,50%进入6期,30 min时全部进入6期麻醉;在40 mg/L丁香酚溶液中,浸泡10 min有30%进入4期,70%进入5期,20 min已全部进入6期麻醉;在50 mg/L丁香酚溶液中,浸泡10 min有50%进入5期,50%进入6期,20 min已全部进入6期麻醉;在60 mg/L丁香酚溶液中,浸泡10 min有30%进入5期,70%进入6期,20 min已全部进入6期麻醉;在70、80及90 mg/L丁香酚溶液中,浸泡10 min已全部进入6期麻醉。
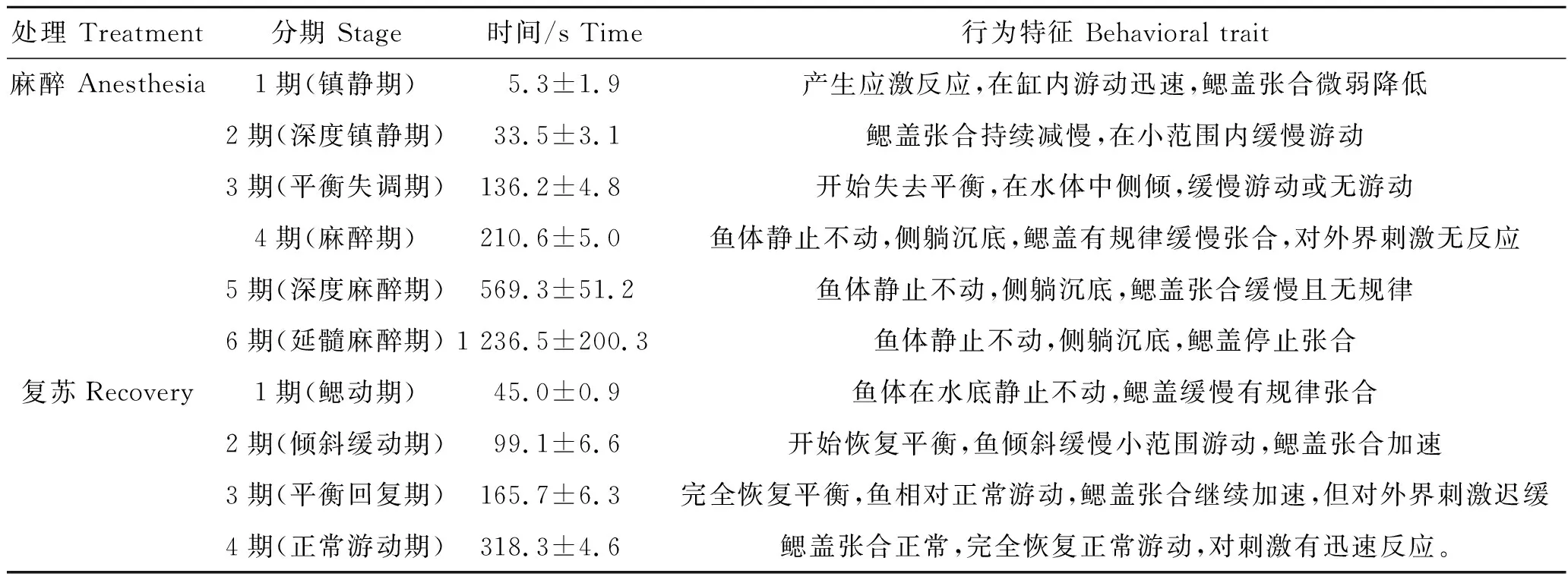
表1 紫红笛鲷幼鱼在30 mg·L-1丁香酚溶液中入麻和复苏分期的时间及行为特征Tab.1 The time and behavioral traits of juvenile L. argentimaculatus at anesthesia and recovery stages in 30 mg·L-1 eugenol
2.3 丁香酚浓度对紫红笛鲷幼鱼入麻时间、复苏时间和呼吸频率的影响
在水温(29.5±0.9) ℃时,紫红笛鲷幼鱼在不同丁香酚浓度的溶液中入麻时间、复苏时间及麻醉时的呼吸频率如图4所示。在10、15和20 mg/L的丁香酚溶液中时,紫红笛鲷幼鱼无法在10 min内进入4期麻醉,图中未列出。当丁香酚质量浓度为30~90 mg/L时,随丁香酚质量浓度的上升,紫红笛鲷幼鱼入麻时间逐渐下降(P<0.05)。丁香酚质量浓度为30~90 mg/L时,进入4期麻醉的紫红笛鲷幼鱼呼吸频率随丁香酚质量浓度上升而降低(P<0.05)。丁香酚浓度为30~70 mg/L时,进入4期麻醉的紫红笛鲷幼鱼的复苏时间随浓度升高之间的变化差异不显著(P>0.05);丁香酚浓度为80~90 mg/L时,复苏时间随浓度升高而显著降低(P<0.05)。
2.4 空气中暴露时间对紫红笛鲷幼鱼复苏的影响
在30 mg/L的丁香酚溶液中,紫红笛鲷幼鱼在(210.6±5.0) s后均能进入4期麻醉。麻醉后空气中暴露时间对紫红笛鲷幼鱼复苏的影响结果如图5所示,暴露时间在6 min以内时,复苏时间随暴露时间的增加而逐渐减少;而暴露时间大于6 min后,复苏时间随暴露时间的增加而显著增加;暴露6 min时的复苏时间最短。当暴露时间在8 min以内时,复苏率为100%。超过8 min后,复苏率逐渐下降,直到16 min时全部死亡。其中,在空气中暴露10、12和14 min的复苏率分别为77.8%、44.4%及11.1%。
图中圆点的大小代表在该丁香酚浓度下指定时间内进入不同麻醉期的
鱼的比例, 未标注数值的单个圆点意为100%进入该麻醉期,下同。
(=)
The size of the dots in the Fig.1 represents the proportion of juvenile
. entering different anesthesia stage within 10 mins
under the concentration of eugenol. A single dot without actual
percentage means 100% entering the anesthesia stage.The same below.
(=)
(=)
同一指标下,标有相同字母者表示组间无显著性差异
(>0.05),标有不同字母者表示组间有显著性差异
(<0.05)。下同。
,
For the same index, the different letters indicated significant differences
at the 0.05 probability level between groups,and the same letters
indicated non-significant differences between groups.The same below.
2.5 丁香酚麻醉对紫红笛鲷幼鱼呼吸频率的影响
紫红笛鲷幼鱼在不同浓度丁香酚溶液中的呼吸频率变化如图6所示。在10、15 mg/L等低浓度丁香酚溶液中,紫红笛鲷幼鱼的呼吸频率在20 s内,与对照组(0 mg/L)相比略微下降,之后逐步降低,其中在10 mg/L浓度中,呼吸频率在2 min时逐渐趋于稳定,基本稳定在130次/min,在15、20 mg/L浓度中,5 min内持续下降直到70次/min左右。随着麻醉时间的延长,呼吸频率呈明显下降趋势,丁香酚的质量浓度越高降低越快:在30~90 mg/L丁香酚溶液中,20 s内已比对照组(0 mg/L)有明显下降;紫红笛鲷幼鱼的呼吸频率在60~90 mg/L等高浓度丁香酚溶液中时,均在2 min内降低至25次/min以内,超过5 min后均停止呼吸。
2.6 低麻状态下对紫红笛鲷幼鱼耗氧率的影响
2.5中试验结果显示,紫红笛鲷幼鱼在低麻状态下呼吸频率会略微下降并在一定时间后维持稳定。紫红笛鲷幼鱼在低浓度丁香酚溶液中耗氧率如图6所示,在10、15 mg/L丁香酚溶液中,紫红笛鲷幼鱼的耗氧率显著下降(P< 0.05)。
3 讨论
3.1 丁香酚麻醉紫红笛鲷幼鱼的有效浓度
丁香酚麻醉鱼类的作用机制是鱼体通过鳃丝或体表摄入后,首先抑制脑皮质,导致触觉丧失,鱼体麻木,再作用于基底神经节与小脑,最后作用于脊髓,致全身麻醉,鱼体进入深度镇静,呼吸平缓,鳃盖张合减慢[10-12]。国内外学者对鱼类有效麻醉浓度的定义相对统一,均认可Marking等研究提出的理想麻醉浓度,即能使实验鱼在3 min内进入4期麻醉,且5 min内完全复苏,存活率100%的浓度[6,12,23-24]。大量鱼类麻醉研究表明,随着麻醉剂浓度的增加,麻醉所需时间也相应缩短,复苏时间则逐渐增加,如黄斑篮子鱼幼鱼[6]、长薄鳅幼鱼(Leptobotiaelongata)[25]、许氏平鲉幼鱼(Sebastesschlegeli)[26]等。而本实验发现,随着丁香酚质量浓度的增加,紫红笛鲷幼鱼入麻时间相应缩短,但在70 mg/L以内复苏时间却没有逐渐增加,而是均保持一个相对长的时间,且各浓度下复苏时间差异不大,可能原因是紫红笛鲷幼鱼对丁香酚不甚敏感,入麻后富集的丁香酚剂量相差不大,复苏时间相近。而当丁香酚浓度大于70 mg/L时,复苏时间反而降低。推断原因,有可能由于高浓度的丁香酚能在更短时间内作用到鱼体中枢神经系统,从而进入麻醉状态,但由于时间很短,进入体内的麻醉剂量相对低浓度入麻时更少,所以复苏过程需要代谢的丁香酚也少,鱼体更容易复苏。
丁香酚对硬骨鱼类的最佳麻醉质量浓度大都集中在20~100 mg/L范围内[27]。在水温(29.5±0.9) ℃时,丁香酚对体质量为(1.041±0.477) g的紫红笛鲷幼鱼的有效浓度为30 mg/L。以往研究表明,丁香酚在不同水温下麻醉不同种类和规格实验鱼的有效浓度存在较大差异,本研究中得出的丁香酚麻醉紫红笛鲷幼鱼的有效浓度(30 mg/L)高于斑马鱼20 mg/L[19]、锦鲤15~20 mg/L[15]和神仙鱼5.5 mg/L[28]等,低于大西洋鲑50 mg/L[18]、罗非鱼(Tilapiamossambica)45 mg/L[29]和翘嘴鲌40~60 mg/L[21]等,总体上处于中等水平。
综合分析丁香酚浓度在30~90 mg/L时紫红笛鲷幼鱼的入麻时间、复苏时间及麻醉时的呼吸频率指标,发现30 mg/L丁香酚浓度为能达到理想麻醉效果的最低浓度,适合在短时间实验操作中推广使用。同时,随着丁香酚浓度的增加,紫红笛鲷幼鱼的入麻时间显著缩短,在实际生产中,为追求快速麻醉,可适当增加丁香酚浓度,但考虑到丁香酚浓度大于70 mg/L后,丁香酚能迅速富集到中枢神经系统造成麻醉效果,容易对鱼体造成伤害,建议不宜超过70 mg/L。
3.2 空气中暴露时间对紫红笛鲷幼鱼复苏的影响
麻醉是降低鱼的应激反应有效且常用的方法,常被用于亲鱼精卵采集、活鱼抽血、鲜活运输、试验取样和标记放流等,而在这些操作中常需将鱼捞出水面短时间置于空气中,因此,有必要研究空气暴露时间对麻醉鱼体复苏的影响。本实验结果表明,暴露时间小于8 min时,复苏时间随暴露时间的增加而下降;而当暴露时间大于8 min时,复苏时间随暴露时间的增加而增加(P<0.05);暴露6 min时复苏时间最短。在丁香酚深度麻醉鲫[17]和翘嘴鲌[21]的研究中,复苏时间随空气中暴露时间的增加而减少,而在大泷六线鱼(Hexagrammosotakii)[30]的麻醉研究中,复苏时间随暴露时间的增加而延长。本实验结果与丁香酚麻醉黄斑篮子鱼[6]和MS-222深度麻醉赤眼鳟(Squaliobarbuscurriculus)[5]幼鱼的研究结果相似,作者认为是当紫红笛鲷幼鱼捞出水面暴露在空中后,鱼体不再摄入丁香酚,相当于已进入复苏期,鱼体表和鳃部有水,能恢复部分呼吸,随着暴露时间的延长,紫红笛鲷幼鱼逐渐复苏,耗氧量也逐渐增加,而体表和鳃部的水中溶氧逐渐被消耗,实验鱼出现缺氧休克[6]。因此,暴露后期复苏时间逐渐增加,死亡率升高。根据本实验结果,入麻后空气中暴露6 min以内复苏率为100%。因此,丁香酚麻醉的紫红笛鲷幼鱼离水操作不宜超过6 min。
3.3 丁香酚对紫红笛鲷幼鱼呼吸频率的影响
大量研究结果表明,在麻醉过程中,随着麻醉程度的加深,鱼体的呼吸频率会逐渐减低,直至深度麻醉后呼吸停止,可能原因是鱼体被麻醉后体内代谢减缓,耗氧率低,鳃腔的水交换量下降所致[5-6,25-26]。本实验结果表明,在丁香酚溶液中浸泡5 min,无论丁香酚浓度高低,紫红笛鲷幼鱼的呼吸频率始终低于对照组。各浓度下呼吸频率在40 s内均迅速下降,并随着丁香酚的浓度升高而加速下降。在低浓度丁香酚溶液中(10 mg/L),紫红笛鲷幼鱼逐渐进入镇静期,呼吸频率缓慢降低后保持相对稳定。在中等浓度丁香酚溶液中(15、20 mg/L),紫红笛鲷幼鱼逐渐进入麻醉期,呼吸频率缓慢降低后也能保持相对稳定。当丁香酚麻醉浓度较高时(>60 mg/L),紫红笛鲷幼鱼在5 min内开始出现呼吸停止现象,且浓度越高,出现呼吸停止的时间越短。这与对黄斑篮子鱼[6]的麻醉研究类似,即当丁香酚浓度高时,丁香酚在短时间内富集到中枢神经系统并产生抑制作用,进入镇静期,呼吸频率下降。在本实验中,紫红笛鲷幼鱼在低浓度丁香酚溶液(10 mg/L)中保持在镇静期而不会进入更深的麻醉状态,可能是由于鱼体对丁香酚的代谢和吸入达到一个相对平衡的状态。
3.4 低麻状态下对紫红笛鲷幼鱼耗氧率的影响
在丁香酚质量浓度为10 mg/L时,紫红笛鲷幼鱼在20~30 min内处于2期麻醉(深度镇静期),这有利于紫红笛鲷幼鱼的运输,与罗非鱼[29]、锦鲤[31]的运输实验研究结论类似,说明在麻醉镇静期鱼体代谢慢,耗氧率低,适宜运输。结合紫红笛鲷幼鱼具有入麻慢且入麻后复苏时间长的特点,即使低浓度但浸泡时间长也会进入更深的麻醉状态,因此,建议对紫红笛鲷幼鱼长时间运输丁香酚浓度应小于10 mg/L。
紫红笛鲷幼鱼对丁香酚敏感程度较低,入麻过程持续较长,而一旦入麻则需要较长时间复苏。有效麻醉浓度为30 mg/L,生产上实际离水操作宜控制在6 min以内且时刻保持鱼体湿润,长时间操作或运输适宜浓度为10 mg/L以内,建议生产上短期操作使用浓度为30 mg/L,若追求更快麻醉,也不宜超过70 mg/L,迅速操作且时刻关注鱼的反应。
