木薯组培苗中叶绿素和类胡萝卜素含量分析
2020-06-08罗秀芹韦卓文杨龙薛晶晶
罗秀芹 韦卓文 杨龙 薛晶晶

摘要:以TM60444和SC9木薯(Manihot esculenta Crantz)组培苗根、茎、叶为材料,采用乙醇∶丙酮溶液萃取方法,利用紫外-可见分光光度计对两种木薯组培苗根、茎、叶中的叶绿素和胡萝卜素含量进行了测定,并对类胡萝卜素生物合成相关基因进行了定量分析。结果表明,两个品种叶绿素和胡萝卜素含量都是叶>茎>根;而类胡萝卜素含量是叶>茎≈根。
关键词:木薯(Manihot esculenta Crantz);类胡萝卜素;定量PCR;紫外-可见分光光度计
中图分类号:S533 文献标识码:A
文章编号:0439-8114(2020)04-0136-05
Abstract: Ultraviolet-visible spectrophotometer was used to detect the content of chlorophyⅡ and carotenoids in TM60444 and SC9 tissues culture seedings. Meanwhile, the relative genes of carotenoids biosynthesis were analyzed. The results showed that there is nearly no difference between two stains and the contents of chlorophyll and total carotene in two seedings: leaf>stem>root; and the content of carotenoids: leaf>stem, while the stem is approximately the root.
Key words: cassava Manihot esculenta Crantz; carotenoid; RT-PCR; UV spectrophotometer
木薯(Manihot esculenta Crantz)是大戟科(Euphorbiaceae)木薯属植物,具有高淀粉、高生物量、耐贫瘠、抗旱等优良属性[1]。木薯、甘薯和马铃薯合称世界三大薯类,广泛栽培于热带及亚热带部分地区,是全世界近10亿人的口粮。木薯因其块根富含淀粉,具有运用的广泛性和独特性,除了可以作为部分地区的主粮外,在化工、医疗、纺织等方面都有重要作用,也是动物饲料的重要来源,同时也是世界上公认的一种具有发展潜力的可再生能源作物[2,3]。木薯叶片粗脂肪、可溶性糖、蛋白质等含量高,可用作动物饲料[4-6]。光照是植物生长发育的必要条件,是光合作用的能量来源和主导因子,而光合作用的主要器官是植物叶片。光合作用过程中吸收光能的植物色素主要有叶绿素(叶绿素a、叶绿素b)和类胡萝卜素(胡萝卜素、叶黄素),其中叶绿素a和叶绿素b是吸收光能的主要物质,直接影响植物光合作用光能利用[7]。在完整的生物系统中,类胡萝卜素和叶黄素是共存的;而在光合系统中,叶绿素又与叶黄素共存[8]。目前,研究木薯植株多采用盆栽苗或地栽苗[9-12],木薯组培苗周期短、易于操作,除了可以检测叶片,也可同时检测茎和根部类胡萝卜素含量,其结果对木薯植株研究也有重要的指导意义[13]。此外,组培苗快速繁殖对木薯叶饲用需求也是一个很好的解决途径。
本研究对两种木薯主栽品种组培苗根、茎、叶,采用有机溶剂乙醇∶丙酮(1∶1)溶液萃取,测定其叶绿素和类胡萝卜素的含量,并结合荧光定量PCR分析其含量与基因表达调控的关系,旨在揭示木薯组培苗间类胡萝卜素积累的差异。
1 材料与方法
1.1 材料
供试材料为TM60444和SC9两种木薯组培苗,扩繁于农业农村部木薯种质资源保护与利用重点实验室组培室中,26 ℃光照16 h,黑暗8 h培养45 d。剪取每个品种的根、茎、叶各3份(0.1 g/份),液氮速冻后于-80 ℃保存备用。另外称取3份(0.3 g/份),待提取类胡萝卜素。
1.2 RNA提取与荧光定量PCR
1)提取根、茎、叶总RNA,反转录合成相应的cDNA第一鏈。每份样品取0.1 g保存于EP管中,置于-80 ℃保存,保存样品的EP管加入小钢珠后用液氮冻脆上下晃研磨至粉碎,参照天根生化科技(北京)有限公司的植物总RNA提取试剂盒提取总RNA;反转录合成cDNA第一链参照北京全式金生物技术有限公司的反转录试剂盒cDNA第一链试剂盒。
2)引物设计和荧光定量PCR方法参照文献[14]。
1.3 类胡萝卜素的提取与测定
参照黄秋蝉等[15]将样品用液氮研磨粉碎后置于20 mL离心管中,加入15 mL乙醇丙酮萃取液(1∶1,V/V),避光浸泡萃取24 h,期间颠倒混合3次,直至待测材料完全失去绿色为止,同时以乙醇丙酮萃取液为空白对照。利用紫外-可见分光光度计分别在470.0、474.0、485.0、462.5、649.0和665.0 nm波长下测定胡萝卜素、叶黄素提取液的吸光度。并按照以下公式算出叶绿素和类胡萝卜素含量(mg/L):
叶绿素a含量=9.99A665 nm-0.086 7A642.5 nm
叶绿素b含量=17.7A642.5 nm-3.04A665 nm
总叶绿素含量=27.9A649 nm
胡萝卜素含量=12.6A485 nm-6.00A470 nm-0.029 8a+0.336b
叶黄素含量=10.2A470 nm-11.5A485 nm-0.003 6a-0.625b
总类胡萝卜素含量=4.92A474 nm-0.025 5a-0.225b
2 结果与分析
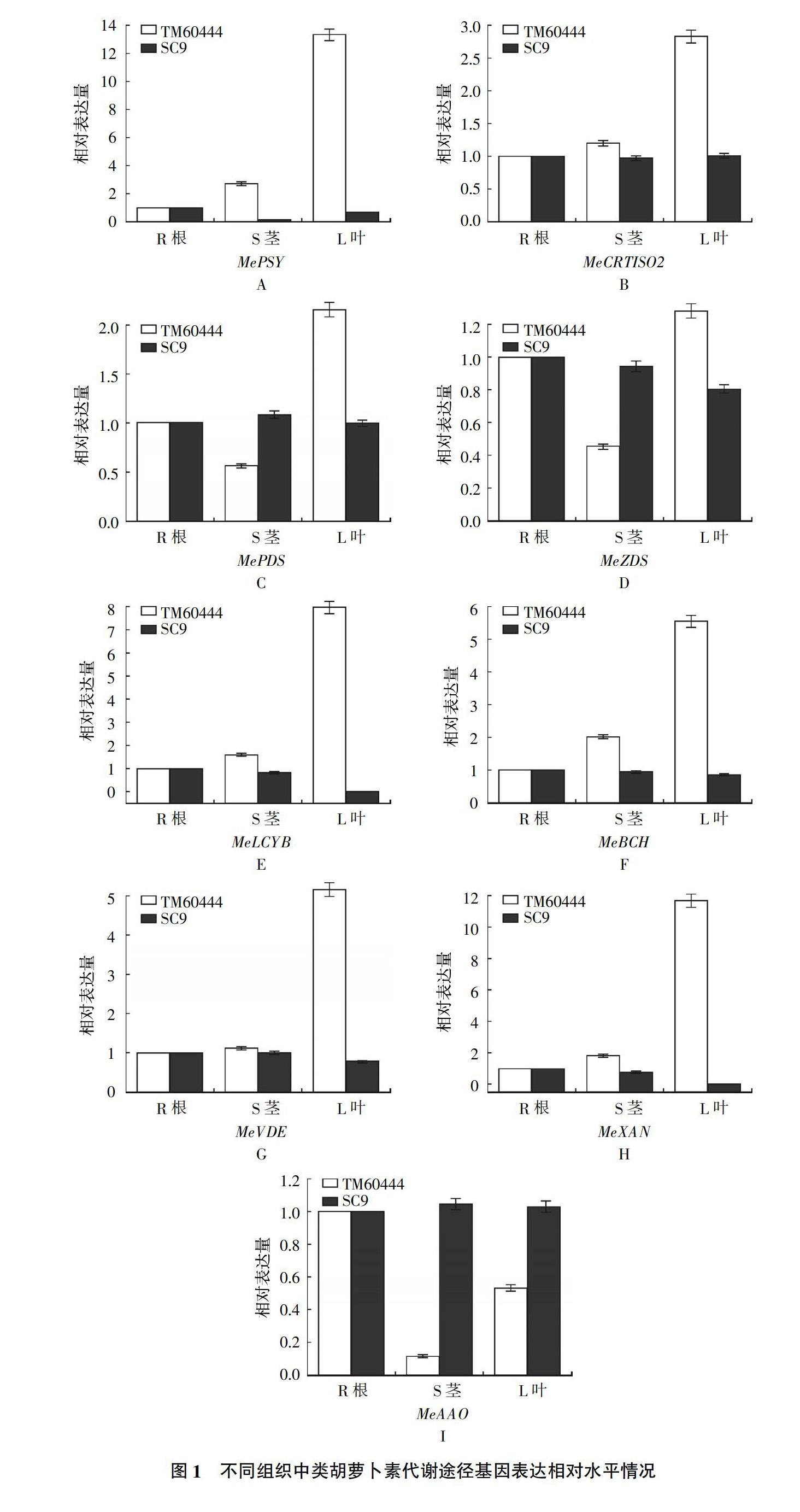
2.1 类胡萝卜素代谢途径基因表达情况
根茎叶中MePSY、MeCRTISO2、MePDS、MeZDS、MeLCYB、MeBCH、MeVDE、MeNXS、MeXAN和MeAAO基因相对表达情况如图1所示。TM60444中除了MeXAN和MeAAO呈下降趋势,其他基因表达水平基本呈上升趋势。SC9中类胡萝卜素代谢途径中所有基因基本呈下降或不变的趋势,MeNXS基因在两个品种的根茎叶中都不表达。TM60444中除了MeAAO,其他9个基因表达情况下类胡萝卜素含量基本是一致的,在根茎叶中含量随着基因表达呈上升趋势;而SC9根茎叶中所有基因表达基本变化不大甚至出现下调趋势,两个品种间的差异较明显。
2.2 类胡萝卜素含量
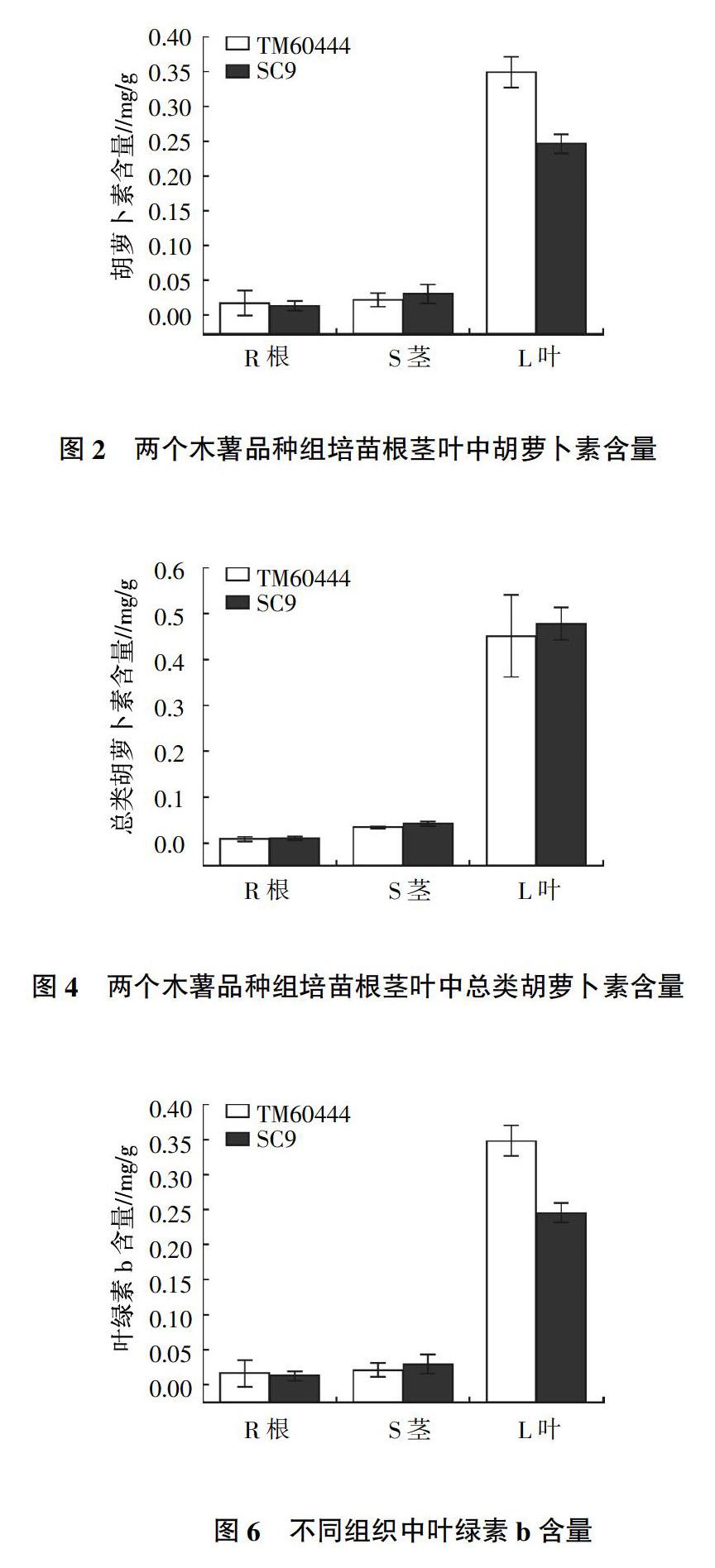
TM60444和SC9根茎叶根类胡萝卜素含量如图2至图4所示。类胡萝卜素含量是叶片中含量最高,根部和茎部接近。TM60444根部和葉片的胡萝卜素含量均比SC9高,特别是叶片;SC9茎中胡萝卜素含量却高于TM60444。叶黄素和总类胡萝卜素的含量都是叶中含量最高,茎中次之,根中最少。而SC9叶片叶黄素含量明显比TM60444高两倍多,两个品种根中叶黄素含量都出现了负值。类胡萝卜素包括叶黄素和各种胡萝卜素等,两个品种根茎叶中类胡萝卜素含量都很相近。
2.3 叶绿素含量
TM60444和SC9根、茎、叶中叶绿素含量如图5、图6所示。叶绿素a和叶绿素b含量都是叶片中含量最高,茎部次之,根部最少。叶绿素含量趋势与类胡萝卜素含量基本一致。
3 讨论
高等植物体内的色素主要以叶绿素、类黄酮和类胡萝卜素等形式存在,其中叶绿素主要包括叶绿素a和叶绿素b;类黄酮主要是花色苷;类胡萝卜素主要包括各种胡萝卜素和叶黄素[16]。木薯叶片中含有丰富的蛋白质和氨基酸,而氨基酸中缬氨酸(Val)和异亮氨酸(Ile)是合成亚麻苦苷和百脉根苷的主要原料[17]。木薯组培苗叶片中也含多种有效成分,叶绿素和类胡萝卜素含量最高。茎和根中也有少量的叶绿素和类胡萝卜素,这是由于组培苗生长在透光的组培瓶中,茎和根同时也能捕获到光源进行光合作用,合成相应的色素。类胡萝卜素属于二萜类化合物,主要由质体合成途径,番茄红素是第一个合成的类胡萝卜素前体,分支为α胡萝卜素和β胡萝卜素,而α胡萝卜素又是叶黄素的前体。叶黄素主要存在于绿色植物的叶绿素中,属于类胡萝卜素,通常颜色越是深绿的植物,叶黄素的含量就越高。本研究显示叶黄素含量基本与叶绿素含量是一致的。两个品种根中叶黄素出现负值,可能是因为叶黄素本身的抗氧化作用,对蓝光有吸收,也可能是叶黄素本身的不稳定产生降解或异构化[18,19],而根中本身含量就比较低,造成该波长下检测出负数。总的来说,组培苗叶片中的叶绿素、叶黄素和总类胡萝卜素含量都是最高的。前期对块根类胡萝卜素代谢途径的分析显示MeLCYB跟块根类胡萝卜素积累相关性最大[20],而本次试验结果显示组培苗与前期块根的研究结果有差异,几乎所有类胡萝卜素代谢的相关基因在TM60444的根茎叶中相对表达量都是呈递增趋势;而在SC9的根茎叶中则都呈现不变或者递减的表达关系。可能是由于不同的组织,植物品种和组织多样性导致。胡萝卜素和叶黄素之间存在转化关系,如SC9叶片中胡萝卜素含量低于TM60444,而叶黄素含量则相反,但两个品种中总类胡萝卜素含量是接近的。本研究结果表明不同品种木薯组培苗不同组织类胡萝卜素等含量基本一致。
参考文献:
[1] 陈冠喜,李开绵,叶剑秋,等.6个木薯品种生长发育及产量性状的初步研究[J].热带农业科学,2009,29(6):26-29.
[2] 张振文,李开绵,叶剑秋,等.木薯光合作用特性研究[J].云南大学学报(自然科学版),2007,29(6):628-632.
[3] LI K M,ZHU W L,ZENG K,et al. Proteome characterization of cassava (Manihot esculenta Crantz) somatic embryos,plantlets and tuberous roots[J].Proteome science,2010,8:10.
[4] 杨 龙,张冠冬,宋雁超,等.野生和栽培木薯叶片的营养及饲料价值研究[J].南方农业学报,2017,48(2):238-245.
[5] 周璐丽,王定发,张振文,等.华南7号木薯茎叶营养价值评价[J].热带作物学报,2016,37(12):2245-2249.
[6] 冀凤杰,侯冠彧,张振文,等.木薯叶的营养价值、抗营养因子及其在生猪生产中的应用[J].热带作物学报,2015,36(7):1355-1360.
[7] MADEIRA A C,MENTIONS A,FERREIRA M E,et al. Relationship between spectroradiometric and chlorophyll measurements in green beans[J].Comm in Soil Sci and Plant Anal,2000,31(5-6):631-643.
[8] 惠伯棣.类胡萝卜素化学与生物化学[M].北京:中国轻工出版社,2005.
[9] 康冬鸽,李瑞梅,胡新文,等.低温胁迫下木薯几种保护酶活性变化及其与耐寒性的关系[J].热带作物学报,2009,30(7):908-911.
[10] 黄秋凤,罗兴录,王春莲,等.低温胁迫对木薯幼苗生理特性的影响[J].中国农学通报,2010,26(17):172-177.
[11] 周玉飞,曾长英,陈 新,等.低温驯化对木薯耐寒性形态、生理特性的影响[J].热带农业科学,2011,31(6):31-36.
[12] 吴海宁,罗兴录,樊吴静,等.低温胁迫对不同木薯品种幼苗生理特性的影响[J].南方农业学报,2013,44(11):1791-1799.
[13] 欧文军,罗秀芹,李开绵.低温胁迫对木薯组培苗叶片若干代谢生理指标的影响[J].热带作物学报,2015,36(4):706-712.
[14] LUO X Q,TOMLINS K I,LUIZ J C B C,et al. The analysis of vandidate genes and loci involved with carotenoid metabolism in cassava(Manihot esculenta Carntz) using SLAF-seq[J].Acta Physiologiae Plantarum,2018,40:66.
[15] 黄秋婵,许元明,韦友欢,等.深色叶植物叶片类胡萝卜素含量比较[J].湖北农业科学,2013,52(11):2573-2574.
[16] 陶 俊,张上隆,徐昌杰,等.类胡萝卜素合成的相关基因及其基因工程[J].生物工程学报,2002,18(3):276-281.
[17] KANNANGARA R,MOTAWIA M S,HANSEN N K,et al. Characterization and expression profile of two UDP-glucosyl transferases,UGT85K4 and UGT85K5,catalyzing the last step in cyanogenic glucoside biosynthesis in cassava[J].Plant journal,2011,68(2):287-301.
[18] 肖亚冬,李大婧,刘春泉,等.叶黄素、β-隐黄质及其异构体检测方法的研究[J].現代食品科技,2016,32(2):335.
[19] 樊继鹏,徐振东,余文静,等.乳粉中叶黄素的测定方法及稳定性的影响[J].包装与食品机械,2014,3(24):20-23.
[20] 罗秀芹,杨 龙,肖鑫辉,等.木薯块根类胡萝卜素积累与主要基因表达谱分析[J].福建农林大学学报,2018,47(2):138-143.
