PI3K/Akt信号通路相关蛋白在胆管癌中的表达及其临床意义
2020-06-08黄利勇吴芳华郑志刚
黄利勇 吴芳华 郑志刚
【摘要】 目的:探讨PI3K/Akt信号通路相关蛋白PI3K、Akt、PTEN在胆管癌(cholangiocarcinoma,CCA)中的表达及其临床意义。方法:收集2010年1月-2017年1月本院47例CCA患者的癌组织及对应癌旁组织标本,另选择同期14例正常胆管组织标本。比较CCA、癌旁组织及正常胆管组织中PI3K、Akt与PTEN蛋白的阳性表达率,并分析PI3K、Akt与PTEN蛋白在CCA组织中阳性表达的相关因素及相关性。结果:CCA组织中PI3K与Akt的阳性表达率均高于癌旁组织和正常胆管组织(P<0.05);CCA組织中PTEN阳性表达率均低于癌旁组织和正常胆管组织(P<0.05);CCA组织、癌旁组织及正常胆管组织的PI3K、Akt及PTEN阳性表达率比较,差异均有统计学意义(P<0.05)。有无神经侵犯、浸润深度、淋巴结转移情况及TNM分期是PI3K、Akt及PTEN蛋白在CCA组织中阳性表达的相关因素(P<0.05)。PI3K、Akt与PTEN在CCA组织中的表达呈负相关(r=-0.635、-0.506,P<0.001),而PI3K与Akt在CCA组织中的表达呈正相关(r=0.332,P=0.023)。结论:PI3K/Akt信号传导通路在CCA组织中过度表达,可能参与了CCA的发生与发展,可作为生物学行为的评估指标,PI3K/Akt信号通路可望成为CCA临床干预的分子靶点。
【关键词】 胆管癌 PI3K/Akt信号通路 PTEN
[Abstract] Objective: To investigate the expression and clinical significance of protein PI3K, Akt and PTEN which correlated with PI3K/Akt signaling pathway in cholangiocarcinoma (CCA). Method: Cancer tissues and corresponding paracancer tissue specimens of 47 CCA patients were collected from our hospital from January 2010 to January 2017. Another 14 normal bile duct specimens were selected. The positive expression rates of PI3K, Akt and PTEN proteins in CCA, paracancer and normal bile duct tissues were compared, and the relevant factors and correlations of PI3K, Akt and PTEN proteins expressions in CCA tissues were analyzed. Result: The positive expression rates of PI3K and Akt in CCA tissues were higher than those in paracancer and normal bile duct tissues (P<0.05). The positive expression rate of PTEN in CCA tissues was lower than that in paracancer and normal bile duct tissues (P<0.05). There were significant differences in the positive expression rates of PI3K, Akt and PTEN in CCA, paracancer and normal bile duct tissues (P<0.05). The presence of nerve invasion, depth of infiltration, lymph node metastasis and TNM stage were the relevant factors for the positive expression of PI3K, Akt and PTEN in CCA tissues (P<0.05). PI3K and Akt were negatively correlated with the expression of PTEN in CCA tissues (r=-0.635, -0.506, P<0.001), while PI3K was positively correlated with the expression of Akt in CCA tissues (r=0.332, P=0.023). Conclusion: The PI3K/Akt signaling pathway is overexpressed in CCA tissues, which may be involved in the occurrence and development of CCA, and can be used as an evaluation indicator of biological behavior, PI3K/Akt signaling pathway is expected to become a molecular target for clinical intervention of CCA.
近年来,胆管癌(cholangiocarcinoma,CCA)的发病率逐年升高,因极具侵袭转移特性,且发病隐匿,导致大多数患者确诊即为晚期,尽管根治性手术切除对部分胆管癌患者预后有所获益,但5年生存率仍不高,中位生存时间仅1~2年,预后极差,因此一直是临床上的难治性疾病之一[1-2]。在人类肿瘤谱中均发现有活动异常的信号通路,推测其可能参与肿瘤发生、发展。研究发现磷脂酰肌醇3-激酶/蛋白激酶B(phosphatidylinositol 3-kinase/protein kinase B, PI3K/Akt)信号转导通路在多种恶性肿瘤中存在异常失调现象,此通路中相关成分突变可引起通路功能异常,不仅参与癌细胞增殖分化和凋亡,还与癌细胞的侵袭转移、促肿瘤新生血管生成以及拮抗放化疗等密切相关[3-4]。PI3K作为催化磷脂酰肌醇物质的特异性激酶,通过活化Akt参与细胞增殖、分化及凋亡,Akt是PI3K下游靶蛋白,可启动下游底物调控细胞周期、抑制凋亡及促血管生成,而负性调控因子PTEN功能丢失可激活PI3K/Akt信号通路,参与肿瘤发生发展。本研究对PI3K、Akt及PTEN在CCA中的表达情况进行分析,旨在探讨其在CCA发生发展中的作用及其与CCA生物学行为的关系,从而为CCA的预防及治疗提供新思路,现报道如下。
1 资料与方法
1.1 一般资料 收集2010年1月-2017年1月本院47例CCA患者的癌组织及对应癌旁组织(距离肿瘤2~3 cm)标本。另选择同期14例正常胆管组织标本(因外伤等原因切除的标本)。纳入标准:年龄25~75岁,均接受CCA根治手术且经术后病理学检查确诊为CCA;术前均未接受放化疗等肿瘤相关治疗;有完整的临床病理资料及随访资料。排除标准:既往或同期合并有其他恶性肿瘤相关疾病的患者。所有患者及家属均知情同意并签署知情同意书,本研究已经医院伦理委员会批准。
1.2 方法與试剂 采用免疫组化(SP)法检测PI3K、Akt及PTEN蛋白在CCA组织、癌旁组织及正常胆管组织中的表达情况。所有标本手术切除后均经10%甲醛固定及石蜡包埋,4 μm厚度连续切片。主要试剂包括兔抗人PI3K单克隆抗体、兔抗人Akt单克隆抗体、兔抗人PTEN多克隆抗体、SP二抗及DAB试剂盒均全套购自北京中杉生物技术有限公司,操作步骤严格按照试剂盒说明书进行。用公司提供的已知阳性组织作阳性对照,以PBS代替一抗作阴性对照。
1.3 判定标准 采用双盲法由两位有经验的病理医师对切片免疫组化染色结果进行判读。PI3K、Akt及PTEN蛋白的阳性表达均以细胞浆出现背景清晰的棕黄或棕褐色颗粒为标准。PI3K及PTEN蛋白表达于细胞质;Akt蛋白主要表达于细胞质,部分表达于细胞核。判定标准:(1)按切片中阳性细胞所占百分比计分:阳性细胞<25%为0分,26%~50%为1分,51%~75%为2分,>75%为3分;(2)按切片中阳性染色强度计分:无显色为0分,浅黄色为1分,棕黄色为2分,棕褐色为3分。根据阳性细胞所占比例及阳性染色强度进行综合评分,两项乘积≤4分记为阴性表达,>4分记为阳性表达。
1.4 统计学处理 采用SPSS 23.0软件对所得数据进行统计分析,计量资料用(x±s)表示,比较采用t检验;计数资料以率(%)表示,比较采用字2检验,相关性分析采用Spearman等级相关分析;生存分析采用Kaplan-Meier法,组间比较采用log-rank检验。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料比较 CCA及癌旁组织标本男31例,女16例;年龄42~72岁,平均(52±11)岁。正常胆管组织标本男9例,女5例;年龄25~75岁,平均(46±17)岁。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
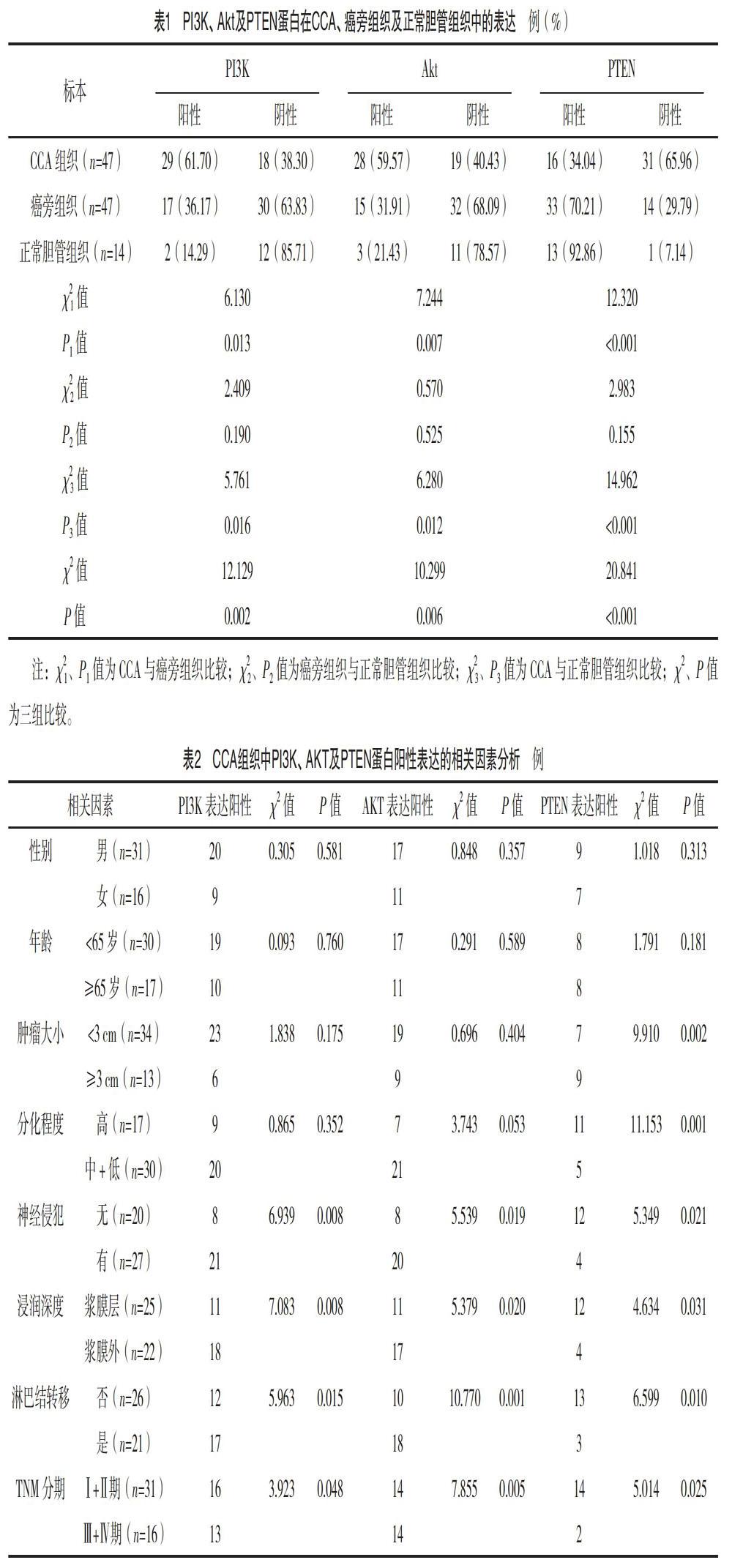
2.2 PI3K、Akt及PTEN蛋白在CCA、癌旁组织及正常胆管组织中的表达 CCA组织中PI3K与Akt的阳性表达率均高于癌旁组织和正常胆管组织,差异均有统计学意义(P<0.05);CCA组织中PTEN阳性表达率均低于癌旁组织和正常胆管组织,差异均有统计学意义(P<0.05);CCA组织、癌旁组织及正常胆管组织的PI3K、Akt及PTEN阳性表达率比较,差异均有统计学意义(P<0.05),但癌旁组织和正常胆管组织PI3K、AKT及PTEN阳性表达率比较,差异均无统计学意义(P>0.05)。见表1。
2.3 CCA组织中PI3K、AKT及PTEN蛋白阳性表达的相关因素分析 有无神经侵犯、浸润深度、淋巴结转移情况及TNM分期为PI3K、Akt及PTEN蛋白在CCA组织中阳性表达的相关因素,差异均有统计学意义(P<0.05)。见表2。
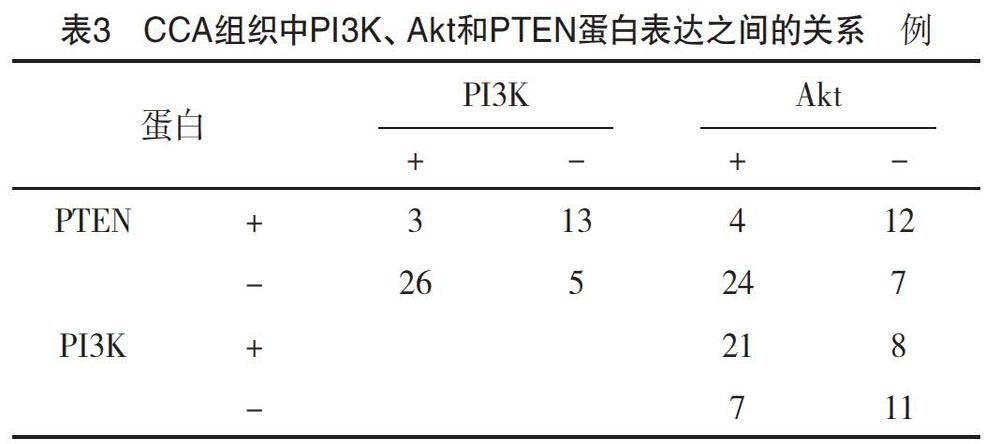
2.4 PI3K、AKT及PTEN蛋白在CCA组织中表达的相关性 PI3K、Akt均与PTEN在CCA组织中的表达呈负相关(r=-0.635、-0.506,P<0.001),而PI3K与Akt在CCA组织中的表达呈正相关(r=0.332,P=0.023)。见表3。
3 讨论
CCA是恶性程度极高、预后较差的恶性肿瘤之一。由于肝胆外科技术的发展与一系列新治疗方法的建立,CCA的无病生存期已逐渐延长,但是其复发率仍然很高,远期疗效较差[5-6]。在分子生物学方面,目前研究认为CCA的发生发展与侵袭转移是多基因、蛋白及细胞因子共同调控的复杂过程。PI3K/Akt是细胞中普遍存在的一种信号通路,可通过调控细胞周期、能量代谢及蛋白合成等途径在细胞增殖、分化与凋亡过程中发挥重要生理功能,此通路中某些成分的改变可导致细胞发生转化,而所致的功能缺失或获得在肿瘤细胞的增殖分化与侵袭转移等过程中起重要作用[7-9]。抑癌基因PTEN可通过对PI3K/Akt信号通路的负性调控而发挥抑制肿瘤形成的功能,PTEN失活则可降低对该通路的抑制作用而导致细胞癌变[10]。PI3K/Akt信号通路在CCA发生发展中发挥重要作用,主要表现为抑制肝癌细胞凋亡和促进细胞生存、促进肿瘤细胞的侵袭、转移及肿瘤血管生成,因此,针对本通路的靶向治疗已成为CCA研究焦点。
癌基因PI3K是磷脂激酶家族重要成员,为一种由调节亚基p85和催化亚基p110组成的异源二聚体,主要存在于细胞质内,具有激酶活性,可将刺激性信号由细胞膜传导至细胞浆[11-12]。PI3K具有抗细胞凋亡作用,Bertram等[13]研究证实PI3K抗凋亡功能可能通过抑制Fas凋亡而实现的。Banumathy等[14]则认为PI3K可引起Akt突变而使细胞失去正常生理功能,且诱发肿瘤生成,达到抑制肿瘤细胞凋亡的作用。本研究结果显示,CCA组织中PI3K蛋白阳性表达率明显高于癌旁组织及正常胆管组织(P<0.05),提示PI3K可能与CCA发生、发展有关,而其机制则可能是通过促进癌细胞增殖和抑制CCA细胞凋亡而实现。且分析显示当存在淋巴结转移、高侵袭性及肿瘤分期晚等高危因素时,CCA中PI3K蛋白的阳性表达率相应增高,提示在CCA的侵袭转移方面PI3K亦发挥着作用。
Akt为一种主要存在胞浆中在进化上高度保守的丝氨酸/苏氨酸蛋白激酶,由480个氨基酸残基组成,是PI3K下游蛋白。AKT的基本结构含有催化活性区,活性区中包含Thr308及Ser473位点,Akt通过血小板-白细胞C激酶同源区与PI3K相结合而使两位点磷酸化而被激活,进而发挥调控肿瘤细胞凋亡的生理功能[15-17]。早期Liu等[18]通过基因芯片技术发现HCC细胞中Akt的表达较正常肝脏组织明显升高。而Duronio等[19]研究证实Akt失活的等位基因可以改变其致癌现象。亦有研究显示Akt可激活内皮型NO合酶磷酸化而产生与血管新生关系密切的NO[20]。本研究发现,CCA组织中Akt蛋白阳性表达率高于癌旁组织与正常胆管组织,且随着侵袭性增高和病理分期升高其阳性率增加,提示CCA中Akt的表达增高与恶性进展密切相关,可能在CCA恶性演进中发挥重要作用。Akt抑制剂MK-2206是当前针对PI3K/Akt通路的研究热点,抑制Akt的功能可消除PI3K/Akt通路介导的增殖信号,抑制周期细胞活性,诱导肿瘤细胞凋亡[21]。
PTEN定位于人類第10q23.3染色体上,是具有双特异性磷酸脂酶活性的抑癌基因。其通过催化PI3K(3,4,5-三磷酸磷脂酰肌醇脱磷酸)去磷酸化还原为PIP2(4,5-二磷酸磷脂酰肌醇)实现对PI3K/Akt信号通路的负性调节,达到抑制细胞增殖和诱导细胞凋亡的作用[10]。因此PTEN的缺失或失活会引起PI3K/Akt信号通路高度激活,导致此通路的活化及促进下游信号分子活性。PTEN在多种肿瘤组织中低表达,如结直肠癌、子宫内膜癌、前列腺癌、小细胞肺癌等[22-23]。已有研究证实PTEN表达缺失与CCA发生发展密切相关[24]。本研究发现PTEN在CCA组织中阳性表达率明显低于癌旁组织及正常胆管组织(P<0.05),其表达与肿瘤大小、病理分级、侵袭性及病理分期均相关,表明PTEN参与了CCA发生发展,PIEN表达缺失或低表达导致其抑制正常细胞恶性转化的能力降低,进而使细胞癌变、增强细胞增殖、分化能力,与CCA恶性进展、高侵袭转移特性密切相关。
本研究中PI3K、Akt均与PTEN在CCA组织中的表达呈负相关(r=-0.635、-0.506,P<0.001),表明PI3K、Akt与PTEN在CCA发生发展中可能相互拮抗,CCA中PTEN表达缺失可能引起PI3K、Akt的活化失去抑制作用,导致PI3K、Akt过度表达,使PI3K/AKT通路处于持续活化状态,造成细胞增殖加快,促进肿瘤恶性进展。此外,PI3K与AKT在CCA组织中的表达呈正相关(r=0.332,P=0.023),提示PI3K和Akt两者协同促进CCA发生、发展及恶化进展。
综上所述,PI3K/Akt信号通路在CCA中过度表达可能与抑癌基因PTEN表达缺失有关,进而使PI3K、Akt的活化失去抑制作用,造成该通路持续活化,促进CCA细胞发生发展及侵袭转移等恶性进展。PI3K/Akt信号通路中的相关蛋白可作为生物学行为的评估指标,今后围绕PI3K/Akt信号通路开展CCA基因治疗,有望成为抑制CCA恶性进展、提高患者生存率的新手段。
参考文献
[1] Murad S D,Kim W R,Therneau T,et al.Predictors of pretransplant dropout and posttransplant recurrence in patients with perihilar cholangiocarcinoma[J].Hepatology,2012,56(3):972-981.
[2] Hameed A,Pang T,Chiou J,et al.Percutaneous vs.endoscopic pre-operative biliary drainage in hilar cholangiocarcinoma-a systematic review and meta-analysis[J].HPB (Oxford),2016,18(5):400-410.
[3] Jung K H,Choi M J,Hong S,et al.HS-116,a novel phosphatidylinositol 3-kinase inhibitor induces apoptosis and suppresses angiogenesis of hepatocellular carcinoma through inhibition of the PI3K/AKT/mTOR pathway[J].Cancer Lett,2012,316(2):187-195.
[4] Sabine V S,Crozier C,Brookes C L,et al.Mutational analysis of PI3K/AKT signaling pathway in tamoxifen exemestane adjuvant multinational pathology study[J].J Clin Oncol,2014,32(27):2951-2958.
[5] Krasinskas A M.Cholangiocarcinoma[J].Surg Pathol Clin,2018,11(2):403-429.
[6] Baheti A D,Tirumani S H,Rosenthal M H,et al.Diagnosis and management of intrahepatic cholangiocarcinoma:A comprehensive update for the radiologist[J].Clin Radiol,2014,69(12):463-470.
[7] Zhang Y,Zhang J W,Lv G Y,et al.Effects of STAT3 gene silencing and rapamycin on apoptosis in hepatocarcinoma cells[J].Int J Med Sci,2012,9(3):216-224.
[8] Bhaskar P T,Hay N.The two TORCs and Akt[J].Dev Cell,2007,12(4):487-502.
[9] Engelman J A.Targeting PI3K signalling in cancer:opportunities,challenges and limitations[J].Nat Rev Cancer,2009,9(8):550-562.
[10] Jiang B H,Liu L Z.PI3K/PTEN signaling in angiogenesis and tumorigenesis[J].Adv Cancer Res,2009,102(1):19-65.
[11] Paz-Ares L,Blanco-Aparicio C,Garcia-Carbonero R,et al.
Inhibiting PI3K as a therapeutic strategy against cancer[J].Clin Transl Oncol,2009,11(9):572-579.
[12] Engelman J A,Luo J,Cantley L C.The evolution of phosphatidylinositol 3-kinases as regulators of growth and metabolism[J].Nat Rev Genet,2006,7(8):606-619.
[13] Bertram J,Peacock J W,Tan C,et al.Inhibition of the phosphatidylinositol 3'-kinase pathway promotes autocrine Fas-induced death of phosphatase and tensin homologue-deficient prostate cancer cells[J].Cancer Res,2006,66(9):4781-4788.
[14] Banumathy G,Cairns P.Signaling pathways in renal cell carcinoma[J].Cancer Biol Ther,2010,10(7):658-664.
[15] Pande S,Browne G,Padmanabhan S,et al.Oncogenic cooperation between PI3K/Akt signaling and transcription factor Runx2 promotes the invasive properties of metastatic breast cancer cells[J].J Cell Physiol,2013,228(8):1784-1792.
[16] Yang N Y,Fernandez C,Richter M,et al.Crosstalk of the EphA2 receptor with a serine/threonine phosphatase suppresses the Akt-mTORC1 pathway in cancer cells[J].Cell Signal,2011,23(1):201-212.
[17] Meric-Bernstam F,Akcakanat A,Chen H,et al.PIK3CA/PTEN mutations and Akt activation as markers of sensitivity to allosteric mTOR inhibitors[J].Clin Cancer Res,2012,18(6):1777-1789.
[18] Liu L X,Liu Z H,Jiang H C,et al.Gene expression profiles of hepatoma cell line HLE[J].World J Gastroenterol,2003,9(4):683-687.
[19] Duronio V.The life of a cell:apoptosis regulation by the PI3K/PKB pathway[J].Biochem J,2008,415(3):333-344.
[20] Gordan J D,Simon M C.Hypoxia-inducible factors:central regulators of the tumor phenotype[J].Curr Opin Genet Dev,2007,17(1):71-77.
[21] Simioni C,Martelli A M,Cani A,et al.The AKT inhibitor MK-2206 is cytotoxic in hepatocarcinoma cells displaying hyperphosphorylated AKT-1 and synergizes with conventional chemotherapy[J].Oncotarget,2013,4(9):1496-1506.
[22]詹曉娟,余研,戴益琛,等.结直肠癌组织中PTEN、VEGF-A、MVD表达与临床病理参数的关系[J].癌症进展.2016,14(12):1239-1242.
[23] Boosani C S,Agrawal D K.PTEN modulators:a patent review[J].Expert Opin Ther Pat,2013,23(5):569-580.
[24] Yothaisong S,Dokduang H,Techasen A,et al.Increased activation of PI3K/AKT signaling pathway is associated with cholangiocarcinoma metastasis and PI3K/mTOR inhibition presents a possible therapeutic strategy[J].Tumour Biol,2013,34(6):3637-3648.
(收稿日期:2020-02-27) (本文编辑:田婧)
