Notch信号通路抑制剂DAPT对急性白血病细胞增殖及凋亡的作用
2020-06-08罗鸿伟陈日玲宋波田川蔡康荣
罗鸿伟 陈日玲 宋波 田川 蔡康荣

【摘要】 目的:探討Notch信号通路抑制剂DAPT对急性白血病细胞增殖及凋亡的作用。方法:选取2017年4月-2018年3月广东医科大学附属医院未化疗白血病患者20例为研究对象,根据形态-免疫-细胞遗传学-分子生物学(MICM)诊断分类,将研究对象骨髓样本中的单个核细胞分离并分为急性淋巴细胞白血病(acute lymphocyte leukemia,ALL)和急性髓系白血病(acute myeloid leukemia,AML),ALL与AML经纯化扩增后分别随机分为实验组及对照组,实验组均予以通路抑制剂DAPT 1 μmol/L共培养,对照组予以等量二甲基亚砜DMSO共培养,共培养72 h后计算各组细胞增殖抑制率,同时应用Annexin V-FIFC/PI检测细胞凋亡情况。结果:ALL中实验组的增殖抑制OD值低于对照组,差异有统计学意义(P<0.000 1);AML中两组的增殖抑制OD值比较,差异无统计学意义(P>0.05)。另外AML予DAPT干预72 h后对细胞进行计数,其中实验组细胞个数为8.6×105/mL,对照组细胞个数为9.2×105/mL,两组细胞数量比较,差异无统计学意义(P>0.05)。AML中实验组细胞凋亡率与对照组比较,差异无统计学意义(P>0.05)。ALL的实验组在培养72 h后细胞计数为5.2×105/mL,而对照组细胞计数9.0×105/mL,实验组的细胞计数明显低于对照组,差异有统计学意义(P<0.05)。ALL中实验组细胞凋亡率为(15.78±0.48)%,高于对照组的(6.25±0.49)%,差异有统计学意义(P<0.001)。结论:Notch信号通路抑制剂对ALL白血病细胞的增殖及凋亡起到重要的作用,而对AML无明显影响。
【关键词】 急性白血病细胞 Notch信号通路 DAPT 增殖 凋亡
[Abstract] Objective: To investigate the effect of Notch signaling pathway inhibitor DAPT on proliferation and apoptosis of acute leukemia cells. Method: A total of 20 non-chemotherapy leukemia patients in affiliated hospital of Guangdong Medical University from April 2017 to March 2018 were selected as the research objects, according to morphoid-immunocytogenetic-molecular biology (MICM) diagnostic classification, the mononuclear cells in the bone marrow samples of research objects were isolated and divided into acute lymphocyte leukemia (ALL) and acute myeloid leukemia (AML). After the purification and amplification of ALL and AML, they were randomly divided into the experimental group and the control group, the experimental group was co-cultured with the pathway inhibitor DAPT 1 μmol/L, and the control group was co-cultured with the same amount of dimethylsulfoxide DMSO, after co-culture for 72 hours, the inhibition rate of cell proliferation in each group was calculated. Result: In ALL, the proliferation inhibition OD value of the experimental group was lower than that of the control group, the difference was statistically significant (P<0.000 1); in AML, there was no statistically significant difference in proliferation inhibition OD values between the two groups (P>0.05). In addition, AML cells were counted after DAPT intervention for 72 h, the number of cells in the experimental group was 8.6×105/mL, and 9.2×105/mL in the control group, there was no significant difference in cell number between the two groups (P>0.05). There was no statistically significant difference in apoptosis rate between the experimental group and the control group in AML (P<0.05). In ALL, after 72 h of culture, the cell count of the experimental group was 5.2×105/mL, while 9.0×105/mL of the control group, the cell count of the experimental group was significantly lower than that of the control group, with statistically significant difference (P<0.05). In ALL, the apoptosis rate of the experimental group was (15.78±0.48)%, higher than (6.25±0.49)% of the control group, the difference was statistically significant (P<0.001). Conclusion: Notch signaling pathway inhibitor plays an important role in the proliferation and apoptosis of ALL leukemia cells, but has no significant effect on AML.
白血病(leukemia)为儿童发病率最高的恶性肿瘤之一,其造成的不良预后及相关并发症常导致儿童死亡;是一类造血系统异常增殖的单克隆恶性疾病,可在体内出现大量分化受阻的原始及幼稚细胞,与正常细胞出现恶性竞争使其正常生理功能无法发挥而导致一系列临床症状产生。尽管随着化疗方案的不断改进,大多数急性淋巴细胞白血病(acute lymphocyte leukemia,ALL)患儿能被治愈,但仍有约25%的患者出现复发,严重威胁患儿生命安全,增加患儿死亡率。然而,近年来随着对肿瘤细胞的深入研究发现Notch信号可在肿瘤细胞内出现异常增生表达,表明Notch信号通路的改变与肺腺癌、胆管癌、淋巴瘤、结直肠癌等多种肿瘤发生有关[1],另外日本儿童白血病研究协会(JACLS)曾在55例T-ALL患者中发现17例(30.9%)出现Notch1突变[2],这表明Notch信号通路在急性淋巴细胞白血病的发病中起到重要作用,但其具体作用机制仍不明确;γ-分泌酶可切割Notch受体,使Notch细胞内结构域解离至细胞核中导致靶基因的表达,而γ-分泌酶抑制剂DAPT是一种在实验中常用的阻断Notch信号通路的分子[3],因此能够抑制Notch信号通路的激活从而使靶基因沉默;本研究则通过体外实验,以急性淋巴细胞白血病为模型,探讨Notch信号通路抑制剂DAPT与急性白血病细胞增殖及凋亡的关系,以增加对急性白血病细胞发病机制的了解,为进一步阐明急性白血病可能的发病机制提供理论依据。
1 材料与方法
1.1 标本来源 经广东医科大学附属医院伦理委员会批准,并在获取家属知情同意及签订书面知情同意书后,于2017年4月-2018年3月从住院部收集未经任何化疗的急性白血病患者骨髓样本20例。(1)纳入标准:①入院前未用过糖皮质激素等化疗有关药物;②经MICM分型确诊为急性白血病患者;③无合并肝、肾及心脑血管疾病与其他恶性肿瘤者。(2)排除标准:①继发于免疫缺陷;②合并遗传代谢病;③入院前曾有放疗史;④中途要求退出者。
1.2 实验仪器及试剂 倒置相差显微镜(Leica公司),酶标测试仪(PerkinElmer公司),荧光显微镜(美国Bio-Rad公司),FACSCanto流式细胞仪(BD公司),DAPT(Selleckchem货号:S2215),RPMI1640基础培养基(Invitrogen,U.S.A货号:SH30809.01B),胎牛血清(Gibco,货号:04-002-1C),人骨髓分离液及样本稀释液(天津,货号:TBD2013LHU),MTT细胞增殖检测试剂盒(碧云天生物公司,货号:559763),AnnexinV-FIFC/PI细胞凋亡试剂盒(碧云天生物公司)。
1.3 方法
1.3.1 分组 从患者骨髓中分离出单个核细胞(MNCs),并根据MICM诊断分型将其分为ALL和急性髓系白血病(acute myeloid leukemia,AML);同一患者骨髓单个核细胞设为自身对照,经分离纯化培养后随机分为实验组和对照组,实验组均予以γ分泌酶抑制剂即DAPT 1 μmol/L浓度共培养;对照组为空白对照,加等量DMSO共培养实验。
1.3.2 骨髓标本抽取 选取2017年4月-2018年3月
广东医科大学附属医院初诊白血病患者(化疗前)20例,抽取骨髓样本后4~6 h内进行密度梯度分离。骨髓涂片原始细胞比例计算方法:通过油镜下计数每个标本的骨髓涂片细胞250个,然后按照髓系原始细胞个数/250个有核细胞所得。
1.3.3 单个核细胞分离及培养 用密度梯度离心法分离单个核细胞:将人淋巴细胞分离液复温后与骨髓标本等量混匀并离心;离心后管内液体分为明显的4层;提取第二层中的单个核细胞云雾状层置于另一无菌离心管中后再次离心,管底白色沉淀即为分离的单个核细胞。单个核细胞培养:将分离出的单个核细胞加入RPMI-1640培养基后置于培养箱内培养96 h;取上述生长状态良好的MNCs以1×104/mL接种于96孔板中,每组设置3个复孔,并在实验组加入1 μmol/mL DAPT,对照组加入1 μmol/mL DMSO后放入37 ℃、5%CO2培养箱中静置共培养72 h。
1.3.4 MTT检测细胞增殖活性 实验组与对照组培养72 h后于每孔均加入配制好的MTT溶液20 μL,放于CO2培养箱孵育4 h后离心后置于酶标仪570 nm读取各孔吸光度(A570)值,按(1-A570用药组/A570未用药组)×100%计算细胞增殖抑制率(%)。
1.3.5 AnnexinV-FIFC/PI检测细胞凋亡 实验组与对照组培养72 h后终止培养,离心后各组均加入100 μL 1×Binding Buffer工作液,混匀,再加5 μL Annexin V-FITC染料和5 μL PI染料,避光,室温下孵育15 min;上机前加入400 μL 1×Binding Buffer工作液后将细胞转移至流式管上机检测且需在1 h内完成检测。
1.4 统计学处理 采用SPSS 17.0软件,正态分布的计量数据以(x±s)表示,组间比较采用t检验,非正态分布的计量资料采用M(P25,P75)表示,以P<0.05为差异有统计学意义。
2 结果
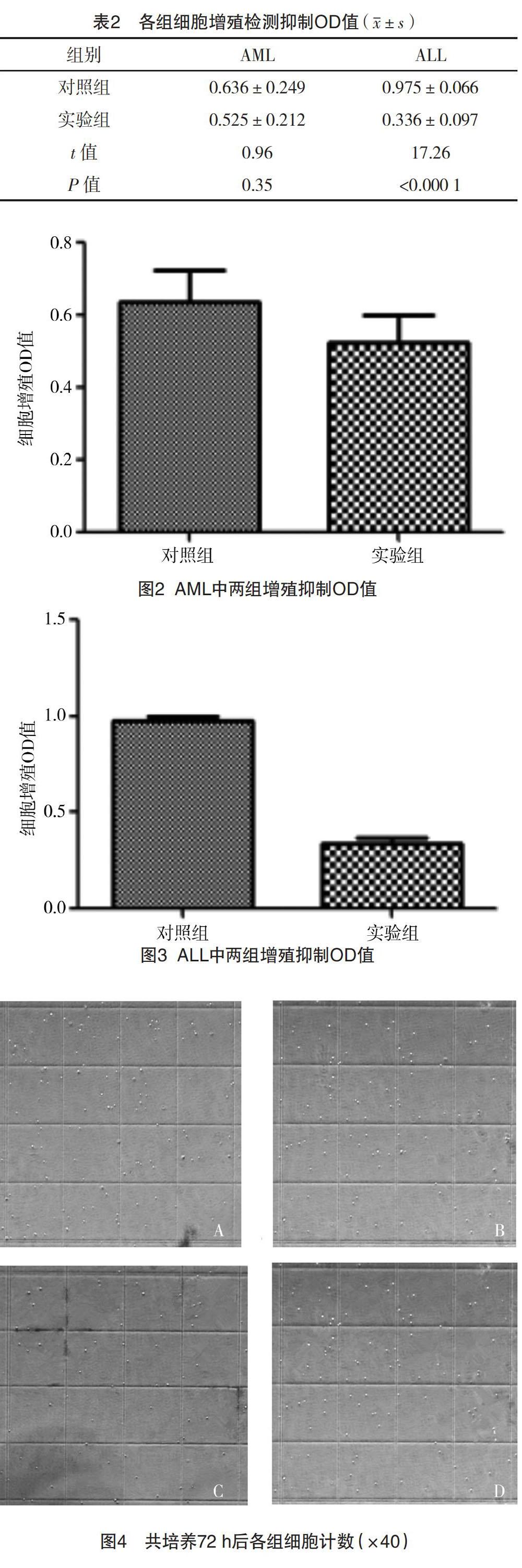
2.1 骨髓样本临床资料 收集急性白血病患者骨髓20例,所取样本中ALL共有11例,以B-ALL为主,占比81.81%(9/11),其中男6例,女5例,年齡1~11岁,平均5(3,10)岁,骨髓涂片原始细胞比例均值为74.15%。AML共有9例,其中男5例,女4例,年龄1~44岁,平均7(4,36.5)岁,骨髓涂片原始细胞比例均值为68.98%。根据MICM分型,临床资料结果见表1。
2.2 MNCs细胞形态学 在倒置显微镜下可观察到:骨髓中单个核细胞为圆形或类圆形,细胞大小相对一致,折光性好,见图1。
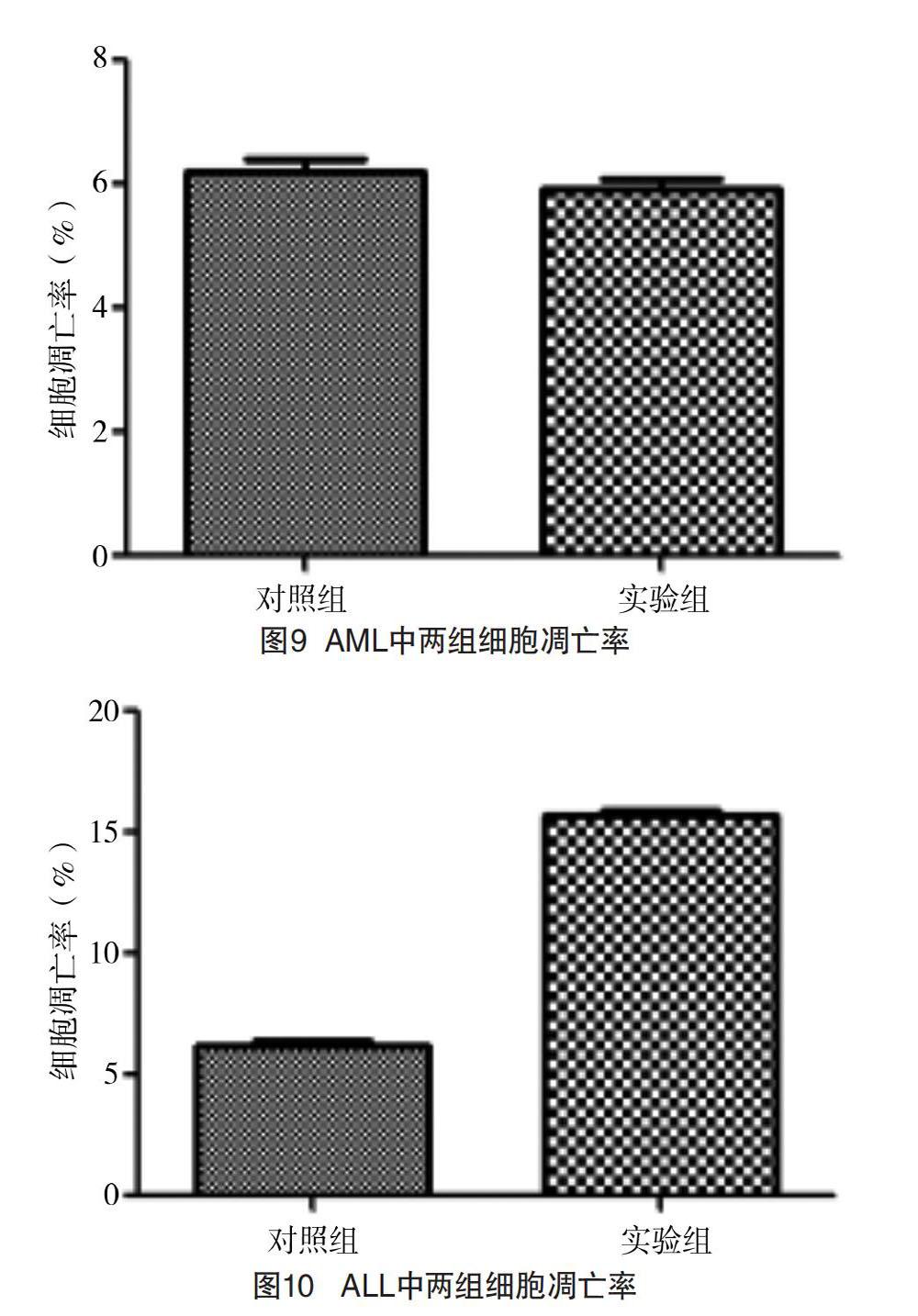
2.3 ALL和ALM中实验组和对照组细胞增殖检测OD值和细胞计数情况比较 (1)ALL:实验组的增殖抑制OD值低于对照组,差异有统计学意义(P<0.000 1);(2)AML:两组的增殖抑制OD值比较,差异无统计学意义(P>0.05)。见表2、图2和图3。另外AML予DAPT干预72 h后对细胞进行计数,其中实验组细胞个数为8.6×105/mL(图4A),对照组细胞个数为9.2×105/mL(图4B),两组细胞数量比较,差异无统计学意义(P>0.05)。ALL的实验组在培养72 h后细胞计数为5.2×105/mL(图4C),而对照组细胞计数为9.0×105/mL(图4D),实验组的细胞计数明显低于对照组,差异有统计学意义(P<0.05)。
2.4 AML和ALL中实验组细胞及空白对照组的细胞凋亡率比较 (1)AML:实验组予DAPT共培养72 h后置于荧光显微镜下观察,可见实验组(图5A)中代表早期凋亡的绿色荧光点及晚期凋亡的红色荧光点较对照组(图5B)无明显数量差异;进一步行流式细胞术检测发现,与对照组(图6)相比,实验组(图6)的流式散点图中Q2及Q4象限中细胞凋亡比例无明显差异性。实验组细胞凋亡率与对照组比较,差异无统计学意义(P>0.05)。(2)经DAPT干预ALL实验组72 h后予流式细胞仪进行检测,实验组(图7)的流式散点图中Q2及Q4象限中所代表的晚期凋亡及早期凋亡细胞比例均较对照组增加(图7),而Q4象限中活细胞比例则较对照组下降;且细胞凋亡免疫荧光图显示,实验组(图8A)每视野下的早期凋亡及晚期凋亡比例均大于对照组(图8B)。实验组细胞凋亡率为(15.78±0.48)%,高于对照组的(6.25±0.49)%,差异有统计学意义(P<0.001)。见表3、图9和图10。
3 讨论
白血病是一种常见的血液系统恶性肿瘤之一,但其具体发病机制仍不明确。Jundt等[4]研究表明,Notch信号通路与白血病和淋巴瘤的发病有关;而Notch基因于1917年由Morgan等从果蝇中发现并命名,后续的进一步研究表明包括小鼠和人在内的哺乳动物的Notch存在四种受体(Notch1-4)及五个配体(Delta-like 1、Delta-like 3、Delta-like 4、Jagged1和Jagged2),Notch通路的激活发生在五种配体中的一种与四种受体中的一种结合之后,导致受体的活性形式被称为“Notch细胞内结构域”[5]。对于细胞,Notch基因具备可选择性地抑制或诱导分化、促进生存或诱导凋亡的能力,为促进或阻碍多种细胞类型的癌变提供了机会,这些不同的选择可直接或间接激活Notch下游靶基因的不同补体如CD25、Ptcra[6],从而对细胞产生不同的作用,这对细胞生长发育起到重要作用。Siemers等[7]首先报道了一项γ-分泌酶抑制剂在体内作用于阿尔茨海默病患者的随机研究,但目前关于γ-分泌酶的酶活性和γ-分泌酶抑制剂作用于白血病细胞的相关研究很少,故本实验通过γ-分泌酶抑制剂DAPT作用于白血病细胞,从而阻断细胞内Notch信号通路,进一步印证Notch信号通路对急性白血病的作用。
本研究结果显示,当Notch信号抑制剂DAPT作用于急性淋巴细胞白血病细胞时,ALL细胞增殖率较对照组降低,差异有统计学意义(P<0.000 1);而凋亡率则较对照组增加,差异有统计学意义(P<0.001),提示阻断Notch信号通路可促进ALL白血病细胞凋亡;Notch在造血发育过程中起着重要作用,早在胚胎造血早期,Notch1信号就被证实在第一代造血干细胞的发育过程中是不可缺少的,Kuang等[8]发现在人B-ALL白血病中Notch通路可抑制早期B细胞分化,导致细胞生长停滞和凋亡,其中的机制可能与异常启动子DNA甲基化和组蛋白修饰致肿瘤抑癌基因的沉默有关,且使用MCA微阵列可在B-ALL样本中在检测到Notch通路基因Notch3和Hes5为高甲基化,提示Notch对B-ALL肿瘤细胞具有抑制作用,且Kamga等[9]研究发现,在未经任何有效化疗的高危急性B淋巴细胞白血病患者体内中Notch3、Notch4和Jagged2存在过表达现象,但在阿糖胞苷、地塞米松和阿霉素等有效化疗后Notch1-4在体内的表达水平却出现下降,提示Notch信号通路可影响B-ALL的增殖及凋亡,进一步的体外试验发现γ-分泌酶抑制剂(GSI)和抗Notch4都能够通过上调细胞内活性氧的水平来增强B-ALL细胞中化疗药物诱导的细胞死亡,降低B-ALL细胞的细胞存活率,这与本次实验结果一致;另外在1991年Notch1被确定为T细胞急性淋巴细胞白血病(T-ALL)患者t(7︰9)(q34;q34)易位的一部分时,异常Notch激活首次与癌症相关,这种易位暗示Notch1是一种T细胞致癌基因[10],而另一项研究更是认为有大于50%以上的T-ALL病例存在Notch1基因的激活突变,揭示Notch1突变是T-ALL中最常见的致癌病变[11],且Mendes等[12]研究显示,阻断Notch1可以通过多种途径抑制PI3K/AKT/mTOR信号传导,导致T-ALL细胞在体外和体内的存活率降低,以上研究与本次实验结果一致,但在T-ALL患者中,Notch1和FBXW7突变通常与良好的预后和较低的微小残留病(MRD)水平相关[13];但由于本实验中因T-ALL样本量少,进一步的结论需要更多的样本量。
另外本研究结果还发现,当Notch信号抑制剂DAPT作用于急性髓系白血病细胞时,AML的DAPT组细胞与Control組细胞增殖、凋亡比较,差异均无统计学意义(P>0.05);而Lbory等[14]研究发现,Notch信号传导途径在原发性AML患者细胞中为沉默表现,当使用活性形式的Notch1或Notch2的条件诱导型等位基因,或在体外使用重组配体介导的方式均能激活Notch信号通路,使体内Notch由沉默转变为再激活,从而引起细胞周期快速停滞、AML细胞快速凋亡,因而有效地抑制AML疾病
進展;另外Ye等[15]也认为N-甲基血红素氯化物(NMHC)可通过激活Notch信号强制表达或模拟Notch配体的多肽效应,从而起到阻碍AML细胞分裂、并诱导其凋亡而成功抑制白血病的发生;Kannan等[16]研究发现人类AML样本具有Notch受体的强大基因数据表达谱,但Notch受体的激活和下游Notch靶标的表达却非常低,这表明Notch虽广泛存在于人AML中,但并未被广泛激活而表现为基因沉默,而被激活的Notch1、Notch2和HES1则可导致体内AML生长停滞和caspase依赖性凋亡,且通过dnMAML抑制Notch则可增强AML在体内的增殖,从而揭示了Notch信号对AML的作用。相反,文献[17-18]研究认为,Notch信号对AML生长和生存的影响是可变的,这取决于个体AML样本,Notch信号传导途径在AML的细胞中的表达水平并不一致,表明可能存在不同的致癌信号传导途径或涉及调节的其他未发现的相关因子,使得各种信号传导途径和细胞因子相互作用导致细胞所处的微环境或Notch受体的分子量、配体密度及活性发生变化,最终导致了不同AML细胞表现出不同的分化、增殖、凋亡等结果;此外,Tohda等[17]从12例患者的血液中分离出的AML细胞置于涂有Jagged1,Delta1或对照IgG的孔中培养,使用比色法评估短期细胞生长变化,结果显示,暴露于不同配体后,膜结合的Notch受体识别Delta1和Jagged1家族的配体时,它们会被金属蛋白酶和γ-分泌酶复合物裂解,从而使细胞内结构域释放到细胞核中,并与辅因子结合以控制大量靶标,导致急性髓系白血病细胞的短期生长根据不同配体产生不同的结果,即促进、抑制或无明显作用。而本实验中考虑可能与样本量不够大或细胞培养条件、细胞本身异质性及其他信号通路共同作用下的癌变的影响下出现阴性结果,但进一步的结论仍需要进行更多研究以更好地描述Notch在AML中的作用。
综上所述,DAPT阻断Notch信号通路可促进ALL中白血病细胞的凋亡,抑制增殖,但对AML骨髓中的白血病细胞增殖、凋亡无明显作用,本实验为进一步明确Notch信号通路在白血病细胞增殖、凋亡中的作用以及急性白血病的靶向治疗的研究提供了理论依据和实验基础。
参考文献
[1] Ntziachristos P,Lim J S,Sage J,et al.From fly wings to targeted cancer therapies: a centennial for notch signaling[J].Cancer Cell,2014,25(3):318-334.
[2] Park M,Taki T,Oda M,et al.FBXW7 and NOTCH1 mutations in childhood T cell acute lymphoblastic leukaemia and T cell non-Hodgkin lymphoma[J].British Journal of Haematology,2009,145(2):198-206.
[3] Li Z,Wang J,Zhao C,et al.Acute Blockage of Notch Signaling by DAPT Induces Neuroprotection andNeurogenesis in the Neonatal Rat Brain After Stroke[J].Translational Stroke Research,2016,7(2):132-140.
[4] Jundt F,Schwarzer R,Dorken B.Notch signaling in leukemias and lymphomas[J].Current Molecular Medicine,2008,8(1):51-59.
[5] Kidd S,Kelley M R,Young M W.Sequence of the notch locus of Drosophila melanogaster: relationship of theencoded protein to mammalian clotting and growth factors[J].Molecular and Cellular Biology,1986,6(9):3094-3108.
[6] Hoofd C,Giambra V,WENG A P.Notch Signaling in T-Cell Acute Lymphoblastic Leukemia and Other Hematologic Malignancies[M].Springer New York,2018:199-225.
[7] Siemers E R,Quinn J F,Kaye J,et al.Effects of a gamma-secretase inhibitor in a randomized study of patients with Alzheimer disease[J].Neurology,2006,66(4):602-604.
[8] Kuang S,Fang Z,Zweidler-mckay P A,et al.Epigenetic inactivation of Notch-Hes pathway in human B-cell acute lymphoblastic leukemia[J].PLoS One,2013,8(4):e61807.
[9] Kamga T P,Collo G D,Midolo M,et al.Inhibition of Notch Signaling Enhances Chemosensitivity in B-cell Precursor AcuteLymphoblastic Leukemia[J].Cancer Research,2019,79(3):639-649.
[10] Ellisen L W,Bird J,West D C,et al.TAN-1,the human homolog of the Drosophila notch gene, is broken by chromosomaltranslocations in T lymphoblastic neoplasms[J].Cell,1991,66(4):649-661.
[11] Weng A P,Ferrando A A,Lee W,et al.Activating mutations of NOTCH1 in human T cell acute lymphoblastic leukemia[J].Science (New York,N.Y.),2004,306(5694):269-271.
[12] Mendes R D,Cante-Barrett K,Pieters R,et al.The relevance of PTEN-AKT in relation to NOTCH1-directed treatment strategies in T-cell acute lymphoblastic leukemia[J].Haematologica,2016,101(9):1010-1017.
[13] Breit S,Stanulla M,Flohr T,et al.Activating NOTCH1 mutations predict favorable early treatment response andlong-term outcome in childhood precursor T-cell lymphoblastic leukemia[J].Blood,2006,108(4):1151-1157.
[14] Lobry C,Ntziachristos P,Nsiaye-Lobry D,et al.Notch pathway activation targets AML-initiating cell homeostasis and differentiation[J].The Journal of Experimental Medicine,2013,210(2):301-319.
[15] Ye Q, Jiang J, Zhan G, et al.Small molecule activation of NOTCH signaling inhibits acute myeloid leukemia[J].Scientific Reports,2016,6:26510.
[16] Kannan S,Sutphin R M,Hall M G,et al.Notch activation inhibits AML growth and survival: a potential therapeuticapproach[J].The Journal of Experimental Medicine,2013,210(2):321-337.
[17] Tohda S,Kogoshi H, Murakami N,et al.Diverse effects of the Notch ligands Jagged1 and Delta1 on the growth anddifferentiation of primary acute myeloblastic leukemia cells[J].Experimental Hematology,2005,33(5):558-563.
[18] Dallas M H, Varnum-Finney B, Delaney C,et al.Density of the Notch ligand Delta1 determines generation of B and T cell precursors from hematopoietic stem cells[J].The Journal of Experimental Medicine,2005,201(9):1361-1366.
(收稿日期:2019-11-05) (本文編辑:张爽)
