烯啶虫胺对褐飞虱的亚致死效应
2020-06-08程世阳龚佑辉王福莲
程世阳 龚佑辉 王福莲

摘要 测定了烯啶虫胺亚致死浓度对处理当代褐飞虱及其子代生物学特性的影响。结果表明:与对照相比,烯啶虫胺亚致死浓度LC15(0.011 mg/L)处理褐飞虱3龄若虫,其发育历期显著延长,成虫羽化率显著下降,单雌产卵量从226.6粒下降到176.4粒,产卵期也显著缩短;子代的发育历期比对照组显著缩短,而子代的产卵量、产卵期和成虫寿命均与对照组无显著差异。子代种群数量趋势指数与对照组也无明显差异。上述结果表明,烯啶虫胺亚致死浓度处理对当代褐飞虱生长发育和繁殖产生不利影响,子代发育历期缩短可能使褐飞虱存在一定的再猖獗风险。
关键词 烯啶虫胺; 褐飞虱; 亚致死效应; 繁殖力; 生物适合度
中图分类号: S 435.112.3 文献标识码: B DOI: 10.16688/j.zwbh.2019476
Abstract The effects of sublethal concentration of nitenpyram on performance of the treated generation and the F1 generation of Nilaparvata lugens were assessed. When the 3rd instar nymphs of brown planthopper were exposed to nitenpyram at the LC15 (0.011 mg/L), nymphal development was significantly prolonged, adult emergence rate was significantly decreased, fecundity per female was significantly decreased from 226.6 to 176.4, and oviposition period was also significantly shortened. In the F1 generation, the nymphal developmental duration was significantly shortened, while fecundity, oviposition period, adult longevity, and population trend index were not significantly affected by the treatment on the parental generation. These results indicate that the sublethal concentration of nitenpyram has adverse effects on growth and development of the treated generation of brown planthopper, but the negative effects are not as pronounced in the offspring (F1) generation. The shorter developmental duration of the F1 generation may pose a possible risk of population resurgence after N. lugens exposure to sublethal concentration of nitenpyram.
Key words nitenpyram; Nilaparvata lugens; sublethal effect; fecundity; biological fitness
褐飞虱Nilaparvata lugens (Stl)是目前为害水稻的重要害虫之一,遍布于热带、亚热带和温带地区。其主要通过直接刺吸稻茎韧皮部的汁液;和传播水稻病毒(齿叶矮缩病毒和草状丛矮病毒)导致水稻减产,严重时呈“虱烧”状[1]。在中国每年发生3~8代,为害单季中、晚稻和双季早稻较重。2005年-2007年,我国曾连续三年褐飞虱大发生,对水稻生产构成严重威胁[2]。现在亚洲地区平均每年由褐飞虱造成的水稻减产约100万t[3]。
杀虫剂施于田间后,毒力会随着时间的推移和环境的改变逐渐递减,从而形成亚致死剂量[4-5]。当个体暴露在该剂量条件下时,对个体生理和行为上产生的影响称为亚致死效应[6]。因杀虫剂种类、剂量高低和其作用对象不同,亚致死效应会对昆虫的生长发育产生不同影响[7],如不利于昆虫生长发育[8-10],刺激增殖[11-12],导致害虫对农药的耐受性或抗药性增加[13-14]及害虫再猖獗[15-16]。
烯啶虫胺属于氯代烟碱类杀虫剂,作用于昆虫中枢神经系统的烟碱型乙酰胆碱受体[17]。烯啶虫胺是防治刺吸式口器害虫的主要杀虫剂,近年来作为替代产品用于防治对吡虫啉有抗性的褐飞虱种群[18-20]。由于烯啶蟲胺近年来的大量使用,关注褐飞虱田间种群的敏感性非常重要。Zhang等[20]报道褐飞虱田间种群对烯啶虫胺的LC50为0.45~6.44 mg/L,显示出中等抗性水平。广东和湖北稻区褐飞虱对烯啶虫胺产生了低到中等水平的抗性[21-22]。
了解药剂的亚致死效应是评估其管理风险的关键[23]。目前,烯啶虫胺是防治褐飞虱的主要杀虫剂,而关于其亚致死剂量对褐飞虱生长发育和种群发展的影响研究较少。我们在室内研究了烯啶虫胺亚致死浓度对处理当代褐飞虱及其子代生物学特性的影响,可为褐飞虱的可持续治理及烯啶虫胺的科学合理使用提供理论依据。
1 材料与方法
1.1 供试虫源
供试褐飞虱种群受赠于华中农业大学李建洪教授实验室,原采集于湖北农业科学院水稻田,在未接触过任何农药的情况下用‘台中一号稻苗室内饲养已10年以上,饲养条件为(27±1)℃、光周期L∥D=16 h∥8 h、相对湿度在70%左右。
1.2 供试药剂
烯啶虫胺(nitenpyram)原药,纯度97%,购自北京普益华科技有限公司(Macklin),TritonX-100购自国药集团化学试剂有限公司,丙酮购自北京化工厂。
1.3 毒力测定
烯啶虫胺对褐飞虱的毒力测定采用稻苗浸渍法[24-26]。用电子天平(精度为万分之一)称取烯啶虫胺原药,用丙酮溶解,然后用含0.1% Triton X-100的蒸馏水稀释成一系列浓度。选取长势良好,高约7 cm的‘TN1稻苗20株左右,洗净。然后将稻苗分别在不同浓度的药液中浸泡30 s,用湿润脱脂棉包裹根部,并放进一次性塑料杯(d=5 cm,h=7.5 cm)中,每杯接入3龄若虫15头,罩上纱网罩。静置2 h后,剔除损伤个体。以含0.1% Triton X-100的蒸馏水作为对照,每个处理重复3次,然后将装置放入温度(27±1)℃,相对湿度70%,光周期L∥D=16 h∥8 h的人工气候箱中。96 h后检查并记录死亡情况。
1.4 烯啶虫胺亚致死剂量处理对褐飞虱生物学特性的影响1.4.1 对处理当代的影响
若虫生长发育和存活率:根据烯啶虫胺毒力测定结果,用供试褐飞虱种群的LC15作为亚致死浓度处理褐飞虱3龄若虫,同时用只含0.1% Triton X-100的蒸馏水为对照,处理方法同1.3。每处理40头若虫,每个处理设置3次重复。96 h后存活若虫单头转移到平底玻璃试管(d=25 mm,h=75 mm)中的分蘖期稻苗的茎段(4~5 cm)上,试管内加1 mL的灭菌超纯水保持茎段新鲜。每日观察记录直至成虫羽化。每2 d更换一次稻茎。处理后若虫饲养在上述人工气候箱中。
成虫繁殖力:取初羽化的成虫随机配对,饲养于平底玻璃试管(d=40 mm,h=180 mm)内,管内有高约10 cm且长势良好的稻苗[27],管口用尼龙网封口。每天定时观察,记录每日孵化的若虫数量(计数后移出用于下述试验)和成虫存活状况,直至成虫死亡。一对成虫为一次重复,每处理至少15个重复。计算每雌产卵量和成虫寿命。
1.4.2 对子代的影响
随机选取处理组和对照组24 h内孵化的若虫,转移至含1 mL灭菌超纯水的平底玻璃试管(d=25 mm,h=75 mm)内分蘖期稻苗的茎段(4~5 cm)上单头培养,用保鲜膜封口。每组4个重复,每重复25头若虫。每2 d更换一次稻茎。每天观察记录若虫的存活情况,直至羽化为成虫。计算龄期、初孵若虫到3龄若虫存活率(Sr1)、3龄到5龄若虫存活率(Sr2)、雌虫比例(Fr)。子代繁殖力测定方法同亲代,并计算羽化率(Er)、交配率(Cr)、每雌产卵量(Fd)。
参照庞雄飞和刘泽文的方法构建实验种群生命表[28-30],并据此计算种群数量趋势指数(I),确定相对适合度的变化。Nt=N0×Sr1×Sr2×Er×Cr×Fr×Fd
I=Nt/N01.5 数据处理
采用POLO-Plus2.0软件计算LC15值。采用独立样本t检验分析褐飞虱发育历期、寿命、产卵量等在处理组与对照组之间的差异显著性。
2 结果与分析
2.1 烯啶虫胺的毒力
烯啶虫胺对褐飞虱的毒力测定结果如表1。烯啶虫胺对褐飞虱3龄若虫的LC50和LC15分别为0.023 mg/L和0.009 mg/L。
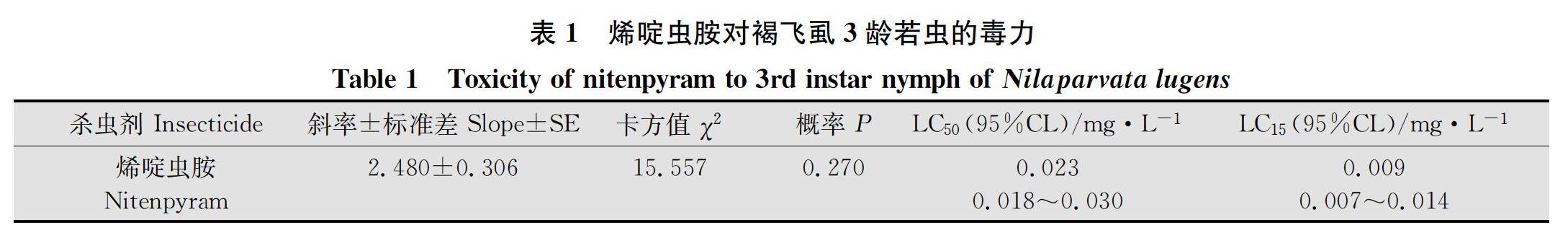
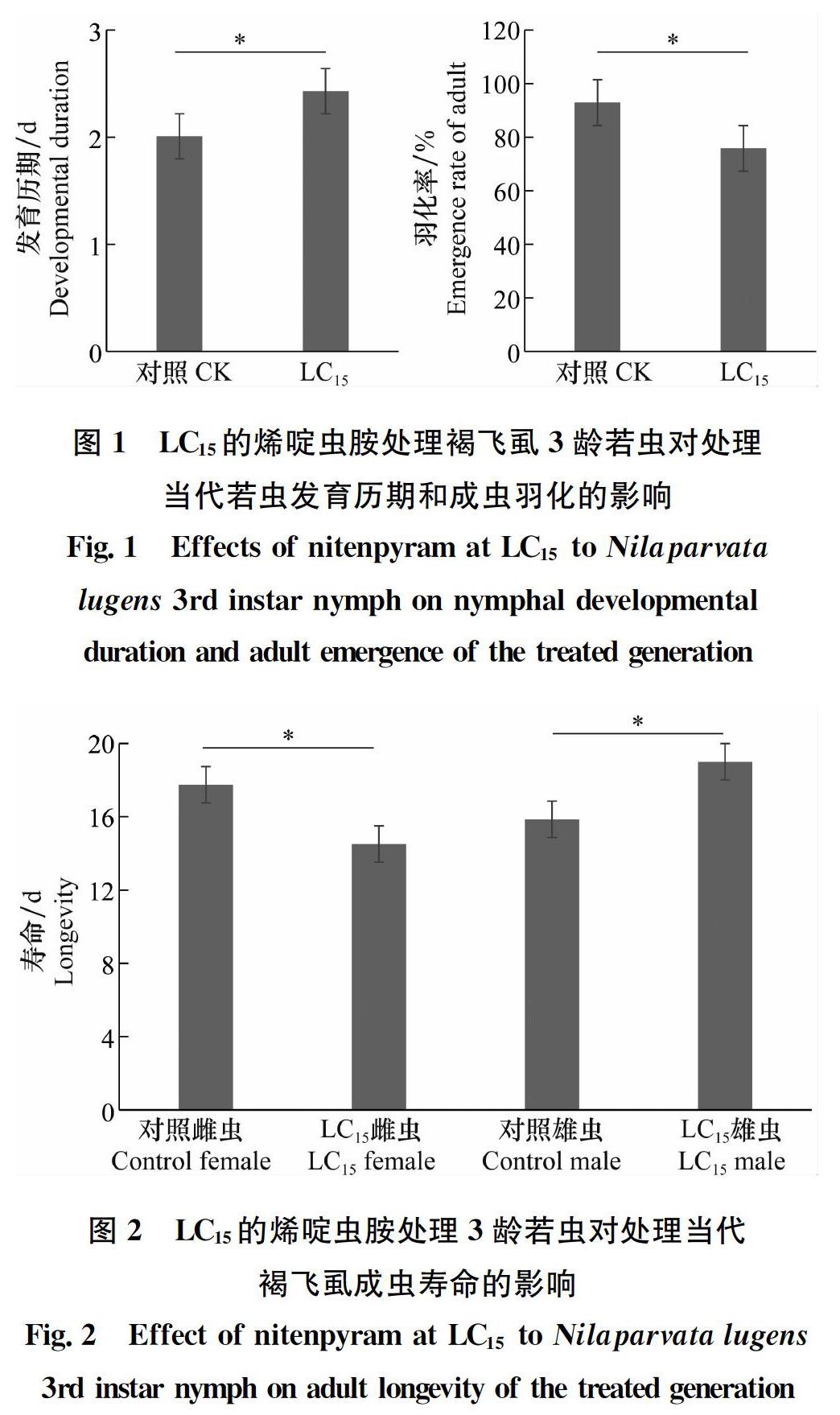
2.2 烯啶蟲胺亚致死浓度对处理当代褐飞虱生长发育和繁殖力的影响 如图1所示。LC15的烯啶虫胺处理褐飞虱3龄若虫后,与对照相比,从3龄若虫到羽化为成虫的时间显著延长了0.4 d(P=0.006),且成虫羽化率显著下降17.1%(P=0.005)。LC15的烯啶虫胺处理3龄若虫后雌虫寿命从17.7 d显著降低到14.5 d(P=0.002),但雄虫寿命反而从15.8 d显著增加到19.0 d(P=0.014)(图2)。雌虫的单雌产卵量(176.4粒)相对于对照(226.6粒)显著下降(P=0.001)、产卵期相比对照也显著缩短1.4 d(P=0.021)(图3)。
2.3 烯啶虫胺亚致死浓度对子代褐飞虱适合度的影响
LC15的烯啶虫胺处理褐飞虱3龄若虫后,与对照相比,子代若虫期显著缩短0.7 d(P=0.026)。这主要是5龄若虫的历期由5.2 d显著缩短到4.8 d(P=0.037)所致,而其他龄期发育期与对照相比均无显著差异(P>0.05)(表2)。
子代产卵期和单雌产卵量(孵化若虫数量)与对照之间均无显著差异(P>0.05)(图4),子代成虫寿命不论雌雄均与对照组之间无显著差异(P>0.05)(图5)。
LC15的烯啶虫胺处理后子代1龄至3龄若虫的存活率和成虫羽化率显著低于对照(表3),3龄至5龄若虫的存活率、雌虫比例、交配率及单雌产卵量在处理组与对照组间差异不显著。LC15的烯啶虫胺处理后的子代种群数量趋势指数与对照无明显差异(表3)。
3 讨论
烯啶虫胺作为第二代新烟碱类杀虫剂,因为其防治效果好及褐飞虱对吡虫啉抗性的不断提升,而广泛应用于褐飞虱防治[31-33]。研究表明,烯啶虫胺对于褐飞虱有很好的防治效果[22,34]。
亚致死剂量的杀虫剂对昆虫的生长发育、生殖力、行为和抗药性发展都会产生不同程度的影响[6]。一些研究表明,亚致死剂量的杀虫剂会刺激害虫增殖。如溴氰菊酯LC5处理后,褐飞虱产卵前期显著缩短、产卵期和产卵量显著增加,表现出显著的刺激增殖作用[35]。Zeng等[12]研究发现用LC30的吡虫啉和溴氰虫酰胺处理桃蚜能提高F1代的繁殖力。但更多研究表明亚致死剂量往往对害虫生长发育产生不利影响。例如亚致死剂量的氯虫苯甲酰胺和毒死蜱处理可显著降低甜菜夜蛾的化蛹率、蛹重、羽化率和单雌产卵量,从而对甜菜夜蛾种群的增长产生不利影响[7]。但即使是同一种药剂,不同的亚致死剂量以及处理后不同的世代也表现出不同的亚致死效应。Tang 等[11]研究表明,LC25的氟吡呋喃酮处理对F1代桃蚜具有显著刺激生殖的作用,但可抑制F2代的生长发育和繁殖。LC10的噻虫嗪可显著刺激桃蚜的繁殖力,但LC30处理则对桃蚜的生长发育和繁殖存在不利影响[36]。我们研究发现,烯啶虫胺的亚致死剂量LC15处理褐飞虱3龄若虫对处理当代的生长发育和繁殖均产生不利影响(图1~3、表2),从而抑制其种群发展。但在子代中,仅若虫发育历期、1~3龄若虫存活率和成虫羽化率有显著下降(图4~5、表3),即对子代的影响不如对处理当代的影响大。LC15的烯啶虫胺处理后子代的种群趋势指数是对照的96%(表3),表明对子代的适合度影响不大。与此不同的是,吡虫啉亚致死剂量处理褐飞虱后,子代种群适合度明显下降(为对照的0.838)[37]。由于子代发育历期缩短,烯啶虫胺亚致死剂量处理可能使褐飞虱产生再猖獗的可能。
本文研究结果对褐飞虱的有效控制具有一定的参考价值,但因为所用试虫为室内敏感种群,仍无法准确推测出烯啶虫胺亚致死剂量在田间施用后会对田间褐飞虱产生怎样的影响,且尚不明确连续多代处理对褐飞虱的效应,特别是对其耐药性或抗性发展会产生怎样的影响。另外,褐飞虱对烯啶虫胺的抗药性发展与P450多功能氧化酶和酯酶的活性上升有关[27],那么连续多代亚致死剂量处理会如何影响褐飞虱体内的解毒酶活性。这些问题都需开展进一步研究,以便为烯啶虫胺的合理使用和褐飞虱的适应性或抗性发展提供更多理论支持和科学依据。
参考文献
[1] GARROOD W T, ZIMMER C T, GORMAN K J, et al. Field-evolved resistance to imidacloprid and ethiprole in populations of brown planthopper Nilaparvata lugens collected from across South and East Asia[J]. Pest Management Science, 2016, 72(1): 140-149.
[2] 王笑见.抗倒伏和抗稻瘟病或抗褐飞虱水稻恢复系的创建[D]. 武汉:华中农业大学, 2014.
[3] ZHANG Xiaolei, LIAO Xun, MAO Kaikai, et al. Insecticide resistance monitoring and correlation analysis of insecticides in field populations of the brown planthopper Nilaparvata lugens (stl) in China 2012-2014[J]. Pesticide Biochemistry and Physiology, 2016, 132: 13-20.
[4] BOINA D R, ROGERS M E, WANG Nian, et al. Effect of pyriproxyfen, a juvenile hormone mimic, on egg hatch, nymph development, adult emergence and reproduction of the Asian citrus psyllid, Diaphorina citri Kuwayama [J]. Pest Management Science, 2010, 66(4): 349-357.
[5] 李会仙,郝赤,王利英,等.高效氯氰菊酯和溴氰菊酯对棉铃虫的亚致死效应[J]. 山西农业大学学报(自然科学版),2005(2):231-233.
[6] DESNEUX N, DECOURTYE A, DELPUECH J M. The sublethal effects of pesticides on Beneficial Arthropods [J]. Annual Review of Entomology, 2007, 52(1):81-106.
[7] 馬冲,路兴涛,刘震,等. 氯虫苯甲酰胺、毒死蜱亚致死剂量对甜菜夜蛾生长发育和繁殖力的影响[J]. 植物保护,2012,38(4):38-41.
[8] ZHEN Congai, MIAO Ling, GAO Xiwu. Sublethal effects of sulfoxaflor on biological characteristics and vitellogenin gene (AlVg) expression in the mirid bug, Apolygus lucorum, (Meyer-Dür)[J]. Pesticide Biochemistry and Physiology, 2018, 144: 57-63.
[9] KANG Zhiwei, LIU Fanghua, PANG Ruiping, et al. Effect of sublethal doses of imidacloprid on the biological performance of aphid endoparasitoid Aphidius gifuensis (Hymenoptera: Aphidiidae) and influence on its related gene expression[J]. Frontiers in Physiology, 2018, 11(9): 1729.
[10] LI Wenqiang, LU Zengbin, LI Lili, et al. Sublethal effects of imidacloprid on the performance of the bird cherry-oat aphid Rhopalosiphum padi [J/OL]. PLoS ONE, 2018, 13(9): e0204097.
[11] TANG Qiuling, MA Kangsheng, CHI H, et al. Transgenerational hormetic effects of sublethal dose of flupyradifurone on the green peach aphid, Myzus persicae (Sulzer) (Hemiptera: Aphididae) [J/OL]. PLoS ONE, 2019, 14(1): e0208058.
[12] ZENG Xianyi, HE Yingqin, WU Jiaxing, et al. Sublethal effects of cyantraniliprole and imidacloprid on feeding behavior and life table parameters of Myzus persicae (Hemiptera: Aphididae) [J]. Journal of Economic Entomology, 2016, 109(4):1595-1602.
[13] GUEDES N M P, TOLLEDO J, CORRE^A A S, et al. Insecticide-induced hormesis in an insecticide-resistant strain of the maize weevil, Sitophilus zeamais [J]. Journal of Applied Entomology, 2010, 134(2): 142-148.
[14] GONG Youhui, XU Baoyun, ZHANG Youjun, et al. Demonstration of an adaptive response to preconditioning Frankliniella occidentalis (Pergande) to sublethal doses of spinosad: a hormetic-dose response [J]. Ecotoxicology, 2015, 24(5): 1141-1151.
[15] NANDIHALLI B S, PATIL B V, HUGAR P. Influence of synthetic pyrethroid usage on aphid resurgence in cotton [J]. Karnataka Journal of Agricultural Science, 1992, 5(3):234-237.
[16] MURALI-MOHAN A, CHRISTOPHER C G, SCOTT-DUPREE C D, et al. Transgenerational shifts in reproduction hormesis in green peach aphid exposed to low concentrations of imidacloprid [J/OL]. PLoS ONE, 2013, 8(9): e74532.
[17] 唐振华. 新烟碱类杀虫剂的结构与活性及其药效基团[J]. 现代农药,2002(1):1-6.
[18] 李敏,成四喜,李海屏,等. 新烟碱类杀虫剂烯啶虫胺述评[J]. 农药研究与应用,2012,16(2):1-5.
[19] ZHANG Xiaolei, LIU Xiangyang, ZHU Fuxing, et al. Field evolution of insecticide resistance in the brown planthopper (Nilaparvata lugens Stl) in China[J]. Crop Protection, 2014, 58: 61-66.
[20] ZHANG Xiaolei, LI Dongyang, ALIA E, et al. The role of detoxifying enzymes in field-evolved resistance to nitenpyram in the brown planthopper Nilaparvata lugens in China [J]. Crop Protection, 2017, 94: 106-114.
[21] 肖汉祥,刘明津,李燕芳,等.广东稻区褐飞虱对烯啶虫胺和呋虫胺的敏感性测定[J].环境昆虫学报,2017,39(6):1369-1373.
[22] 张欧,王京安,顾辉,等.湖北省稻飞虱抗药性试验研究[J].湖北植保,2018(5):11-12.
[23] 余慧灵,向兴,袁贵鑫,等.溴氰虫酰胺亚致死剂量对甜菜夜蛾生长发育及体内解毒酶活性的影响[J].昆虫学报,2015,58(6):634-641.
[24] 倪珏萍.褐飞虱室内活性测定法的优化与应用[J].药科学与管理,2007,28(8):36-41.
[25] BAN Lanfeng, ZHANG Shuai, HUANG Ziyang, et al. Resistance monitoring and assessment of resistance risk to pymetrozine in Laodelphax striatellus (Hemiptera: Delphacidae)[J].Journal of Economic Entomology,2012,105(6):2129-2135.
[26] ZHANG Kai, ZHANG Wei, ZHANG Shuai, et al. Susceptibility of Sogatella furcifera and Laodelphax striatellus (Hemiptera: Delphacidae) to six insecticides in China [J]. Journal of Economic Entomology, 2014, 107(5): 1916.
[27] ZHANG Xiaomin, TAO Yunli, CHI H, et al. Adaptability of small brown planthopper to four rice cultivars using life table and population projection method[J/OL]. Scientific Reports, 2017, 7: 42399.
[28] 龐雄飞.种群数量控制指数及其应用[J]. 植物保护学报,1990,17(1):11-16.
[29] LIU Zewen, HAN Zhaojun. Fitness costs of laboratory-selected imidacloprid resistance in the brown planthopper, Nilaparvata lugens (Stl) [J]. Pest Management Science, 2010, 62(3):279-282.
[30] 刘泽文,韩召军,王荫长.褐飞虱抗有机磷品系的交互抗性及适合度研究[J].南京农业大学学报,2001,24(4):37-40.
[31] 李建,周彩荣,佘永红.新烟碱类杀虫剂——Nitenpyram [J].河南化工,2004(8):4-6.
[32] WANG Yanhua, CHEN Jin, ZHU Yucheng, et al. Susceptibility to neonicotinoids and risk of resistance development in the brown planthopper, Nilaparvata lugens(Stl) (Homoptera: Delphacidae)[J]. Pest Management Science, 2008, 64(12): 1278-1284.
[33] 孙慧,杨春河.新型杀虫剂烯啶虫胺[J].精细与专用化学品, 2009,17(11):16-18.
[34] 刘玉坤,陈宇,席春虎.5种药剂对稻飞虱防治效果评价[J].安徽农学通报,2018,24(8):57.
[35] 汤爱兵.溴氰菊酯对稻褐飞虱繁殖力的影响[J].江西植保,2007,30(2):70-71.
[36] WANG Pan, ZHOU Lilin, YANG Fan, et al. Sublethal effects of thiamethoxam on the demographic parameters of Myzus persicae (Hemiptera: Aphididae)[J]. Journal of Economic Entomology, 2017, 110(4): 1750-1754.
[37] 刘淑华,杨保军,刘双,等.亚致死剂量吡虫啉和吡蚜酮对褐飞虱生物适合度的影响[J].中国水稻科学,2012,26(3):361-364.
(责任编辑: 田 喆)
