一种高效的镰刀菌接种体制备方法
2020-06-08谢淑娜郝俊杰李保叶
谢淑娜 郝俊杰 李保叶


摘要 本文以玉米茎腐病人工接种所需的禾谷镰刀菌Fusarium graminearum和拟轮枝镰刀菌F.verticillioides为材料,比较了三角瓶、聚乙烯袋和牛皮纸袋内用谷物培养基制备接种体的差别。发现在牛皮纸袋内用孢子悬浮液接种玉米粒培养基可高效制备接种体。与三角瓶、聚乙烯袋相比,在牛皮纸袋中制备接种体表现生长点多、透气性好、菌丝生长快、污染率低、质量高、对存放环境要求不严的优点。这种方法可以为玉米茎腐病等相似土传病害的人工接种和病圃建造等提供高质量的接种体。
关键词 接种体; 镰刀菌; 牛皮纸袋; 玉米茎腐病菌
中图分类号: S 435.131.4 文献标识码: A DOI: 10.16688/j.zwbh.2019090
Abstract This study aimed at investigating the differences in flask, polyethylene bag and kraft bag to produce Fusarium graminearum inoculum and F.verticillioides inoculum on a corn grain medium in order to artificially inoculate maize and cause stalk rot. It was found that inoculum could be efficiently prepared by inoculating corn kernel medium with spore suspension in kraft paper bag. In comparison with flask and polyethylene bag, the inoculum in kraft bags has the advantages of many growing points, good air permeability, fast growth of mycelium, low pollution rate, high quality and lax storage environment requirements. This method can be used in rapid production of uniform inoculum on grain medium for soil-borne plant pathogen causing diseases.
Key words inoculum; Fusarium; kraft bag; pathogens of maize stalk rot
镰刀菌Fusarium是农业生产中比较多样且常见的病原真菌,能造成多种植物的根腐、茎腐和穗腐等;在田间病害循环中,该类真菌可在土壤、作物残体、寄主中存活,包括有腐生性存活、孢子扩散传播和侵染定殖寄主等不同生活阶段[1-2];比较常见的传播途径有种传、土传和气传等[3]。镰刀菌引起的土传病害是农业生产中的重要病害,如玉米茎腐病,可由禾谷镰刀菌F.graminearum、层出镰刀菌F.proliferatum和拟轮枝镰刀菌F.verticillioides单独或复合侵染引起[4];由假禾谷镰刀菌F.pseudograminearum引起的小麦茎腐病是近年来我国小麦生产上的一种重要病害[5],这些病害已成为我国黄淮海区域粮食作物上的重要土传病害。
对镰刀菌引起的土传病害研究有病原菌鉴定、致病力测定、种质资源抗性鉴定、抗性材料创制、抗性基因定位[6]等;选育和种植抗病品种是防控这些病害最经济有效的措施[7],其中有些环节需要人工接种鉴定,这就需要接种体的制备。就玉米和高粱茎腐病抗性鉴定来说,除了田间自然诱发鉴定以外,常用的人工接种鉴定方法有茎基部注射孢子液、牙签接种和土壤接种等[8-9],不同接种方法需要制备不同的接种体,接种体的制備质量直接影响鉴定结果的可靠性。
目前我国对玉米品种进行茎腐病的抗性鉴定采用土壤接种法,即接种时将玉米根系一侧土壤挖开(深约5~10 cm),将病原菌培养物20~30 g接种在露出的根系处,接种后覆土,并保持土壤湿润,以使病原菌能够正常侵染玉米根系组织并从内部向茎髓组织扩展[8]。这种方法通常需要制备大量的接种体,常用方法是将马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)平板上培养的病原菌菌丝块接种于经高压灭菌的玉米粒或小麦粒培养基上扩大繁殖,选用的容器有三角瓶或聚乙烯袋。在实际操作中,当需要鉴定的材料数量较多时,接种体制备工作量较大,且往往存在污染率高、制备速度慢、操作复杂、培养和存放不便等问题,特别是要求短期内需快速、大量制备接种体时就更加困难。传统的利用三角瓶或聚乙烯袋制备接种体,还表现操作不方便、透气性差、湿度大等导致菌丝生长受到抑制、繁殖周期长,且存放时间较长时会大量滋生杂菌,污染率很高,制备的接种体质量较差,由此会影响抗性鉴定的可靠性。
本文以引起玉米茎腐病的镰刀菌为材料,介绍一种将镰刀菌孢子悬浮液接种在牛皮纸袋中的谷物培养基上,快速、大量制备接种体的方法。这种方法可为与玉米茎腐病等相似土传病害的人工接种或病圃建造等提供高质量的接种体。
1 材料与方法
1.1 玉米粒培养基准备
将玉米粒先用水浸泡过夜,再在锅内煮50 min左右,淋水备用。
1.1.1 三角瓶内制备接种体
选实验室中常用且容量大的1 000 mL三角瓶,将水煮过的玉米粒装入三角瓶至约2/3处(约650 g),无菌透气封口膜封口后,121℃高压湿热灭菌1 h。
1.1.2 聚乙烯袋内制备接种体
将水煮过的玉米粒装入聚乙烯袋(10 cm×8 cm×30 cm)至约2/3处(约900 g),用聚乙烯袋上专用的套环和盖子封口,121℃高压湿热灭菌1 h。
1.1.3 牛皮纸袋内制备接种体
选择韧性较好的牛皮纸定制成长×宽×高为10 cm×8 cm×30 cm的双层袋子,内层袋子底部外侧粘一层防水不干胶加固,将袋子在121℃高压湿热灭菌30 min后,放烘箱内60℃烘干4 h。在无菌操作台中,将已在聚乙烯袋内灭菌过的玉米粒培养基装入灭菌的双层牛皮纸袋,装至牛皮纸袋约2/3处(约900 g)(图1)。
1.2 接种体的制备
选取本实验室保存的禾谷镰刀菌F.graminearum和拟轮枝镰刀菌F.verticillioides各1个菌株活化至PDA平板上,长出新鲜菌丝后,再转PDA平板上,25℃下培养3 d,待用。
禾谷镰刀菌和拟轮枝镰刀菌的孢子悬浮液制备方法相同,将PDA平板上培养的菌丝挑取10块左右(1 cm2)放入3%~5%的绿豆汤培养液中,每三角瓶150 mL绿豆汤,将三角瓶放摇床上摇72 h,温度25℃,转速180 r/min。镜检孢子浓度≥104个/mL即可使用,孢子悬浮液制备好后若不及时使用,可放4℃冰箱备用。在无菌操作台上将两种镰刀菌的孢子悬浮液分别接入三角瓶、聚乙烯袋和牛皮纸袋内的玉米粒培养基上,约30 mL/(瓶)袋,将瓶(袋)封口,牛皮纸袋口需对齐折叠,用发夹卡住,轻轻摇匀。每个处理接菌60(瓶)袋,全部摆放在室内架子上室温培养,摆放时不要太紧密,保持一定距离,利于通风透气。培养过程中若发现接种体被污染,及时清除。
1.3 接种体制备效果的调查
所有处理分别在接种后2、5、10、15 d和20 d进行调查,观察不同镰刀菌在玉米粒培养基上生长情况。调查接种体的污染率、菌丝在玉米粒上布满情况(菌丝布满率)及接种体的产孢情況。其中污染率(%)为污染瓶(袋)数占总瓶(袋)数的百分比;一粒玉米粒长满菌丝视为菌丝完全布满玉米粒,菌丝布满率(%)为瓶(袋)内菌丝布满玉米粒量占全部玉米粒量的百分比。三角瓶和聚乙烯塑料袋内制备的接种体透过瓶(袋)直接肉眼观察估测,牛皮纸袋的接种体在无菌操作台上打开调查。
由于禾谷镰刀菌在玉米粒上不产孢,所以只调查拟轮枝镰刀菌接种体的产孢情况。分别在接菌后10 d和20 d对每个处理随机选取10瓶(袋)无污染的接种体调查,在无菌操作台上每瓶(袋)取50 g接种体,取前将瓶(袋)内接种体摇晃混匀,放于三角瓶内加100 mL水,振荡5 min后用纱布过滤,对原始孢子液进行梯度稀释,用血球计数板检测孢子浓度,并用公式计算每g接种体上产孢量,每g接种体上产孢量(个/g)=[原始孢子液浓度(个/mL)×100 mL]/50 g。每个处理调查10瓶,取平均值。
2 结果与分析
2.1 接种体的生长情况
玉米粒培养基接菌2 d后调查,不同瓶(袋)内玉米粒均以每个孢子为生长点,瓶(袋)内上下全部玉米粒开始生长新鲜的细小白色菌丝,生长点多,且分布均匀,其长势非常旺盛。接种5 d后,玉米粒表面菌丝增多,菌丝颜色由白色稍变粉红色,在三角瓶和聚乙烯袋内,上部玉米粒菌丝明显比下部菌丝生长旺盛,而牛皮纸袋内所有玉米粒表面均长满菌丝,生长一致,都很旺盛,此时间段开始有杂菌污染。10 d后三角瓶和聚乙烯袋内菌丝长势会慢慢变弱,特别是下部玉米粒几乎不再长菌丝(图1),牛皮纸袋内制备的玉米粒表面菌丝变浓密,上下部接种体一致,玉米粒逐渐结成团,菌丝红色加深,此时间段污染杂菌污染率迅速增加。15 d和20 d后,三角瓶和聚乙烯袋内会出现少量水珠,内部湿度很大,菌丝越来越稀薄,上层玉米粒布满菌丝,下层玉米粒表面几乎没有菌丝(图1),有的接种体被细菌严重污染,几乎看不到菌丝,呈水浸状,打开有腥酸味,而牛皮纸袋制备的接种体,菌丝布满整个玉米粒,粒间通过菌丝结成团,颜色深红,打开无特殊味道,袋内湿度逐渐降低,污染率远低于三角瓶和聚乙烯袋。
2.2 接种体的污染情况
接菌后不同时间调查接种体污染率(图2),结果发现所有处理在接菌后2 d内均没有污染,之后污染率随时间的推移而增加,聚乙烯袋的接种体污染率增加幅度最快,三角瓶次之,牛皮纸袋最慢;接菌20 d后聚乙烯袋内禾谷镰刀菌和拟轮枝镰刀菌的接种体污染率分别为56%和62%,三角瓶内两种镰刀菌的接种体污染率分别为30%和36%,牛皮纸袋内的接种体污染率最低,特别是禾谷镰刀菌接种体在接菌后10 d时有4%的污染率,到20 d后污染率仍为4%,拟轮枝镰刀菌接种体在第5天调查有2%的污染率,20 d时污染率为12%。以上结果表明牛皮纸袋内的接种体污染率最低,且增加幅度最慢,三角瓶次之,聚乙烯袋的最高,禾谷镰刀菌的接种体污染率比拟轮枝镰刀菌的略低。
2.3 接种体在玉米粒上的菌丝生长情况
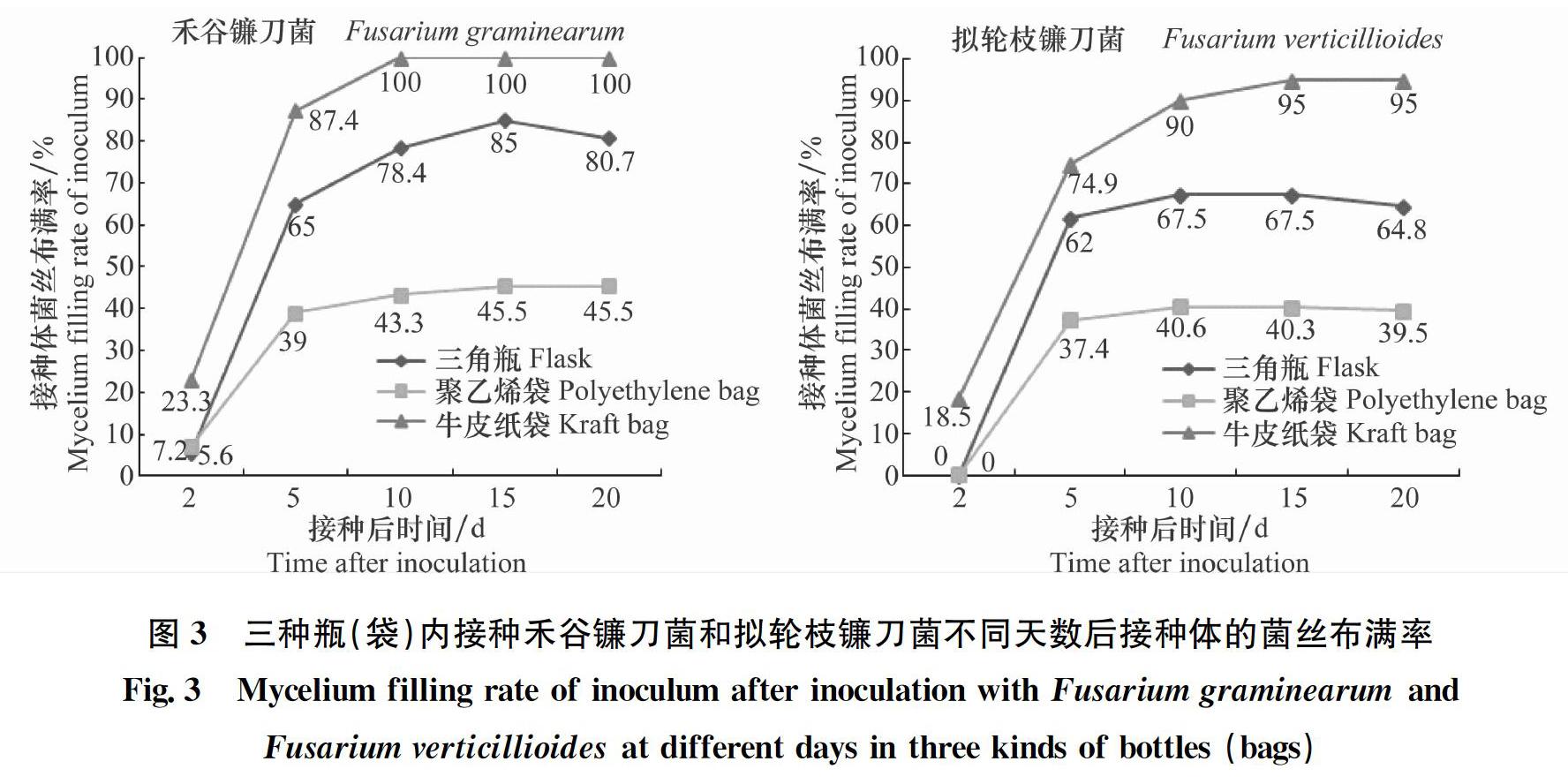
在玉米粒接菌后不同时间调查接种体菌丝布满率(图3),调查发现所有处理在接菌后5 d内,玉米粒表面菌丝布满速度很快,特别是牛皮纸袋内接种体的菌丝布满率最高,禾谷镰刀菌和拟轮枝镰刀菌接种体的菌丝布满率分别为87.4%和74.9%,三角瓶内接种体的菌丝布满率次之,两种镰刀菌接种体的菌丝布满率分别为62%和65%,聚乙烯袋的菌丝布满率最低,分别为39%和37%;接菌后10 d发现,牛皮纸袋内接种体的菌丝已全部布满菌丝,两种镰刀菌接种体的菌丝布满率分别为100%和90%,三角瓶的次之,为78.4%和67.5%,聚乙烯袋的最少,为43.3%和40.6%;接菌后15 d到20 d调查发现,聚乙烯袋的菌丝布满率不再增加,反而有下降的趋势,三角瓶内的禾谷镰刀菌接种体在15 d的菌丝布满率最高,为85%,之后便开始下降。总体来说,牛皮纸袋内的接种体菌丝布满率最高,三角瓶的次之,聚乙烯袋的最低,禾谷镰刀菌的接种体菌丝布满率比拟轮枝镰刀菌的略高。
2.4 拟轮枝镰刀菌接种体的产孢量
三种瓶(袋)内玉米粒接种拟轮枝镰刀菌后不同时间调查接种体产孢量,结果表明随着时间的增加接种体的产孢量不断增加,2、5、10 d三种瓶(袋)内接种体产孢量差别不大,到20 d时牛皮纸袋内的产孢量最高(2.6×109个/g),三角瓶内的产孢量次之(8.3×108个/g),聚乙烯袋内的产孢量最少(6×108个/g)(表1)。
3 讨论
广义的接种体包括植物的病残体、空气中的孢子、带菌的土壤等可能携带病原菌的载体,而用于人工接种鉴定的接种体通常需要经过一定程序的制备。土传病害根腐病和茎腐病人工接种鉴定的接种体多选用孢子悬浮液或谷物培养基[11-13]。目前,国内多数单位对玉米品种抗茎腐病的人工接种鉴定采用土壤接种法,其接种体制备一般选用小麦或玉米粒培养基,多数单位选用三角瓶作为容器进行制备,也有利用聚乙烯袋进行制备[9]。也有通过创伤后注射孢子悬浮液进行接种的报道[14],对高粱茎腐病的抗性鉴定多用牙签接种法[15],不同方法选用不同类型接种体。
玉米茎腐病的接种时期为玉米大喇叭口期至吐丝散粉期,在接种前需要完成接种体制备,而这时通常气温高、湿度大、空气中杂菌多,接种体制备过程中容易污染。特别是当需要制备较多接种体时,工作量大、时间紧迫,就可能影响接种体质量。本文以玉米茎腐病人工接种鉴定所需的接种体制备为例,选用禾谷镰刀菌和拟轮枝镰刀菌,比较了三角瓶、聚乙烯袋和牛皮纸袋内制备镰刀菌谷物培养基接种体的差别。由于传统的菌丝块接菌,操作不方便,接种体生长点少且不均匀,不适合大量制备接种体使用,所以本文选用孢子悬浮液接菌,每瓶(袋)装入玉米粒至自身体积的2/3处。结果表明前期瓶(袋)内接种体之间差别不大,菌丝生长都很旺盛;但随着时间的推移,不同瓶(袋)内接种体生长特性表现明显的差别。三角瓶和聚乙烯袋封口小、透气性差,后期因菌丝体增加,生长呼吸需要更多氧氣,造成内部空间湿度大,菌丝生长受到抑制,这时玉米籽粒可能由于灭菌不彻底,会滋生杂菌,时间越长污染越严重,造成菌丝生长势变弱,导致培养的接种体污染率高,菌丝布满率低、产孢量变小;而且传统三角瓶内制备接种体的方法在操作、存放和运输方面都不方便,三角瓶内制备接种体量也受限,为了防止存放期间接种体污染率继续增加,最好在低温下存放。而采用牛皮纸袋制备接种体,前期菌丝能快速布满玉米粒,由于牛皮纸袋透气性相对较好,能提供菌丝生长所需氧气,菌丝能很快长进玉米粒内部,可快速大量制成污染率低、菌丝布满率高、产孢量大的高质量接种体,正好可弥补三角瓶和聚乙烯袋的不足。此外,牛皮纸袋的使用方便、环保、存放节省空间、不易破碎、运输方便,对存放环境要求不高,制备的接种体若不及时使用,会自然风干,不需要另外采取措施存放,可常温放置备用,保持良好通风即可。通过我们实验室近几年的实际操作,发现可以加大牛皮纸袋体积,推荐的尺寸是18.5 cm×11.5 cm×32.5 cm,可以快速大量制备优质的接种体。
本研究中,选用了引起玉米茎腐病的主要病原菌禾谷镰刀菌和拟轮枝镰刀菌两个种的菌株,结果发现禾谷镰刀菌接种体比拟轮枝镰刀菌接种体污染率相对低,菌丝布满率高,这可能是由于拟轮枝镰刀菌本身的菌丝生长没有禾谷镰刀菌旺盛,所以外表观察拟轮枝镰刀菌的接种体没有禾谷镰刀菌的长势好。但拟轮枝镰刀菌可产孢,产孢量结果同样表明牛皮纸袋内制备的接种体质量最好。
在试验过程中,我们还用牛皮纸袋制备了玉米茎腐病的另一种重要病原菌肿囊腐霉菌Pythium inflatum Matthews[5]的玉米粒接种体,同样获得了高质量接种体,其方法同镰刀菌接种体制备。我们还发现牛皮纸袋也可以用于玉米小斑病(Southern corn leaf blight)和弯孢叶斑病(Curvularia leaf spot)的病原菌Bipolaris maydis和Curvularia lunata (Wakker) Boedijn在高粱粒培养基上接种体的制备,省略了传统方法中要求菌丝布满高粱粒后,用水洗去菌丝,然后平铺于垫有灭菌纸的瓷盘中保湿等环节。因为在牛皮纸袋内制备玉米小斑病菌或弯孢叶斑病菌接种体的过程中,由于其透气性好,在接菌约10 d后自然风干过程中会产生大量的分生孢子,接种约20 d左右可直接用于孢子洗脱及田间接种。此外,在牛皮纸袋内制备的接种体还可用于土传病害病圃的建造,也可尝试用禾谷镰刀菌F.graminearum制备的谷物培养基接种体早春撒播麦田,诱导产生子囊孢子,用于冬小麦赤霉病的抗性鉴定。
参考文献
[1] KUHNEM P R, SPOLTI P, DEL PONTE E M, et al. Trichothecene genotype composition of Fusarium graminearum not differentiated among isolates from maize stubble, maize ears, wheat spikes, and the atmosphere in New York [J]. Phytopathology, 2015, 105: 695-699.
[2] DEL PONTE E M, SPOLTI P, WARD T J, et al. Regional and field-specific factors affect the composition of Fusarium head blight pathogens in subtropical no-till wheat agroecosystem of Brazil [J]. Phytopathology, 2015, 105: 246-254.
[3] 赵廷昌, 冯凌云. 玉米茎腐病研究进展概述[J]. 辽宁农业科学, 1992(3):12-14.
[4] 孙静, 谢淑娜, 刘佳中,等. 河南省玉米茎基部镰刀菌的形态和分子鉴定[J]. 植物病理学报, 2014, 44(1): 8-16.
[5] LI Honglian, YUAN Hongxia, FU Bo, et al. First report of Fusarium pseudograminearum causing crown rot of wheat in Henan, China [J]. Plant Disease, 2012, 96(7): 1065.
[6] 吕国忠,陈捷,刘伟成,等.玉米茎腐病的病原菌与品种抗性[J].玉米科学,1995(S1):47-51.
[7] 吴海燕,孙淑荣,范作伟,等.玉米茎腐病研究现状与防治对策[J].玉米科学,2007,15(4):129-132.
[8] 李春霞,苏俊,龚士琛,等.玉米茎腐病接种方法的研究[J].玉米科学,2001,9(2):72-74.
[9] 王晓鸣.玉米病虫害田间手册-病虫害鉴别与抗性鉴定[M].北京:中国农业科学技术出版社,2010.
[10] 黃敏佳.高粱镰孢菌茎腐病研究进展[J].中国农学通报,2016,32(14):90-95.
[11] HWANG S F. Effects of VA mycorrhizae and metalaxyl on growth of alfalfa seedlings in soils from fields with “alfalfa sickness” in Alberta [J]. Plant Disease, 1988, 72: 448-452.
[12] ZHOU Qixing, CHEN Yongyan, YANG Yalong, et al. Effect of inoculum density and quantitative PCR-based detection of Rhizoctonia solani AG-2-1 and Fusarium avenaceum on canola[J]. Crop Protection, 2014, 59:71-77.
[13] YANG Qin, YIN Guangming, GUO Yanling, et al. A major QTL for resistance to Gibberella stalk rot in maize [J]. Theoretical and Applied Genetics, 2010, 121:673-687.
[14] MUIMBA-KANKOLONGO A, BERGSTROM G C. Transitory wound predisposition of maize to Anthracnose stalk rot [J]. Canadian Journal of Plant Pathology, 1990,12(1):1-10.
[15] ADEYANJU A, LITTLE C, YU J, et al. Genome-wide association study on resistance to stalk rot diseases in grain sorghum[J]. G3: Genes, Genomes, Genetics, 2015, 5:1165-1175.
(责任编辑: 田 喆)
